类风湿关节炎患者趋化因子CXCL9和CXCL10在骨侵蚀中的作用
2021-12-13徐丽玲白明欣
钟 华,徐丽玲,白明欣,苏 茵
(北京大学人民医院风湿免疫科,风湿病机制及免疫诊断北京市重点实验室,北京 100044)
类风湿关节炎(rheumatoid arthritis,RA)是一种以慢性破坏性多关节炎为主要临床表现的自身免疫性疾病,其基本病理改变包括关节滑膜炎、血管翳及骨破坏等,最终导致关节畸形和功能丧失[1]。我国RA的患病率为0.28%,患病人数达500万。未经正规治疗的RA患者3年的致残率达75%,是造成劳动力丧失的主要原因之一[2-3]。
趋化因子是一类相对分子质量为8×103~12×103的多肽物质,主要通过诱导免疫细胞与炎性介质的定向迁移、活化与发育发挥趋化作用,参与RA的组织破坏。有研究显示,趋化因子可能通过募集中性粒细胞、淋巴细胞,促进细胞与基质间相互作用、细胞骨架重构、血管生成及抑制上皮细胞凋亡等方式促进滑膜炎及血管翳的发生[4]。CXCL9和CXCL10是CXC亚家族的成员,由γ-干扰素(interferon γ,IFN-γ)诱导产生并作用于趋化因子受体CXCR3,主要对单核细胞和淋巴细胞具有趋化作用[5]。有研究发现,RA患者的滑膜液和滑膜组织中可检测到CXCL9和CXCL10的表达升高,提示其可能参与RA的发病[6-9]。然而,CXCL9和CXCL10在RA患者血清中的表达水平以及其与骨破坏的关系尚不清楚,值得进一步探讨。
本研究旨在通过酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测RA患者以及骨关节炎(osteoarthritis,OA)患者、健康人外周血清中CXCL9、CXCL10的表达水平,分析其与RA临床及实验室指标之间的关系,初步探讨其在RA骨侵蚀中的临床意义。
1 资料与方法
1.1 研究对象
连续纳入北京大学人民医院风湿免疫科自2018年1—6月住院的105例RA患者,其中女性81例,男性24例,平均年龄(56.33±14.41)岁。所有患者均符合2010年美国风湿病学会(American College of Rheumatology,ACR)修订的RA分类标准[10]。同时,选取年龄和性别相匹配的、符合2009年欧洲抗风湿病联盟OA诊断建议[11]的90例OA患者作为疾病对照组,选取在北京大学人民医院体检的健康体检者25例作为健康对照组。排除合并恶性肿瘤、严重感染、严重并发症(如心力衰竭或肝肾功能不全)及其他严重的血液系统、消化系统和内分泌系统疾病的患者。本研究经北京大学人民医院医学伦理委员会批准(2021PHB282-001),所有研究对象均签署知情同意书。
1.2 样本的采集和处理
空腹抽取各组患者及对照组静脉血4 mL,离心收集血清并分装,置-80 ℃冰箱储存以待检测血清CXCL9和CXCL10使用。
1.3 检测试剂及方法
采用ELISA法检测血清CXCL9和CXCL10水平,试剂盒购自美国R&D公司(DY392-05、DY266-05),具体操作步骤严格按照试剂盒说明书进行。
1.4 临床资料采集
详细记录RA患者的病程、肿胀关节数(swollen joint count,SJC)、压痛关节数(tender joint count,TJC)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、C反应蛋白(C-reactive protein,CRP)、类风湿因子(rheumatoid factor,RF)、免疫球蛋白(immunoglobulin,Ig)A、IgG、IgM以及抗环瓜氨酸多肽抗体(anti-cyclic citrullinated peptide antibody,ACPA)。
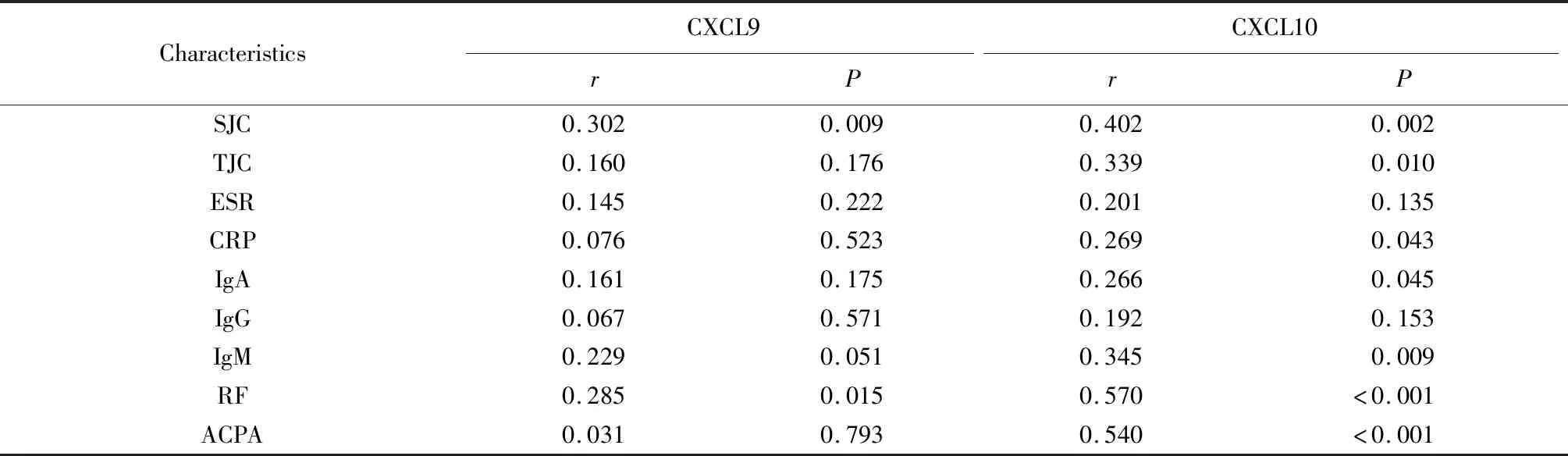
以关节疾病活动度评分(disease activity score 28,DAS28)评估RA患者的疾病活动度,根据欧洲抗风湿病联盟推荐的定义,DAS28>5.1为高度活动;3.2 应用SPSS 22.0软件对数据进行分析。计数资料以频数和构成比表示,组间比较采用卡方检验。计量资料采用Shapiro-Wilk进行正态性检验,符合正态分布的资料以均数±标准差表示,非正态分布的资料以中位数(四分位数间距)表示,组间比较根据是否符合正态分布,分别采用独立样本t检验和Mann-Whitney非参数检验。多组间计量资料采用Kruskal-WallisH检验,并采用Bonferroni方法对检验水准进行校正。相关性检验采用Spearman相关分析,采用单因素及多因素Logistic回归分析发生骨侵蚀的相关因素,将单因素分析中P<0.05的变量、临床疾病活动度和血清ACPA等指标共同纳入多因素变量模型。P<0.05为差异有统计学意义。 血清CXCL9和CXCL10水平结果显示,RA患者血清CXCL9 [250.02(126.98,484.29)ng/L]和CXCL10 [108.43(55.16,197.17)ng/L]水平均明显高于OA患者[165.05(75.89,266.37)ng/L,69.00(33.25,104.74)ng/L]及健康对照者[79.47(38.22,140.63)ng/L,55.44(18.76,95.86)ng/L],组间差异有统计学意义(H=26.13,P<0.001;H=20.97,P<0.001;图1)。 RA,rheumatoid arthritis;OA,osteoarthritis;HC,healthy controls.图1 RA患者、OA患者及健康人血清CXCL9和CXCL10的水平比较Figure 1 Serum levels of CXCL9 and CXCL10 in RA patients compared with osteoarthritis and healthy control groups 进一步分析RA患者血清CXCL9和CXCL10水平与临床特征及实验室指标的相关性发现,血清CXCL9水平与SJC及RF呈正相关(P<0.05),血清CXCL10水平与SJC、TJC、CRP、IgA、IgM、RF及ACPA均呈正相关(P<0.05),详见表1。 表1 RA患者血清CXCL9和CXCL10水平与临床特征及实验室指标的相关性Table 1 Correlation between serum CXCL9 and CXCL10 levels with clinical characteristics and laboratory parameters in RA patients 血清CXCL9和CXCL10水平与RA患者的DAS28评分呈正相关(r=0.301、0.364,P=0.011、0.006,图2)。高疾病活动度组(DAS28>5.1)的RA患者血清CXCL9水平[304.73(236.42,617.51)ng/L]、CXCL10水平[132.86(74.55,201.05)ng/L]分别显著高于中低疾病活动组(DAS28≤5.1)的CXCL9水平[175.39(107.29,481.13)ng/L]和CXCL10水平[60.03(30.84,156.21)ng/L],差异有统计学意义(P均<0.05)。 将骨侵蚀组与非骨侵蚀组RA患者的临床特征、血清学指标、疾病活动度及趋化因子水平进行比较,结果显示骨侵蚀组RA患者的病程更长,且血清CXCL9和CXCL10水平明显高于非骨侵蚀组,差异均有统计学意义(P<0.05,表2)。 表2 发生与未发生骨侵蚀的RA患者临床特征及实验室指标Table 2 Clinical and biochemical characteristics of RA patients with or without bone erosion 进一步将病程时间、血清ACPA水平、临床疾病活动度DAS28评分及血清CXCL9和CXCL10水平纳入多因素Logistic回归模型,分析结果显示,长病程、高疾病活动度及高血清CXCL9水平与RA患者发生骨侵蚀相关(表3)。 DAS28,disease activity score 28;RA,rheumatoid arthritis.图2 血清CXCL9和CXCL10与RA患者疾病活动度的相关性Figure 2 Correlation between serum CXCL9 and CXCL10 levels with disease activities in RA patients 表3 血清CXCL9、CXCL10水平与RA骨侵蚀的相关性分析Table 3 Multiple Logistic regression analysis of factors associated with RA patients with bone erosion RA是一种致残性、慢性、自身免疫性疾病,早期的组织病理表现包括滑膜细胞增生、间质炎性细胞浸润和血管翳形成,晚期可出现骨和软骨组织破坏、最终导致关节强直、畸形,表现为关节活动受限、功能丧失和生活质量下降。目前,临床上主要依靠影像学手段作为临床评估患者关节破坏的客观指标,虽然随着技术的不断进步,关节超声和MRI的应用已大大提高了RA患者骨侵蚀的早期检出率,但经影像学检查显示异常的患者即使临床症状和体征缓解,关节损伤的进程仍会持续进展。近年来的研究发现,RA患者在病程2年内的骨侵蚀发生率高达90%,且大部分患者在6个月内即开始出现骨侵蚀,而在第1年的骨质破坏进展要明显快于第2年和第3年[17]。本研究旨在探讨血清学指标与骨侵蚀发生的相关性,进一步探索早期监测RA患者骨关节破坏的风险指标。 趋化因子是一类细胞因子样分泌蛋白的超家族,包括CXC、CC、C及CX3C四个亚族,通过与靶细胞表面的受体结合发挥趋化作用,参与多种生理和病理过程,包括炎症、感染、免疫、肿瘤等[18]。既往研究显示,CXC亚家族在自身免疫性疾病中有明显的促炎效应,CXCL9和CXCL10均是CXC亚家族成员,由IFN-γ诱导产生,为趋化因子受体CXCR3的配体,两者结合后促进Th1细胞方向分化[19-20]。在炎症细胞中,单核/巨噬细胞和T淋巴细胞是CXCL9和CXCL10的主要来源。趋化因子选择性招募及活化炎症细胞进入滑膜组织中,介导炎症反应,从而在RA骨破坏中发挥重要作用。 CXCL9的编码基因位置与CXCL10基因紧邻[21],推测两者可能具有相似的功能。本研究结果表明,CXCL9在RA患者外周血中的表达明显升高,且与疾病活动性相关,Logistic分析提示CXCL9水平与RA发生骨侵蚀有关(OR=1.012,P=0.004)。CXCL9除了作为重要的趋化因子参与自体免疫性关节炎发病之外,也有研究报道其参与多种感染、肿瘤及免疫性疾病,如人类免疫缺陷病毒感染、病毒性肝炎、结直肠癌、乳腺癌、狼疮性肾炎、炎症性肠病及移植物抗宿主病等。目前,关于CXCL9对骨破坏的作用机制研究较少,随着人们对骨组织稳态的认识不断加深,CXCLs/CXCR3趋化轴在RA骨代谢中的作用可以作为未来进一步探索的方向。 与CXCL9相比,CXCL10在RA发病中的作用研究较多,但目前的观点并不完全一致。在炎性关节炎小鼠模型的滑膜组织中发现,CXCL10可通过刺激核因子κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL)及肿瘤坏死因子(tumor necrosis factor,TNF)在CD4+T细胞上的表达诱导RA骨破坏的发生,加入拮抗剂后小鼠骨关节的破坏程度明显降低,提示CXCL10可能与骨侵蚀的发生有关联[22]。但也有研究显示,并未在受累关节中发现CXCL10表达上的差异[23]。本研究结果显示,RA患者外周血清中CXCL10的表达水平显著高于健康对照人群,进一步的相关性分析提示,CXCL10与RF及ACPA滴度呈正相关,且高、低疾病活动度的患者组间CXCL10表达差异有统计学意义,高CXCL10水平组RA患者发生骨侵蚀的比例更高。以上结果进一步证实了CXCL10可以作为RA患者体内炎症活跃及骨破坏发生的提示指标,然而Logistic回归分析未证实这种关联(OR=0.996,P>0.05)。以上结果的不一致可能与病例选择的异质性有关,RA是一个长病程、多因素参与的复杂疾病,趋化因子在不同阶段发挥的主要作用会受到其他细胞因子的调节,因此,CXCL10与骨破坏之间的关系还需要进一步挖掘。 综上所述,RA患者血清中趋化因子CXCL9和CXCL10的表达水平升高,与RA疾病活动性及骨侵蚀具有相关性,可能是参与RA骨破坏的重要因子。本研究尚存在一定的局限性,一方面,横断面研究对因果关系的分析能力不足,尚不足以论证RA罹患骨侵蚀的危险因素;另一方面,具有完整影像学资料的例数较少且缺少随访数据。在后续研究中,可以进一步扩大样本量并设计随访队列完善对骨侵蚀的评估,明确CXCLs/CXCR3趋化轴在RA骨代谢中的作用机制。1.5 统计学分析
2 结果
2.1 RA患者、OA患者及健康人血清CXCL9和CXCL10水平比较

2.2 RA患者血清CXCL9和CXCL10水平与临床特征及实验室指标的相关性分析
2.3 血清CXCL9和CXCL10水平与RA患者疾病活动度的相关性分析
2.4 血清CXCL9和CXCL10水平与RA患者骨侵蚀的关系



3 讨论
