聚焦铁的冶炼
2021-12-12赵培龙
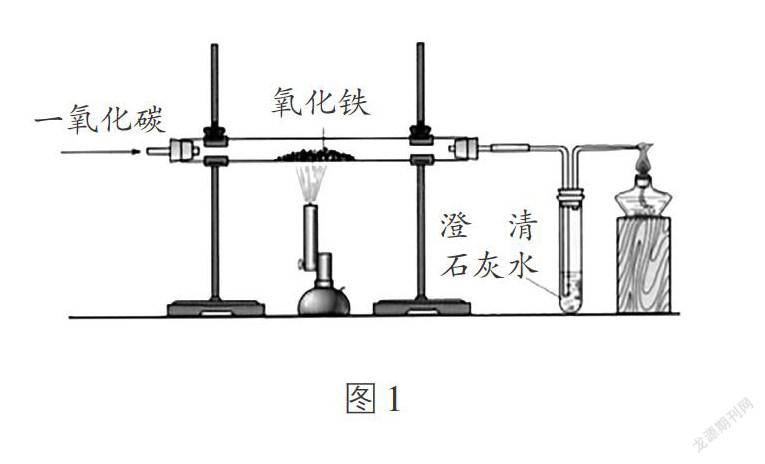

铁器的生产和使用是人类文明和社会进步的一个重要标志。铁的冶炼是初中化学的重点内容之一,也是中考命题的热点。下面加以总结归纳。
[夯实基础]
一、实验室模拟炼铁
1. 实验仪器:铁架台(带铁夹)、硬质玻璃管、酒精灯、酒精喷灯、试管等。
2. 实验药品:一氧化碳、氧化铁、澄清石灰水等。
3. 实验原理:在高温条件下,用还原剂一氧化碳将铁的氧化物(如Fe2O3)中的铁还原出来。化学方程式为:Fe2O3+3CO [ 高温 ] 2Fe+3CO2。
4. 实验装置:如图1所示。
5. 实验步骤:
(1)检查装置的气密性;
(2)将氧化铁粉末装入硬质玻璃管中央后,将硬质玻璃管固定在铁架台上;
(3)点燃右端的酒精灯;
(4)向硬质玻璃管中通入一氧化碳;
(5)点燃酒精喷灯,加热装有氧化铁的硬质玻璃管;
(6)熄灭酒精喷灯,停止加热;
(7)停止通入一氧化碳;
(8)熄灭右端的酒精灯。
6. 实验现象:硬质玻璃管中的红棕色粉末逐渐变为黑色,试管中的澄清石灰水变浑浊,玻璃导管尖嘴处产生蓝色火焰。
7. 注意事项:
(1)实验开始时要先通入一氧化碳,再点燃酒精喷灯,以排尽玻璃管内的空气,防止加热时发生爆炸。
(2)实验结束时,应先停止加热,并继续通一氧化碳直至装置冷却,以防止生成的铁又被空气中的氧气氧化;同时防止试管中的澄清石灰水倒吸进入灼热的硬质玻璃管内,使硬质玻璃管炸裂。
(3)一氧化碳有毒,不能直接排放到空气中,否则会污染空气,因此装置中必须有尾气处理装置。尾气处理可用收集法(用气球或排水法收集尾气)或燃烧法(将尾气点燃烧掉或用于加热氧化铁)。
二、工业高炉炼铁
1. 设备:高炉。
2. 原料:铁矿石、焦炭、石灰石、空气。
3. 原理:在高温条件下,用还原剂一氧化碳将铁从铁矿石中还原出来。高炉内有关反应的化学方程式为:C + O2 [ 高温 ] CO2, C + CO2 [ 高溫 ] 2CO,Fe2O3+3CO [ 高温 ] 2Fe+3CO2。
[实验拓展]
实验室模拟炼铁实验的改进
1. 改进装置(图2):
<E:\MXJ\2021PB\CZ21-25 初中生12期 中考版\12期 中考版 内文图片\21年12期化学第4篇:铁的冶炼实验-赵培龙-2C86\image4.jpeg>[甲酸][4mL 98%浓硫酸][80 ℃
热水][氧化铁][澄清石灰水][标记
位置][W形管]
图2
2. 实验步骤:
(1)检查装置气密性。如图2所示,连接仪器并添加药品,挤压胶头滴管的胶帽,若观察到集气瓶内的两根导管出现稳定的液面差(左低右高),则装置气密性良好。
(2)水浴加热。对W形管前端的浓硫酸进行80 ℃水浴加热。
(3)取下胶头滴管,吸取3 mL甲酸后连接于装置中。轻轻挤压滴管的胶帽,将甲酸逐滴滴加到浓硫酸中。
(4)当集气瓶内液面下降到标记位置时,点燃酒精灯,先预热,再固定位置集中加热。
(5)当红棕色粉末全部变黑且澄清石灰水变浑浊时,继续加热2~3分钟,而后熄灭酒精灯。
(6)用磁铁吸引管内黑色粉末,多余的尾气用集气瓶收集。
(7)后续处理:实验结束后,取下集气瓶,拿到安全之处,在老师的帮助下,拔掉双孔塞,立即点燃尾气。拆开其余实验装置,清洗并整理实验用品。
3. 改进优点:(1)甲酸在浓硫酸的催化下反应生成一氧化碳和水,所以本实验无须提前储存一氧化碳;(2)加入防倒吸装置,提升实验安全系数;(3)W形管还可应用于其他化学实验的改进中。
[实战演练]
(2021·四川·广安)利用图3所示实验装置模拟工业炼铁,下列说法正确的是( )。
A. 反应前后Fe元素的化合价由+2价变为0价
B. 充分加热,a处固体由黑色变为红色
C. b处可以用澄清石灰水检验生成的CO2
D. 可用水吸收尾气中的CO
解析:反应前氧化铁中Fe元素的化合价是+3价,反应后铁中Fe元素的化合价是0价,A错误;氧化铁是红棕色固体,铁是黑色固体,充分加热,a处现象是固体由红棕色变为黑色,B错误;可以用澄清石灰水检验生成的CO2,C正确;CO难溶于水,不能用水吸收尾气CO,尾气处理可用收集法或燃烧法,D错误。答案:C。
