天然免疫RIG-I 样受体LGP2在抗病毒免疫中的作用
2021-12-11张佳佳张友文刘学良夏能文朱建中
邵 琦,曹 琦,张佳佳,张友文,罗 佳,刘学良,夏能文,朱建中
(扬州大学兽医学院,扬州大学比较医学研究院,江苏省动物重要疫病与人兽共患病防控协同创新中心,农业与农产品安全国际联合研究实验室,江苏扬州 225009)
机体的免疫反应包括先天存在的天然免疫反应和高度特异的适应性免疫反应,二者相互作用共同抵御病原微生物的侵袭。在天然免疫反应中,宿主细胞的特异性受体能够识别病原相关分子模式(pathogen associated molecular patterns,PAMPs),从而诱导I 型干扰素(IFNs)和炎性细胞因子产生[1]。宿主细胞特异性受体被称为模式识别受体(pattern recognition receptors,PRRs),主要包括Toll 样受体(toll-like receptors,TLRs)、RIG-I 样受体(RIG-I like receptors,RLRs)、NOD 样受体(NOD-like receptors,NLRs)、C 型凝集素样受体(C-type lectin receptors,CLRs)和胞浆DNA受体(cytosolic DNA receptors,CDRs)等。
RLRs 作为细胞质中重要的PRRs,能够识别双链RNA 病毒[2],是抗病毒天然免疫与适应性免疫非常重要的组成部分。其家族有3 个成员:遗传与生理实验分子(laboratory of genetics and physiology 2,LGP2)、视黄酸诱导基因I(retinoic acid inducible gene I,RIG-I)和黑色素瘤分化相关基因 5(melanoma differentiation associated gene 5,MDA5)[3]。近年来,对RIG-I、MDA5 的功能研究很透彻,RIG-I、MDA5 可分别识别短链、长链RNA,从而诱导下游IFNs 产生;而LGP2 的功能尚不清楚,因此进一步探究LGP2 的确切功能很有必要。
1 RIG-I、MDA5 介导的信号通路
RLRs 家庭成员(RIG-I、MDA5 和LGP2),在分子结构上具有同源性,都具有识别病毒dsRNA 与水解腺嘌呤核苷三磷酸(ATP)的能力,但在酶活性、内在识别RNA 能力和活化机制等方面存在差异。在正常细胞中,RLRs 表达量较低,但在被病毒感染的细胞中,可被IFNs 激活。
RIG-I 作为胞质中识别病毒dsRNA 的传感元件,能够优先识别短链dsRNA(<300 bp)和5'端含有三磷酸基团的dsRNA(5'-triphosphorylated RNA,5'-ppp-dsRNA)[4]。MDA5 能够优先识别长链dsRNA(>1 000 bp),也能识别人工合成的dsRNA 类似物聚肌胞苷酸(polycytidylic acid,polyI:C)。RIG-I、MDA5 活化后都可诱导IFNs 表达,从而激活抗病毒免疫反应。RIG-I、MDA5 具 有3 个结构域:N 端串联Caspase 活化与聚合区域(caspase activation and recruitment domains,CARDs)、中 间RNA 解旋酶结构域(RNA helicase domain)和C 端调控或抑制结构域(C-terminal domain,CTD 或repressor domain,RD)。宿主细胞处于静息状态时,RIG-I、MDA5的CARDs 区与自身RD 结构域结合,此时二者处于非活化状态[5]。病毒感染宿主细胞时,RIG-I、MDA5 的CTD 结构域识别病毒dsRNA 并且发生构象上的改变,致使二者CARDs 区都被激活,进而活化下游含CARDs 区的信号接头蛋白——线粒体抗病毒信号蛋白(mitochondrial antiviral signaling,MAVS 或IPS-1/VISA/Cardiff)[6]。活化的MAVS 能够激活TRAF3(TNF receptor associated factor 3)和TRAF2/6(TNF receptor associated factor 2/6)。其中:TRAF3 进一步激活TBK1、IKKε 蛋白激酶,二者通过磷酸化激活转录因子IRF3/7(interferon regulatory Factor 3/7)诱导IFNs 产生[7];TRAF2/6通过与RIP1(receptor interacting protein 1)、TRADD(TNF receptor type 1 associated death domain protein)、Caspase 8/10 相互作用进一步激活IKK 复合物(IKKα/IKKβ/IKKγ),从而激活核因子κB 蛋白(nuclear factor kappa-B,NF-κB),诱导产生炎性细胞因子。IFNs、炎性细胞因子和其他抗病毒产物共同作用产生抗病毒效应[8]。图1 是依据文献[14-15,23-25,29]绘制的LGP2 双向调控RLRs 介导的天然免疫信号通路。
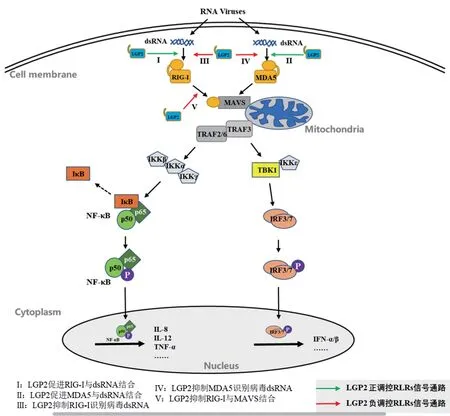
图1 LGP2 双向调控RLRs 介导的天然免疫信号通路
2 LGP2 结构特征及其在RLRs 介导信号通路中的作用
根据遗传学与生理学研究[9],人类LGP2 蛋白由17 号染色体上的DHX58基因编码。DHX58基因全长共11 329 bp,包含14 个外显子与13 个内含子。LGP2 蛋白由678 个氨基酸组成,相对分子质量约为75 kDa。LGP2 作为RLRs 家族的一员,与RIG-I、MDA5 具有显著的结构相似性,但其对病毒dsRNA 的识别能力与RIG-I、MDA5 有所差异[10]。
LGP2 具有与RIG-I、MDA5 相同的DExD/H 盒、中间解旋酶结构域和CTD 结构域,这使其可以识别并结合病毒dsRNA。但与RIG-I、MDA5相比,LGP2 缺少CARDs 区,因此不能与下游信号分子结合。但LGP2 可通过强大的结合病毒dsRNA 能力来调控RIG-I、MDA5 介导的信号通路。早期细胞转染试验研究[11-13]表明,LGP2 能负调控RIG-I、MDA5 介导的信号通路。此后利用LGP2缺陷(LGP2-/-)小鼠研究发现,LGP2 的ATP 酶结构域可以促进RIG-I、MDA5 对病毒dsRNA 的识别,从而正向调控RIG-I、MDA5 介导的信号通路(图1:I)[14]。进一步研究发现:LGP2 不仅具有双向调控作用而且具有一定的浓度依赖性,当细胞处于感染早期时,低浓度水平的LGP2 可以促进MDA5活化来抵抗病毒感染;而在感染后期,当LGP2 浓度升高时,则会抑制RIG-I、MDA5 的活化[15]。
近年来,生理性低浓度的LGP2 对MDA5 的正向调控作用已被广泛证实[16-18],其作用的生化机制与分子机制逐渐清晰[19-22]。在RLRs 家族成员中,MDA5 可与长链dsRNA 缓慢形成不稳定的纤丝,因此MDA5 与病毒dsRNA 结合能力较弱;而LGP2 结合dsRNA 与5'-PPP 和RNA 的长度无关,且不形成纤丝[23-24],因此LGP2 与病毒dsRNA 结合能力最强。另外,LGP2 的ATP 水解酶活性区域不仅可以增强MDA5 与dsRNA 的初始结合,还可以使MDA5 在dsRNA 上形成短纤丝并保持稳定,从而提高MDA5 的生理活性(图1:II)。Li 等[25]的研究同样发现,猪LGP2 可与MDA5 相互作用,增强MDA5 与dsRNA 的结合能力,从而正向调控MDA5 介导的信号通路。
另一方面,LGP2 能够通过多种方式抑制RIG-I 介导的信号通路(图1:III)。其C 端RD结构域可与RIG-I 的RD 结构域结合形成异二聚体复合物,抑制RIG-I 多聚化,从而抑制RIG-I 识别病毒dsRNA;LGP2 也可抑制RIG-I 与MAVS 结合(图1:V),进而抑制RIG-I 的信号传导[26]。另外,LGP2 还可通过抑制RIG-I 下游转录因子IRF3的活化从而发挥潜在的负调控[27]。近年来,有研究报道[28]称,多种RNA 解旋酶,例如DDX3、DHX29、DHX36 和DDX60,都参与了对RIG-I、MDA5 的正向调控作用。猪LGP2 产生的效应与上述RNA 解旋酶类似,很可能也正向调控RIG-I、MDA5 介导的信号通路[25]。
在不同物种中,LGP2 对RIG-I、MDA5 介导的信号通路发挥着相同的作用。在抗鸭病毒性肠炎(duck virus enteritis,DVE)试验中,研究发现LGP2 对MDA5 介导的抗病毒信号通路的调节是呈浓度依赖性的,低浓度的LGP2 能够增强MDA5介导的抗病毒作用,而高浓度的LGP2 则抑制了MDA5 的抗病毒作用[29](图1:IV)。在牛口蹄疫病毒(foot-and-mouth disease virus,FMDV)感染中,上述结论同样得到了印证,LGP2 在抗FMDV 中起着双向调控类似于平衡器一样的作用[30]。在青鱼抗草鱼呼肠病毒(grass carp reovirus,GCRV)和鲤鱼春季病毒血症病毒(spring viremia carp virus,SVCV)研究中发现,LGP2 本身对诱导IFNs 表达的作用不大,但低浓度的LGP2 可以导致MDA5介导的信号通路和抗病毒活性明显增强[31]。小鼠抗脑心肌炎病毒(encephalomyocarditis virus,EMCV)感染试验[32]表明,LGP2 在RIG-I、MDA5 介导的抗病毒信号通路中发挥正向调节作用。进一步的研究[33]表明,LGP2 的ATP 酶活性结构域在这种正向调节作用中扮演重要角色。
3 LGP2 在适应性免疫应答中的作用
LGP2 在天然免疫应答中发挥正、负调节作用的同时,在适应性免疫应答中同样也发挥着重要的调节作用。在适应性免疫应答中,LGP2 对CD8+T细胞的产生、分化、存活与凋亡发挥调控作用。T细胞增殖、存活与发挥效应需要Dicer(一种特定的核糖核酸内切酶)的参与,LGP2 能够与Dicer酶相互作用,促进T 细胞存活,提高其适应性[34]。
Kandasamy 等[35]试验发现,病毒感染宿主细胞时,LGP2 可以促进外周T 细胞增殖,增强外周T 细胞的免疫应答效应,提高机体免疫力。在MAVS-/-CD8+T 细胞试验中进一步发现,抗原刺激机体后,细胞内死亡受体(death receptor)介导的细胞凋亡通路被激活,在无MAVS 参与的条件下,LGP2 能够抑制该凋亡通路,维持CD8+T 细胞存活。图2 是依据文献[36]绘制的LGP2 调控CD8+T 细胞的存活与凋亡路径。

图2 LGP2 调控CD8+ T 细胞的存活与凋亡
最新研究[36]表明,LGP2 可通过两种机制调节CD8+T 细胞凋亡与抗凋亡:(1)激活T 细胞受体(T cell receptor,TCR),促进LGP2 过表达,而过表达的LGP2 通过与细胞表面受体Fas(factor related apoptosis,或称CD95/APO-1)相互作用,延缓CD8+T 细胞的凋亡进程(图2:I),从而维持CD8+T 细胞的正常功能。(2)机体受到抗原刺激后,LGP2 能够调节T 细胞微小RNA(microRNA或称miRNA)的合成,从而调控促凋亡因子的释放和T 细胞的存活。同时,LGP2 还能够协助CD8+T 细胞识别多种病毒RNA,清除体内的病原微生物[37]。
在自然界中,RNA 干扰机制(RNA interference,RNAi)高度保守且能够特异性识别具有同源序列的RNA,因此也可以看作为适应性免疫应答。在真核生物中,RNAi 只发生在病毒侵入宿主细胞且IFNs 途径受到抑制时,RNAi 可代替天然免疫清除病毒,使宿主细胞免受侵害。LGP2 在抗病毒RNAi 中通过两条途径发挥其调节作用:(1)病毒dsRNA 进入宿主细胞后,该dsRNA 可被Dicer 切割成多个小干扰RNA(small interfering RNA,siRNA),从而引起病毒RNAi产生,使病毒dsRNA 丧失侵染宿主细胞的能力;LGP2 能够抑制Dicer 对病毒dsRNA 的切割,对RNAi 介导的抗病毒作用进行负调控[38]。(2)反式激活反应区(TAR)-RNA结合蛋白(transactivating response RNA-binding protein,TRBP)对某些特定的miRNA 前体(pre-miRNA)具有结合偏好,TRBP 能够将pre-miRNA 募集到Dicer 上,加快形成成熟的miRNA,促进RNAi 机制产生,进而增强RNA 沉默效应(RNA silencing)[39]。病毒侵入宿主细胞后,LGP2 能够与pre-miRNA 竞争TRBP上的结合位点,抑制RNAi 效应,使下游细胞凋亡调控基因表达增强,促进细胞凋亡,从而抑制病毒增殖,发挥抗病毒作用[40]。
4 LGP2 在宿主应对不同病毒感染中的作用
4.1 双链DNA 病毒
双链DNA 病毒主要有腺病毒(adenovirus)、痘病毒(poxviruses)等。双链DNA 病毒感染宿主细胞后,病毒dsDNA 会利用细胞RNA 聚合酶进行转录。LGP2 不直接与病毒DNA 结合,而是在细胞RNA 聚合酶III 途径的下游(如5s rRNA、snRNA、tRNA 等)起作用,从而间接调节抗dsDNA 病毒反应。Zhu 等[41]用改良牛痘病毒(modified vaccinia virus MVA,Ankara)感 染LGP2-/-细胞,结果发现被感染的LGP2-/-细胞内细胞因子水平下降,poly(dA:dT)信号传导也受损。这表明LGP2 在RIG-I 介导的信号传导过程中起正向调节作用,并主要通过与RIG-I 及其下游MAVS相互作用而产生该效应。
4.2 单链DNA 病毒
单链DNA 病毒主要有猪细小病毒(porcine parvovirus virus,PPV)、鹅细小 病 毒(goose parvovirus virus,GPV)等。单链DNA 病毒感染可使RIG-I 的CARDs 区去磷酸化,导致CARDs区失活。LGP2 能够促进CARDs 区失活的RIG-I与非典型泛素链结合,从而诱导I 型IFNs 产生。正常情况下,RIG-I 被激活并寡聚化时,其CARDs区暴露并与下游MAVS 结合,进而激活TBK1、IKKε 蛋白激酶,启动I 型IFNs 转录,I 型IFNs 以自分泌与旁分泌方式与细胞受体结合,诱导细胞的抗病毒反应[42]。但过表达的LGP2 会与MAVS 相互作用,阻断该信号传导从而抑制抗病毒反应。
4.3 双链RNA 病毒
双链RNA病毒主要有呼肠孤病毒(reoviruses)、轮状病毒(rotavirus)等。研究[43-45]表明,LGP2 不能直接激活MAVS,但其正常表达可增强RIG-I、MDA5 对dsRNA 的识别能力,进而激活MAVS,产生炎性细胞因子和I 型IFNs。而Till 等[46]试验表明,过表达LPG2 能干扰RIG-I、MDA5 对病毒dsRNA 的识别。
伴随长久的遗传进化,鸡RIG-I(chRIG-I)已经缺失,但鸡LGP2(chLGP2)能正向调节鸡MDA5(chMDA5)介导的IFNs 合成与分泌。Esser-Nobis 等[47]试验表明,chMDA5 与chLGP2的相互作用能够补偿chRIG-I 缺失引起的功能丧失。最新结构分析显示,dsRNA 与chLGP2 的CTD 结构域、解旋酶结构域结合表现出类似于与RIG-I 末端结合的特性,这进一步阐明了chMDA5与chLGP2 识别病毒dsRNA 的机制。
4.4 正义单链RNA 病毒
正义单链RNA 病毒主要有脊髓灰质炎病毒(poliovirus)、冠状病毒(coronavirus)等。在正义RNA 病毒感染过程中,LGP2 通过上调调控凋亡的酶caspase-2、3、7、8 来促进细胞凋亡。Ohtani 等[48]用正义RNA 病毒感染细胞发现,与未感染病毒的细胞相比,正义RNA 病毒感染能够显著促进LGP2 表达,而过表达的LGP2 则会抑制机体的抗病毒反应。Miguel 等[49]发现,FMDV 能够抑制LGP2 的ATP 酶结构域活性,从而逃避机体的免疫反应,表明LGP2 参与对正义单链RNA 病毒的识别过程。
4.5 负义单链RNA 病毒
负义单链RNA 病毒主要有狂犬病毒(rabies virus,RV)、仙台病毒(Sendai virus,SeV)和流感病毒(influenza virus,IV)等。感染负义RNA 病毒时,LGP2 可作为IFNs 的诱导剂。但是Miyamoto 等[50]发现,LGP2 可以抑制由RV 感染引起的先天免疫反应。在体内外不同类型的细胞中,LGP2 对RV 感染的I 型IFNs 反应均有抑制作用。
在感染甲型流感病毒(influenza A virus,IAV)的小鼠中,LGP2 也会抑制IFNs 产生,这与调控失控性炎症反应密切相关[50]。最近,LGP2 还被认为与抑制Dicer 酶依赖的dsRNA 加工有关,从而抑制RNAi 现象发生。Chopy 等[51]试验发现,在感染高致病性H5N1 禽流感病毒番鸭的多个脏器中,鸭LGP2(duLGP2)表达水平升高,表明duLGP2 参与了抗病毒的早期免疫反应。Childs等[52]通过试验进一步发现,duLGP2 在鸭肠炎病毒(duck enteritis virus,DEV)感染中通过与MDA5相互作用而发挥功能。
5 展望
LGP2 是RLRs 家族的重要成员之一,能够参与病毒激活的免疫应答反应。虽然LGP2 缺少信号活性区域(CARDs),但其能够与配体dsRNA高度结合,发挥重要的调控功能。在调控RIG-I、MDA5 介导的信号通路与抗病毒免疫应答中,尚不清楚LGP2 发挥的确切功能和其作用机制,目前仍有一些争议。当前研究认为,LGP2 对RIG-I 和MDA5 介导的抗病毒信号通路具有双向调控作用,因此LGP2 被认为是调控RIG-I、MDA5 介导的信号通路的平衡器。至于LGP2 的调控作用是否与病毒结构有关尚未得到证实,是后续研究的重点。另外,最新研究[53]表明,LGP2 对抗原特异性T 细胞的生存和适应性也有重要作用。因此,未来可以进一步加深LGP2 在细胞免疫应答中的作用及机制研究。
