氧化物纳米材料表面结构与性质的固体核磁共振波谱研究
2021-12-10夏锡锋张文静林芝晔柯晓康温玉洁陈俊超彭路明
夏锡锋,张文静,林芝晔,柯晓康,温玉洁,王 芳,陈俊超#,彭路明
氧化物纳米材料表面结构与性质的固体核磁共振波谱研究
夏锡锋1,张文静2,林芝晔2,柯晓康2,温玉洁2,王 芳2,陈俊超2#,彭路明2*
1. 分析测试中心,南京理工大学,江苏 南京 210094;2. 介观化学教育部重点实验室和生命化学协同创新中心,化学化工学院,南京大学,江苏 南京 210023
氧化物纳米材料的多种应用与其表面结构和性质密切相关.近年来,固体核磁共振波谱在相关研究中提供了关键信息.本综述总结了近期发展的、以固体核磁共振波谱为主的两种表征氧化物纳米材料表面结构和性质的方法,包括表面选择的同位素标记17O核磁共振波谱与动态核极化表面增强核磁共振波谱,并对氧化物纳米材料的固体核磁共振波谱研究的发展趋势进行了展望.
氧化物纳米材料;表面结构与性质;氧-17;固体核磁共振波谱;动态核极化
引 言
纳米氧化物材料在催化、储能和环境等诸多领域应用广泛[1,2],其表面结构起着关键作用.纳米材料化学的研究进展表明,氧化物纳米材料的表面结构,如纳米氧化物暴露的晶面,决定了其催化活性和选择性[3,4].因此,发展先进的表征技术探究氧化物纳米材料表面结构与性能间的关系,对设计和开发性能更好的相关材料具有重要意义[5].
衍射法是表征固体物质最常用的方法,它能够提供材料长程有序的结构信息[6].然而,纳米材料的长程有序被其表面所打断,而且其表面常出现缺陷位,因此衍射法很难提供氧化物纳米材料的结构细节信息[7].电子显微镜技术是研究纳米材料最常用的手段,但它仅可针对样品的一小部分进行结构研究,其结果不一定能体现整个样品的情况,更无法得到定量的信息;此外,诸如氢和氧等起到重要作用的轻元素也很难通过电子显微镜技术探测[8].固体核磁共振(NMR)波谱可以有效弥补衍射法和电子显微镜技术的不足,能够针对特定原子核提取出材料局域结构的定量信息,兼具无损检测的特点[9],因此是表征固体结构与性质的理想手段.然而,固体表面物种含量低于体相[7],而NMR本质上是一个检测灵敏度较低的技术[10],这阻碍了固体NMR波谱在固体表面表征方面的应用.特别是对于氧化物材料,运用17O NMR进行表面研究还需要克服额外的困难,即17O极低的天然丰度(0.037%)[11],即便研究氧化物的体相结构一般仍需要进行17O同位素标记.以往更常用的方法是通过在氧化物上吸附探针分子,如三甲基膦(TMP)[12],再通过NMR波谱检测探针分子的信号研究氧化物的表面性质[13].然而,探针分子可能会改变氧化物的表面性质,也无法用于可探测实际反应过程的原位实验.
近期,表面选择同位素标记17O NMR与动态核极化表面增强NMR(DNP SENS)相结合的技术的发展,为高比表面的氧化物纳米材料的固体NMR研究提供了新的机遇.本文综述了近6年来固体NMR波谱在氧化物纳米材料表面结构和性质研究方面的重要进展.
1 17O NMR结合17O表面选择性同位素标记
17O的自旋量子数为5/2,是氧元素中唯一具有NMR活性的稳定同位素.17O化学位移范围超过1 000 ppm,是一个十分灵敏的结构探针.虽然17O NMR已用于研究多种纳米氧化物的体相氧[14],但是几乎没有相关论文涉及氧化物纳米材料表面氧的结构和性质.其主要原因是常用的高温17O同位素标记会导致纳米材料的烧结,不仅改变了氧化物纳米材料表面原子的排列方式,更使得表面原子比例显著降低,很难获得表面结构信息.
Wang等[15]以主要暴露{111}晶面的二氧化铈纳米颗粒(3 nm左右)为模型化合物,在相对较低的温度(523 K)下对材料进行了17O2同位素标记.二氧化铈纳米颗粒的大小在标记后没有出现明显改变,他们通过17O魔角旋转(MAS)NMR波谱成功地观察到三个之前研究未发现过的信号,分别位于O1 040、920和825(图1).这些信号的强度随着纳米粒子尺寸的增加而减小,表明这些信号来自表面物种.密度泛函理论(DFT)计算发现这三个信号分别归属为二氧化铈{111}面第一层(O1 040)、第二层(O920)和第三层(O825)的氧离子.这说明17O NMR结合低温17O同位素标记能够以极高的分辨率区分纳米氧化物表面不同层的氧物种.Wang等[15]还用17O富集的水(H217O)在更低温度(373 K)下对二氧化铈纳米材料进行标记.其17O NMR谱图中仅观察到表面羟基(O270)、第一层(O1 040)和第二层(O920)的氧离子.这表明选择合适的方法,可以选择标记表面氧物种,实现氧化物纳米材料表面的选择性观测.
图1 二氧化铈纳米颗粒的(a) 17O NMR谱图与(b) DFT计算的17O NMR化学位移[15]
基于上述表面选择的同位素标记策略,还能够探索多种氧化物的表面结构[5,16-22].Li等[5]结合17O NMR和DFT理论计算分别研究了锐钛矿型二氧化钛纳米片(NS001-TiO2)和纳米八面体(NO101-TiO2)的表面结构,结果显示两种样品的17O NMR谱图出现显著不同(图2).DFT计算可以得到可能的模型中表面各个氧物种的17O NMR参数(各向同性化学位移iso、四极耦合常数Q和不对称参数),利用这些参数模拟得到的NMR谱图与实验NMR谱图进行对比,可以得到符合真实情况的表面结构.结果表明在主要暴露{001}面的二氧化钛纳米片上,H2O发生解离吸附,且表面会发生重构;而在主要暴露{101}面的二氧化钛纳米八面体上,H2O发生分子吸附,且{101}面存在较高浓度的“台阶位”缺陷.上述发现说明可以借助17O NMR谱学区分氧化物纳米晶暴露的晶面,并给出有关晶面结构和性质的细节信息.
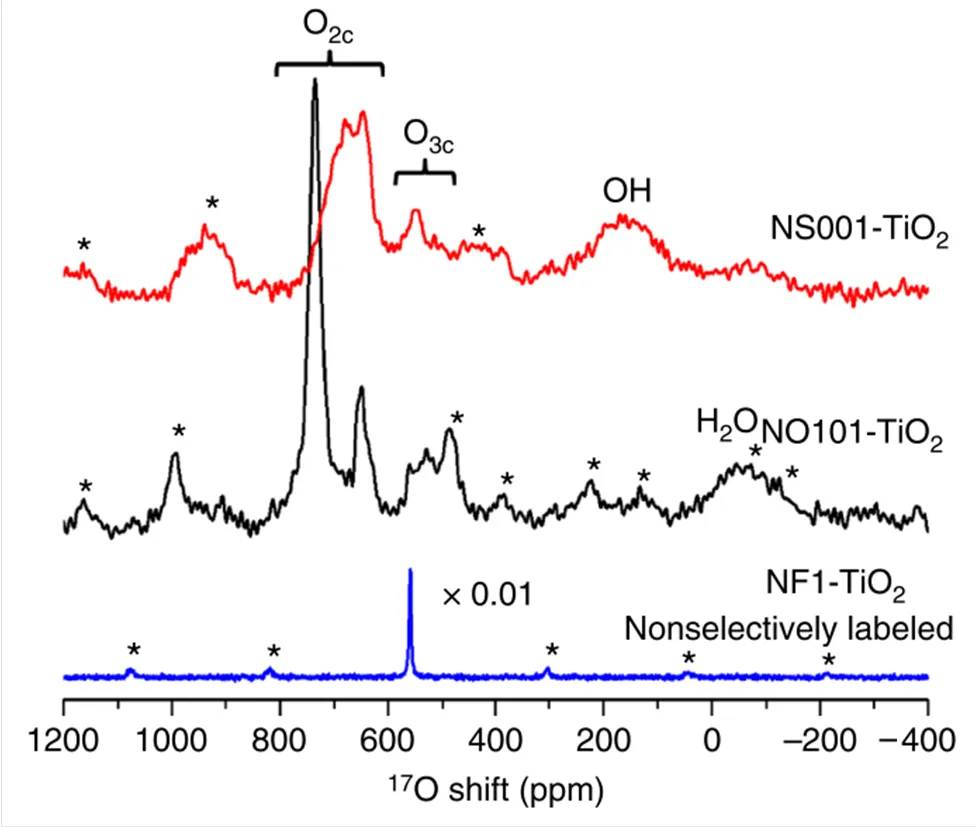
图2 H217O标记的二氧化钛不同纳米结构的17O NMR谱图[5]
Chen等[16]随后以暴露{100}极性晶面的二氧化铈纳米立方块(NCs)为例,结合17O和1H NMR,以及DFT计算,发展了定量表征氧化物纳米材料极性晶面精确结构的新方法.将NCs分别与17O2和H217O在523 K和373 K下进行17O同位素标记,得到了低表面选择性标记的NCs-17O2和高选择性表面标记的NCs-H217O.两种样品的17O NMR谱图呈现出显著差异(图3),而定量的1H NMR谱图则表明两种样品表面H含量不同.在同时考虑表面H和表面重构的CeO4-t结构后,结合DFT计算,顺利归属了1H和17O的NMR信号.研究结果显示,二氧化铈{100}晶面上同时存在O-t和重构的CeO4-t两种局部结构,且CeO4-t与羟基物种共同补偿了二氧化铈{100}晶面的极性.在借助1H NMR谱学对桥羟基(-OHB)和端羟基(-OHT)的含量进行确定的基础上,还能推算出NCs上两种局域结构(O-t和CeO4-t)的相对含量.
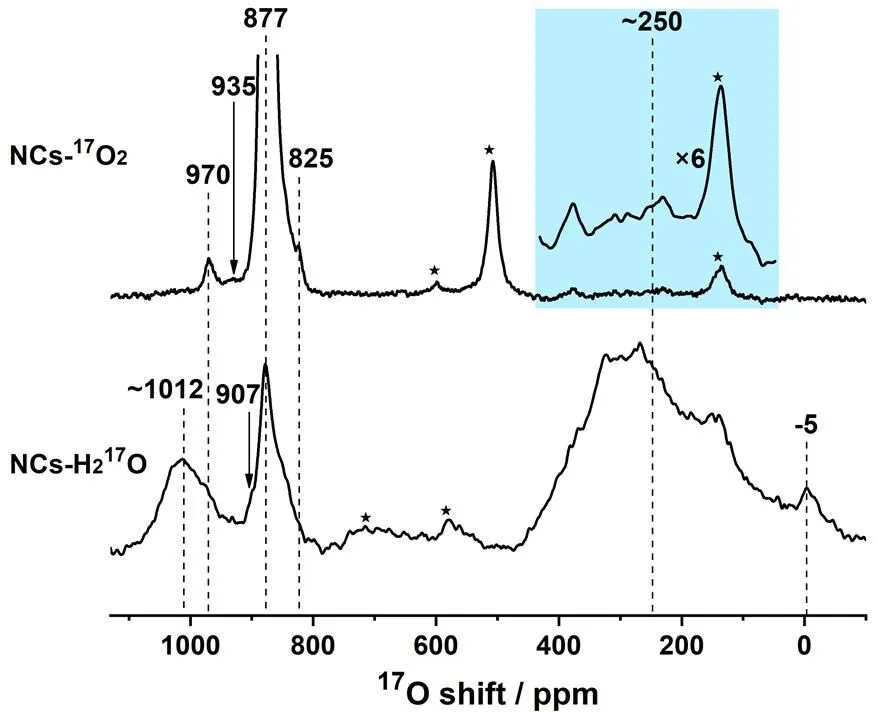
图3 17O2和H217O标记的二氧化铈纳米立方块的17O NMR谱图[16]
Chen等[17]又以主要暴露{111}晶面的二氧化铈纳米棒(NRs)为例,探索了水和纳米氧化物界面的相互作用.将NRs与H217O在不同温度下(室温~423 K)进行17O同位素标记,这些样品的17O NMR化学位移随温度变化呈现出显著差异(图4).定量1H NMR谱图表明这些样品表面分子吸附的水含量随着17O同位素标记温度升高而降低,而解离吸附的水含量则保持不变.变温固体NMR测定的纵向弛豫时间和DFT计算的能量证明了水分子与表面晶格氧的瞬时配位与断裂非常容易发生,这些水分子在氧化铈{111}晶面的快速运动是导致17O NMR化学位移变化的原因.这些研究为考察水和氧化物之间的相互作用提供了一种新方法.

图4 含水的二氧化铈{111}晶面模型与对应的17O NMR谱图[17]
Shen等[18]通过在-三氧化二铝纳米棒上吸附富含17O的水,借助1H和17O NMR研究了水与氧化物的相互作用.由于1H和17O核均主要位于氧化物的表面,因此能够通过1H和17O NMR实现表面的选择性实时监测(图5).结合超高场(35.2 T)27Al NMR以及双共振NMR实验结果,发现纳米棒与水接触后,表面上的羟基物种很快形成.水分子中的氧原子和裸露在-三氧化二铝表面的氧会发生快速交换,显示了表面氧物种的高反应性.这些结果为-三氧化二铝表面的结构和动态变化提供了新的见解.
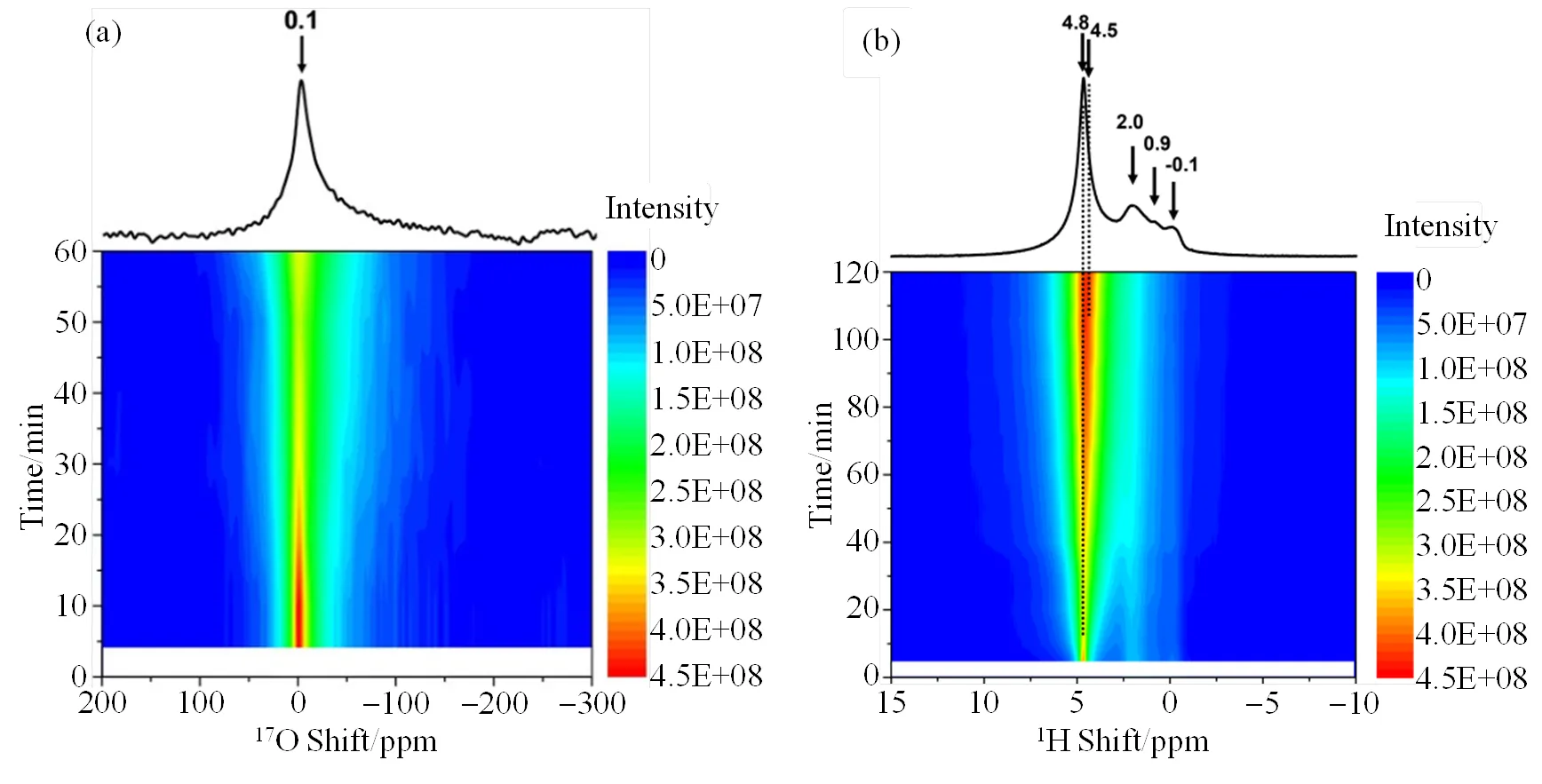
图5 水与g-三氧化二铝纳米棒相互作用的(a) 17O与(b) 1H NMR时间分辨谱图[18]
相较于二氧化铈和氧化钛中的氧物种,-三氧化二铝中氧的四极相互作用较强,谱图不可避免地显著宽化.Wang等[23]提出了一种使用超高场降低谱线宽化和提高分辨率,以区分-三氧化二铝中氧物种的策略.2D17O双量子-单量子同核相关NMR实验在35.2 T的超高磁场下进行,揭示了不同氧物种从体相到表面的空间邻近性(图6).此外,2D异核相关的NMR实验能够快速识别和区分表面羟基和(亚)表面的氧物种.Wang等的实验结果揭示了-三氧化二铝中氧离子的分布规律,为后续研究四极作用强的氧化物中的氧物种奠定了基础.
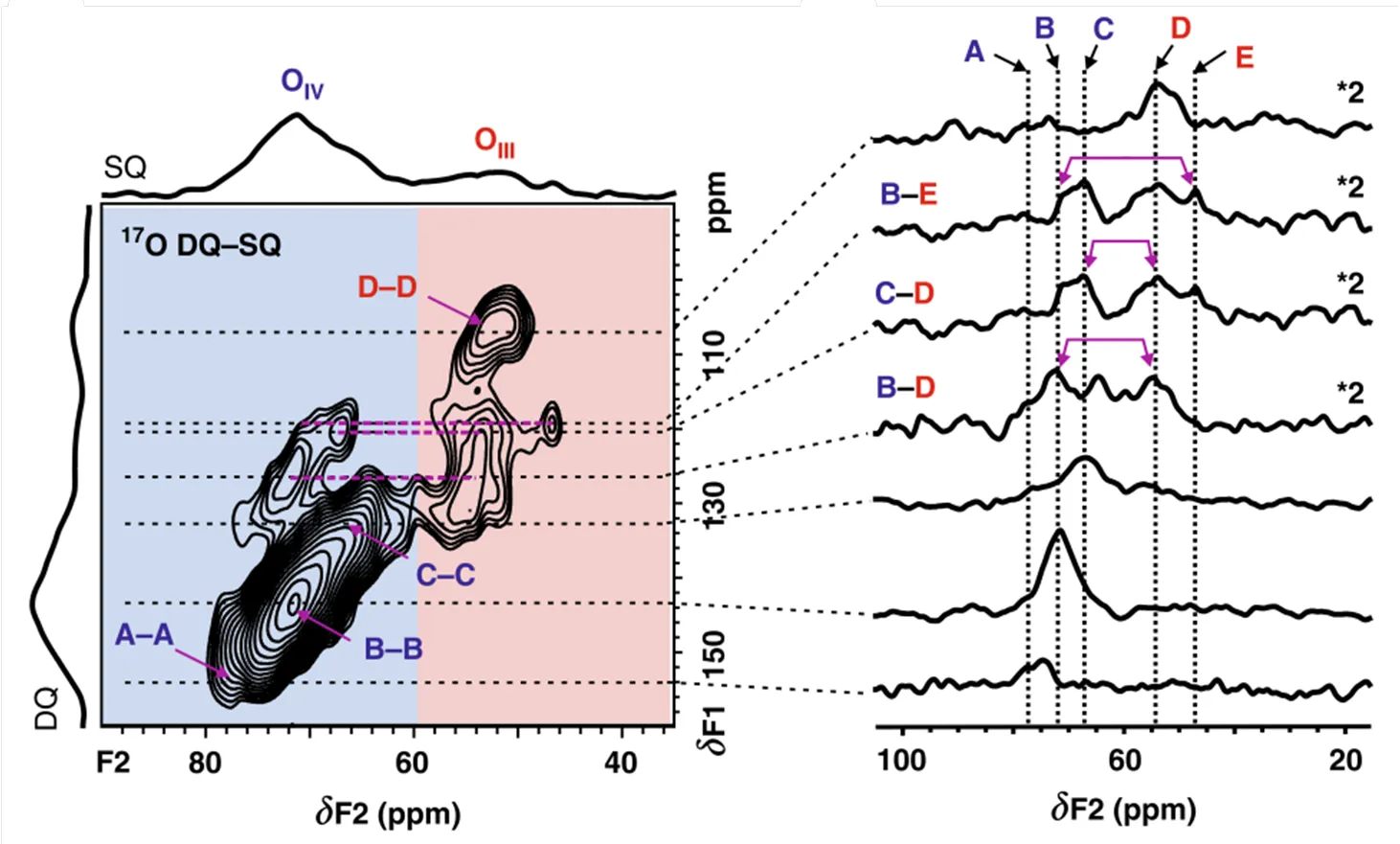
图6 通过2D 17O 双量子-单量子NMR实验探测g-三氧化二铝中氧与氧的邻近性[23]
由于17O NMR能够区分表面和体相氧物种,所以这一谱学方法应能够监测升温时氧化物表面氧物种向体相迁移的动态过程.例如,Wang等[15]发现在423 K或以上,二氧化铈纳米粒子表面氧可以与体相氧物种发生显著的交换.Shen等[21]研究了单斜相和四方相的二氧化锆纳米颗粒中的体相和表面氧的交换,发现在473 K或以上,单斜相二氧化锆纳米颗粒表面氧会向体相扩散,而对于四方相的二氧化锆纳米颗粒,这一过程在373 K就可以显著发生(图7).这些结果将有助于理解氧化物离子导体中氧离子传导的机理和设计更好的氧化物燃料电池电解质材料.
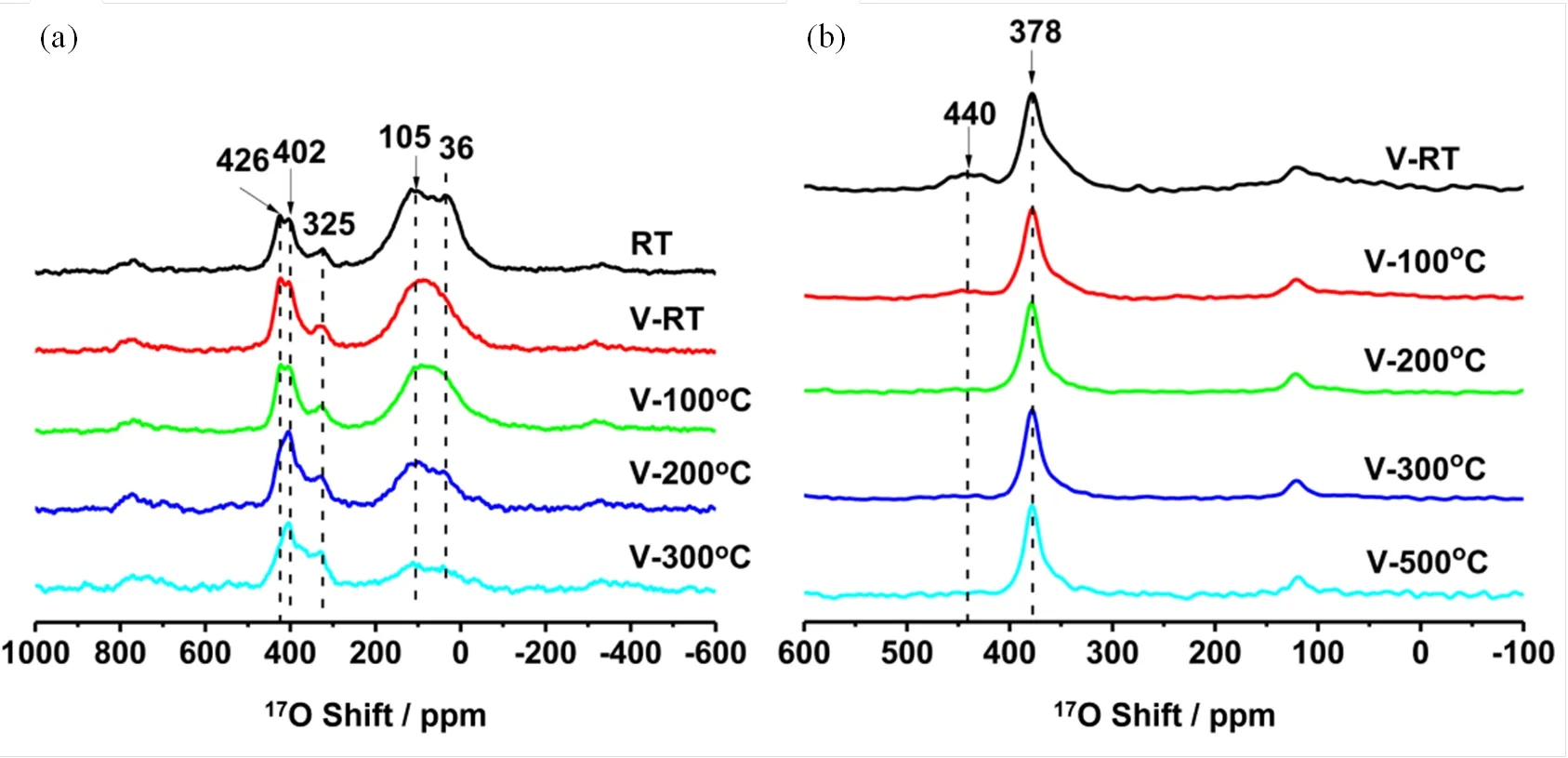
图7 (a)单斜相和(b)四方相二氧化锆的表面氧向体相扩散的17O NMR谱图[21]
表面选择的17O同位素标记结合17O NMR[15]的方法也可用于检测纳米氧化锌晶体中晶格氧与表面水中氧的动态交换过程.Champouret等[19]使用纳米氧化锌作为模型化合物,区分了其中不同氧的化学环境,并证明了氧化锌纳米晶与来自水中的氧存在动态交换(图8).这种交换不仅涉及表面原子,还涉及位于氧化锌内部更深处的氧离子,因此Champouret等提出了一种干/湿交替处理氧化物样品的策略,可以大大提高金属氧化物纳米晶的稳定性.
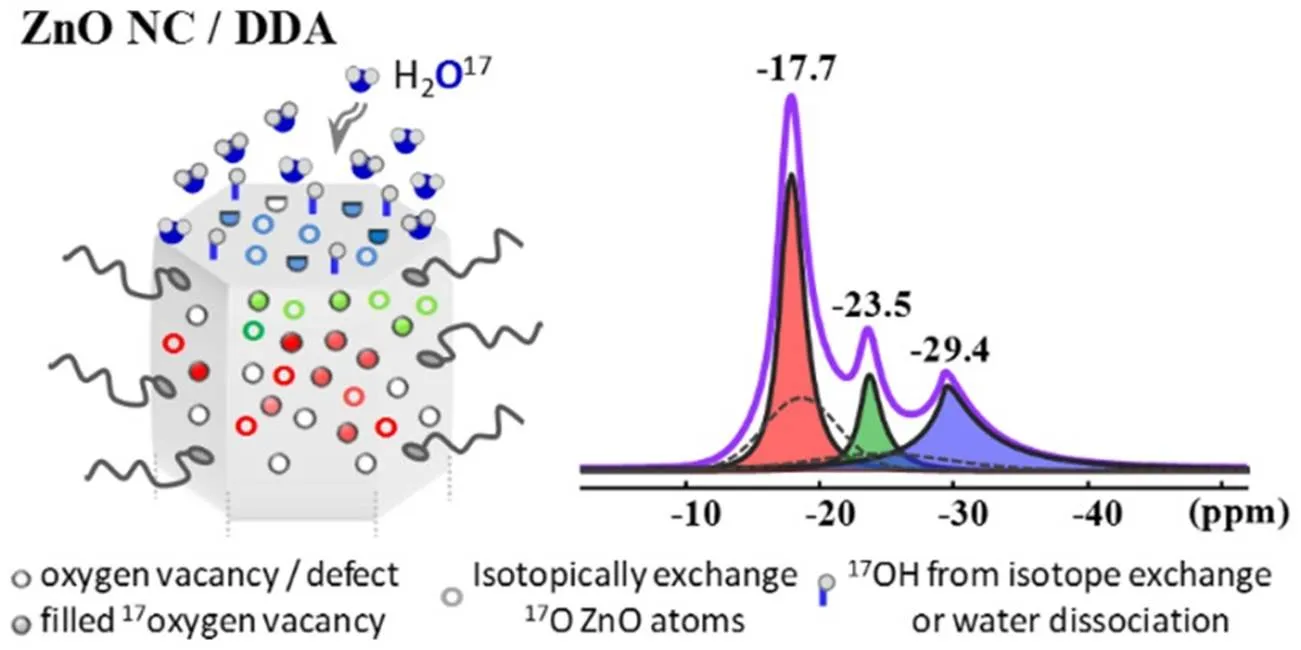
图8 氧化锌纳米晶中不同氧原子的示意图[19]
此外,一些部分还原的氧化物也在催化等应用中体现出不错的性能[24],该类材料也可以通过上述方法进行研究.Li等[22]结合17O NMR和电子顺子共振(EPR)研究了部分还原二氧化钛纳米材料的表面结构.EPR结果显示,部分还原二氧化钛的顺磁物种(由于氧空位产生的Ti3+)含量远高于非还原样品,且EPR信号的强度受吸附水含量的影响.非还原与部分还原样品的17O NMR谱中,除了表面低配位氧的信号有明显差异外,还发现在部分还原的样品表面存在更多的羟基,表明该样品表面存在较高比例的高能{001}晶面.1H-17O交叉极化(CP)和二维异核相关NMR谱则能够确认吸附的水和羟基物种的归属.这些表面结构的差异反映在两种材料光降解甲基橙的性能差别上.
2 DNP SENS技术
DNP通过施加微波辐照诱导未成对电子的自旋极化转移到所观测的原子核上[25],可以实现NMR信号强度的增强.虽然DNP的原理早被知晓,然而直到最近,DNP才被用于提高样品表面NMR信号的强度,实现表面增强NMR波谱(SENS).例如利用DNP SENS可以显著提升杂化二氧化硅材料表面信号的强度[26].DNP SENS实验通常需要将双自由基(例如TOTAPOL[27])溶解在D2O/H2O中,用混合物浸润待测固体样品,并使用一个可产生强微波的回旋管以持续引发双自由基中未成对电子共振,继而将高度极化的电子自旋转移到核上[28].此外,为了使得极化转移实现高效率,DNP SENS实验需要在非常低的温度(~100 K)下进行.
DNP SENS实验可以通过两种方式进行:直接极化和间接极化.在前一种情况中,未成对电子的自旋极化直接转移到被观测核;间接极化是指将电子的自旋极化首先转移到1H核上,随后通过CP方式再转移至被观测核.通过两种方式采集到的粘土纳米颗粒的29Si DNP SENS数据[29]提供了不同的结构信息:直接极化DNP有利于观测顺磁中心附近的29Si物种;而由于CP和1H的自旋扩散,间接DNP能够观测到离顺磁中心更远的29Si物种.因此,应根据特定需求选择DNP实验的方式.
很明显,17O DNP SENS应能作为一种普适的方法研究纳米氧化物材料的表面结构.17O DNP SENS首次应用是在针对17O标记的氧化镁、氢氧化镁和氢氧化钙的研究中[30],分别通过直接和间接极化两种方式进行了信号采集.结果显示,样品的17O NMR谱峰强度尽管获得了较大的增强,但氧化镁纳米粒子中的表面(O42)和体相(O47)氧位点的信号得到同等强度的增益,没有实现选择性观测.Perra等[31]采用相移重耦(PRESTO)的极化转移技术改进了17O DNP SENS的灵敏度[32],使之具有表面选择性,从而克服了传统CP转移存在的问题.
Hope等[33]将主要暴露{111}面的二氧化铈纳米颗粒为模型化合物,首次证明了直接17O DNP SENS结合17O选择性同位素标记能够高选择性地区分二氧化铈最表面的三层氧物种.这种选择性源于17O的自旋极化只能缓慢扩散到体相氧核中,因此只有表层/亚表层的氧离子被表面自由基中的未成对电子极化.不同信号的时间累积曲线和不同标记程度样品间的比较也证实了此技术具有表面选择性(图9).虽然间接DNP可用于识别二氧化铈表面上的羟基和吸附的水,但由于表面附近质子的匮乏以及远距离1H-17O CP的低效,因此无法通过间接DNP观测上述表层/亚表层氧位点.
Chen等[16]也通过DNP SENS研究了主要暴露{100}极性晶面的NCs.对于NCs-17O2和NCs-H217O,体相信号(O875)的强度增益为5.2倍.对于NCs-17O2,其它信号(如位于O970处信号)强度的增益大约是8倍,而在NCs-H217O无微波辐照的谱图中没有观察到任何其它信号,表明超极化作用对这些信号的增益比对体相信号更大,从而证实了这些信号确实来源于表面氧物种.DNP纵向弛豫时间DNP也可以用于区分外部和内部的17O核,靠近表面的氧核比表面双自由基中的未成对电子自旋极化速度更快,因此具有更短的DNP.对NCs-17O2,位于O970、880和870处的DNP值远小于O875处的体相信号,表明这三个信号代表NCs-17O2中的表面氧物种.17O DNP SENS谱图观察到的信号比室温常规NMR信号都有相应的增宽,这归因于DNP实验时的低温能够将物质表面动态的物种冻结,这和Hope等[33]对暴露{111}面的NRs所观察到的现象也是一致的.
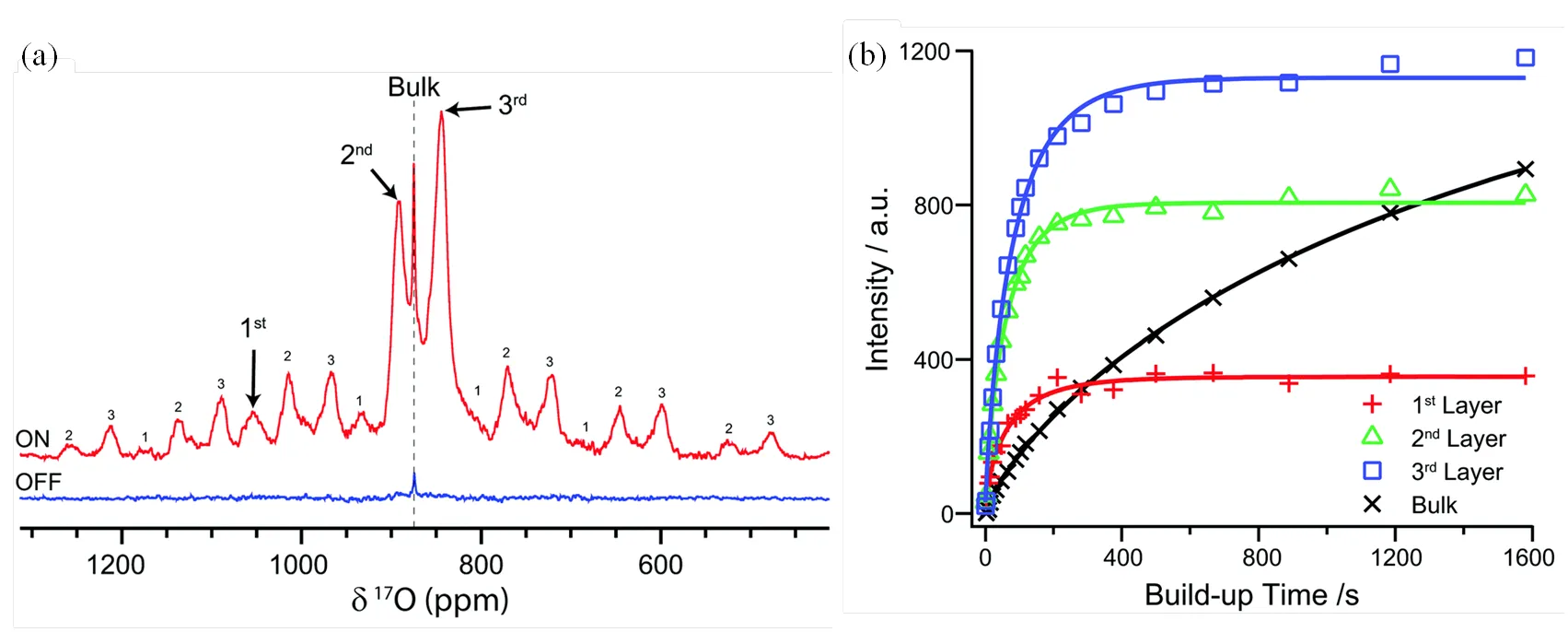
图9 (a) 17O标记的二氧化铈纳米颗粒的17O DNP SENS(14.1 T)谱图与(b)不同环境物种的17O时间累计曲线[33]
与表面选择标记的常规17O NMR相比,17O DNP SENS显然能提供信噪比更高的数据,进而可帮助归属常规17O NMR测得的谱图.通过对比表面选择17O同位素标记与非标记(N.A.)样品的常规固体17O NMR和17O DNP SENS谱图(图10),Chen等[17]提出上述两种方法哪种更适合取决于样品进行17O同位素标记的难易程度和表面质子含量的多少,即对于表面选择性标记程度较差或非标记的氧化物,直接DNP SENS更有利;对易于进行表面标记的氧化物,尤其是表面不含大量质子的材料,或观测核不易进行CP实验(即四极核,如17O),表面选择性同位素标记17O NMR的方法更有利.
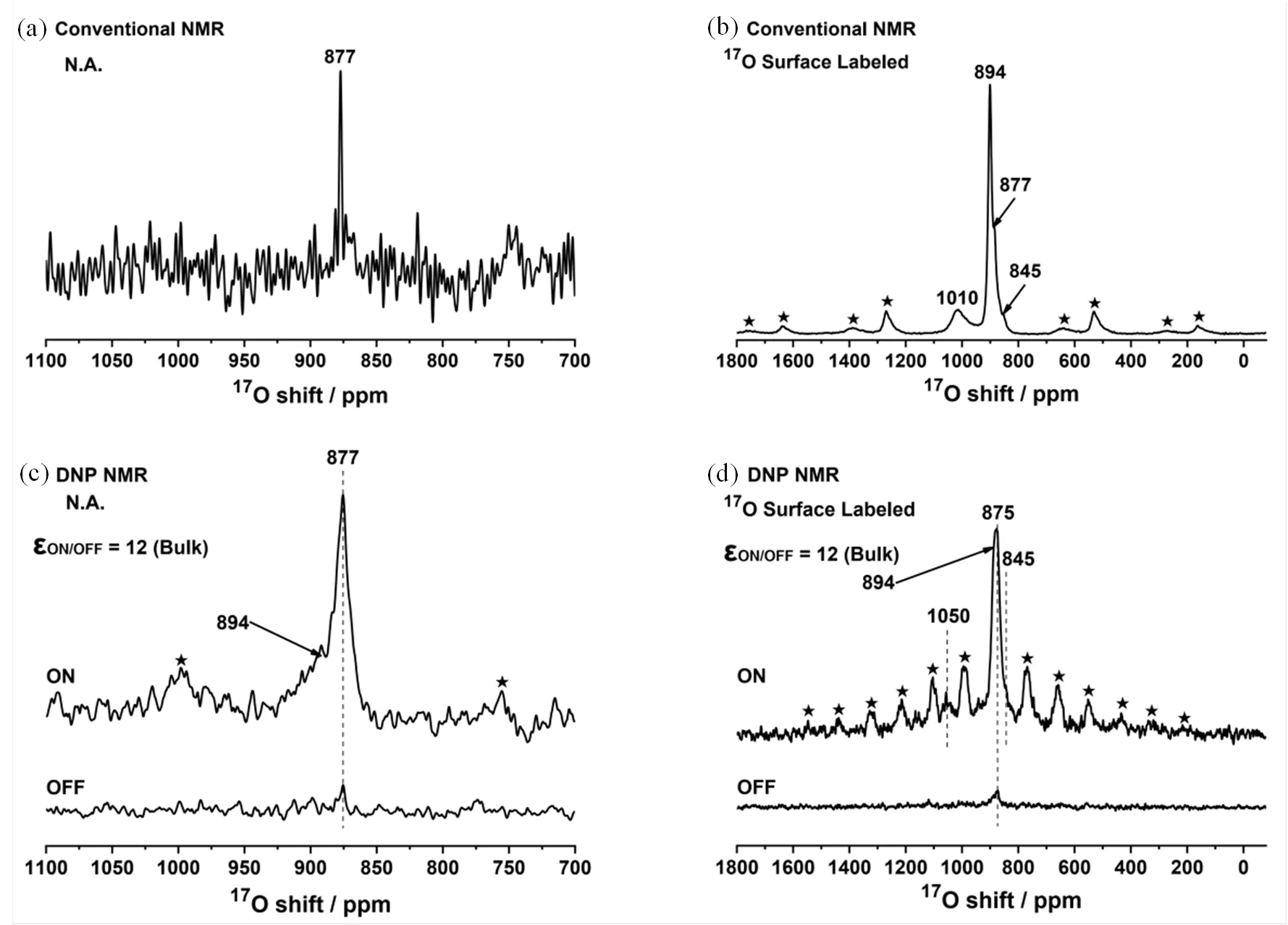
图10 (a) 非标记(N.A.)和(b) 17O标记的二氧化铈纳米棒的常规17O NMR与(c, d)它们对应的直接DNP SENS谱图[17]
由于DNP SENS具有表面选择性,对于-三氧化二铝这类金属元素同样可以通过NMR研究的氧化物,也可以选择金属核来研究氧化物的表面.27Al具有相对较大的旋磁比,天然丰度为100%,因此与17O相比,更容易获得高信噪比的NMR谱图.Vitzthum等[34]采用1H-27Al CP的间接DNP技术,将-三氧化二铝表面的27Al NMR信号提高了20倍(图11).相对于金属核,17O NMR一般有更好的分辨率.Li等[35]将17O DNP SENS技术用于探测-三氧化二铝的表面氧物种.直接和间接DNP实验能够观测表面裸露的氧物种和羟基,特别是首次通过二维2D17O 3QMAS DNP SENS技术实现了区分-三氧化二铝表面不同氧物种,发现了两种OAl4和一种OAl3物种.2D1H-17O HETCOR DNP SENS实验能够进一步帮助区分三种桥羟基和两种端羟基.对于17O2气体或H217O水标记的-Al2O3样品,裸露的氧物种和表面羟基的结构特征是相似的.研究结果表明,表面选择性标记的17O DNP SENS技术是表征具有复杂表面结构氧化物的有效方法.
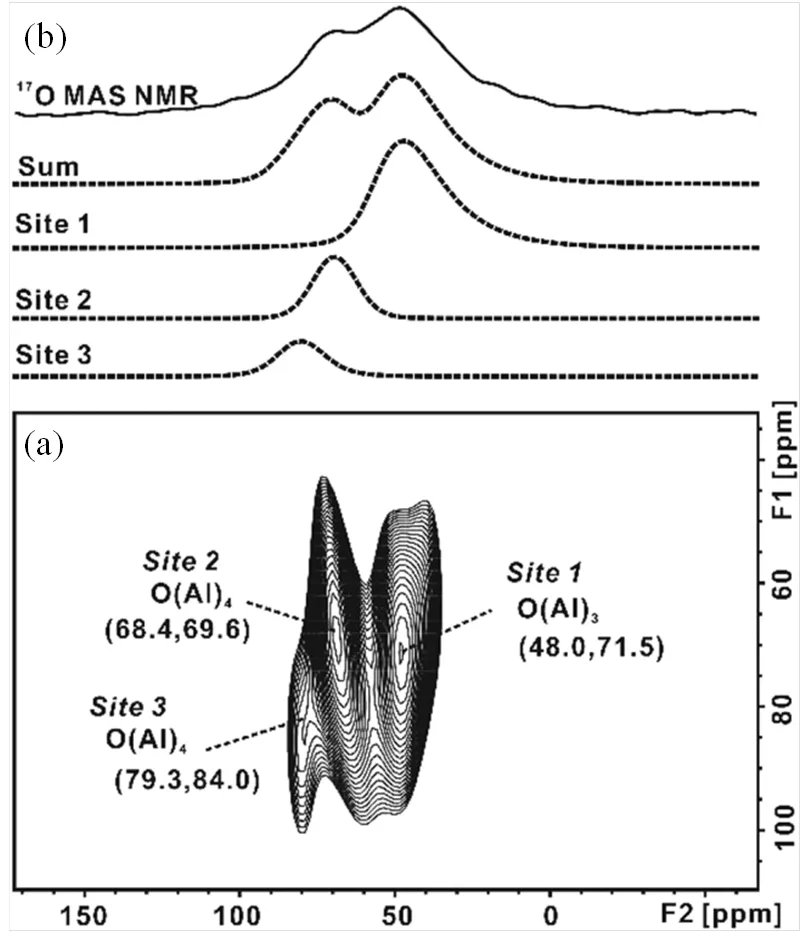
图11 g-三氧化二铝的(a) 2D 17O 3QMAS DNP SENS谱图与(b)模拟的3QMAS谱图中不同位点(1、2和3)谱图[34]
3 总结与展望
本综述探讨了可用于固体氧化物纳米材料表面结构和性质深入研究的固体NMR方法,包括选择性同位素标记的17O NMR和DNP SENS技术.由于DNP SENS具有更好的灵敏度,该方法应能够用于天然丰度氧化物纳米材料(如难以标记的氧化物)的研究,揭示它们的表面结构和性质间的关系.同时,表面选择性同位素标记的17O NMR是一种更具成本效益且足够灵敏的方法,可以区分不同原子层和晶面中的氧离子,用这种技术获得的NMR信号与表层/亚表层氧物种的反应性以及相互之间的动态交换有关.而通过DNP SENS观察到的NMR信号可能取决于更多的因素,包括1H浓度、1H自旋扩散的效率和与顺磁中心的距离.因此需要根据实际样品与具体需求选择合适的测试方法.必要时也可以将两种方法结合起来,进一步提升针对表面观测的灵敏度,使研究比表面较低的块体氧化物材料成为可能.未来上述方法将能够研究氧化物表面相关的更多挑战性问题,包括氧化物表面相互作用及参与的化学过程(如吸附、催化等,区分不同位点所起的作用),以及进一步探索氧化物(如金属-氧化物复合材料)界面结构和性质.
无
[1] YANG P D. Crystal cuts on the nanoscale[J]. Nature, 2012, 482: 41-42.
[2] LI Y, SHEN W J. Morphology-dependent nanocatalysts: rod-shaped oxides[J]. Chem Soc Rev, 2014, 43(5): 1543-1574.
[3] XIE X W, LI Y, LIU Z Q, et al. Low-temperature oxidation of CO catalysed by Co3O4nanorods[J]. Nature, 2009, 458(7239): 746-749.
[4] ZHOU K B, LI Y D. Catalysis based on nanocrystals with well-defined facets[J]. Angew Chem Int Ed, 2012, 51(3): 602-613.
[5] LI Y H, WU X P, JIANG N X, et al. Distinguishing faceted oxide nanocrystals with17O solid-state NMR spectroscopy[J]. Nat Commun, 2017, 8: 581.
[6] Chapter 7: Basics of X-ray diffraction[M]. Scintag, Inc, 1999.
[7] DU J H, PENG L M. Recent progress in investigations of surface structure and properties of solid oxide materials with nuclear magnetic resonance spectroscopy[J]. Chin Chem Lett, 2018, 29(6): 747-751.
[8] VOGT T, DAHMEN W, BINEV P. Modeling nanoscale imaging in electron microscopy[M]. Springer, 2012.
[9] MARCHETTI A, CHEN J, PANG Z F, et al. Understanding surface and interfacial chemistry in functional nanomaterials via solid-state NMR[J]. Adv Mater, 2017, 29(14): 1605895.
[10] LEVITT M H. Spin dynamics: basics of nuclear magnetic resonance[M]. Second edition, John Wiley & Sons, Ltd, 2008.
[11] PENG L M, LIU Y, KIM N, et al. Detection of Bronsted acid sites in zeolite HY with high-field17O-MAS-NMR techniques[J]. Nat Mater, 2005, 4: 216-219.
[12] ZHENG A M, LI S H, LIU S B, et al. Acidic properties and structure-activity correlations of solid acid catalysts revealed by solid-state NMR spectroscopy[J]. Acc Chem Res, 2016, 49(4): 655-663.
[13] ZHENG A M, LIU S B, DENG F.31P NMR chemical shifts of phosphorus probes as reliable and practical acidity scales for solid and liquid catalysts[J]. Chem Rev, 2017, 117(19): 12475-12531.
[14] MACKENZIE K J D, SMITH M E. Multinuclear solid-state NMR of inorganic materials[M]. Pergamon, 2002.
[15] WANG M, WU X P, ZHENG S J, et al. Identification of different oxygen species in oxide nanostructures with17O solid-state NMR spectroscopy[J]. Sci Adv, 2015, 1(1): e1400133.
[16] CHEN J C, WU X P, HOPE M A, et al. Polar surface structure of oxide nanocrystals revealed with solid-state NMR spectroscopy[J]. Nat Commun, 2019, 10: 5420.
[17] CHEN J C, HOPE M A, LIN Z Y, et al. Interactions of oxide surfaces with water revealed with solid-state NMR spectroscopy[J]. J Am Chem Soc, 2020, 142(25): 11173-11182.
[18] SHEN L, WANG Y, DU J H, et al. Probing interactions of-alumina with water via multinuclear solids-state NMR spectroscopy[J]. ChemCatChem, 2020, 12(6): 1569-1574.
[19] CHAMPOURET Y, COPPEL Y, KAHN M L. Evidence for core oxygen dynamics and exchange in metal oxide nanocrystals from in situ17O MAS NMR[J]. J Am Chem Soc, 2016, 138(50): 16322-16328.
[20] XU M, CHEN J C, WEN Y J, et al.17O solid-state NMR studies of Ta2O5nanorods[J]. ACS Omega, 2020, 5(14): 8355-8361.
[21] SHEN L, WU X P, WANG Y, et al.17O solid-state NMR studies of ZrO2nanoparticles[J]. J Phys Chem C, 2019, 123(7): 4158-4167.
[22] LI Y H, WU X P, LIU C. NMR and EPR studies of partially reduced TiO2[J]. Acta Phys Chim Sin, 2020, 36(4): 1905021.
[23] WANG Q, LI W Z, HUNG I, et al. Mapping the oxygen structure of gamma-Al2O3by high-field solid-state NMR spectroscopy[J]. Nat Commun, 2020, 11: 3620.
[24] LIUL, CHENX B. Titanium dioxide nanomaterials: Self-structural modifications[J]. Chem Rev, 2014, 114(19):9890-9818.
[25] CARVER T R, SLICHTER C P. Polarization of nuclear spins in metals[J]. Phys Rev, 1953, 92: 212-213.
[26] LESAGE A, LELLI M, GAJAN D, et al. Surface enhanced NMR spectroscopy by dynamic nuclear polarization[J]. J Am Chem Soc, 2010, 132(44): 15459-15461.
[27] SONG C, HU K N, JOO C G, et al. TOTAPOL: A biradical polarizing agent for dynamic nuclear polarization experiments in aqueous media[J]. J Am Chem Soc, 2006, 128(35): 11385-11390.
[28] REIF B, ASHBROOK S E, EMSLEY L, et al. Solid-state NMR spectroscopy[J]. Nat Rev Methods Primers, 2021, 1: 2.
[29] LAFON O, THANKAMONY A S L, ROSAY M, et al. Indirect and direct29Si dynamic nuclear polarization of dispersed nanoparticles[J]. Chem Commun, 2013, 49(28): 2864-2866.
[30] BLANC F, SPERRIN L, JEFFERSON D A, et al. Dynamic nuclear polarization enhanced natural abundance17O spectroscopy[J]. J Am Chem Soc, 2013, 135(8): 2975-2978.
[31] PERRAS F A, KOBAYASHI T, PRUSKI M. Natural abundance17O DNP two-dimensional and surface-enhanced NMR spectroscopy[J]. J Am Chem Soc, 2015, 137(26): 8336-8339.
[32] ZHAO X, HOFFBAUER W, SCHMEDT AUF DER GUNNE J, et al. Heteronuclear polarization transfer by symmetry-based recoupling sequences in solid-state NMR[J]. Solid State Nucl Magn Reson, 2004, 26(2): 57-64.
[33] HOPE M A, HALAT D M, MAGUSIN P C M M, et al. Surface-selective direct17O DNP NMR of CeO2nanoparticles[J]. Chem Commun, 2017, 53: 2142-2145.
[34] VITZTHUM V, MIEVILLE P, CARNEVALE D, et al. Dynamic nuclear polarization of quadrupolar nuclei using cross polarization from protons: surface-enhanced aluminium-27 NMR[J]. Chem Commun, 2012, 48: 1988-1990.
[35] LIW Z, WANG Q, XU J, et al. Probing the surface of-Al2O3by oxygen-17dynamic nuclear polarization enhancedsolid-state NMR spectroscopy[J]. PhysChemChemPhys, 2018, 20(25): 17218-17225.
Solid-State NMR Studies on the Surface Structure and Properties of Oxide Nanomaterials
1,2,2,2,2,2,2,2*
1.Analysis and Testing Center, Nanjing University of Science and Technology, Nanjing 210094, China; 2. Key Laboratory of Mesoscopic Chemistry of Ministry of Education and Collaborative Innovation Center of Chemistry for Life Sciences, School of Chemistry and Chemical Engineering, Nanjing University, Nanjing 210023, China
Many applications of oxide nanomaterials depend on their surface structure and properties. Solid-state nuclear magnetic resonance (NMR) spectroscopy has been used to obtain such key information in related studies. This paper summarizes two recently developed approaches based on solid-state NMR spectroscopy for determining the surface structure and properties of oxide nanomaterials, including surface-selective isotopic labeling17O NMR and dynamic nuclear polarization surface enhanced NMR spectroscopy. The development trend for investigating oxide nanomaterials with solid-state NMR spectroscopy is also introduced.
oxide nanomaterials, surface structure and properties,17O, solid-state nuclear magnetic resonance spectroscopy, dynamic nuclear polarization
O482.53
A
10.11938/cjmr20212936
2021-07-13;
2021-08-18
国家自然科学基金资助项目(91745202, 21972066, 21661130149).
* Tel: 15105171931, E-mail: luming@nju.edu.cn;
# Tel: 15751863953, E-mail: cjcnuaa@163.com.
