基于固体核磁共振技术的固体酸结构、酸性及活性分析
2021-12-10杨文杰
杨文杰,黄 骏
基于固体核磁共振技术的固体酸结构、酸性及活性分析
杨文杰,黄 骏*
催化工程实验室,化学与生物分子工程学院,悉尼纳米中心,悉尼大学,新南威尔士州 2006
固体酸是工业烃转化和生物质精炼中应用最广泛的非均相催化剂之一,了解它们的局部结构和酸性等性质有利于合理设计高效绿色固体酸催化剂,从而提高目标反应的活性和稳定性.近年来,固体核磁共振波谱在定性和定量表征固体酸的局部结构和酸性方面已显示出巨大的应用潜力,甚至可作为一种标准方法.二维固体核磁共振波谱的应用可以进一步揭示固体酸表面位点的结构对称性和不同位点的空间构效关系,从而加深对“催化剂结构-酸性-活性关系”的理解.在这篇综述中,我们总结了用于固体酸表征的固体核磁共振波谱方法和常规实验操作流程,并着重阐述了在使用和不使用探针分子的情况下,固体核磁共振波谱应用于固体酸局部结构和酸性性质研究的进展.
布鲁斯酸;路易斯酸;固体酸;酸位结构;固体核磁共振波谱
引 言
固体酸作为目前工业上使用的最多最重要的多相催化剂之一,在许多重要的化学过程中,尤其是在碳氢化合物和燃油的生产过程中,已逐步取代了具有腐蚀性和危险性的液体酸催化剂.目前,对于固体酸催化剂的需求随着近年来环保意识的逐渐增强、绿色新能源的快速发展,以及可持续化工的大力提倡而进一步增加.通常,酸有两种类型:布鲁斯酸(BAS)和路易斯酸(LAS),它们在催化反应的初始阶段表现出完全不同的性能.例如,BAS会向反应物提供酸性质子,从而引发反应发生;而LAS则通过从反应物中获取孤对电子来激活反应.固体酸表面酸位的形成通常是由表面暴露的局部结构决定的[1].例如在脱铝分子筛Y表面,部分骨架内电中性的硅氧四面体(SiO4)被含有一个负电荷的铝氧四面体(AlO4)替代,而带负电荷的结构被额外的氢离子进一步平衡电荷,形成基于Si-(OH)-Al桥键的BAS[2].此外,由于脱铝而引入的骨架外铝物种,例如Al(OH)3、AlOOH、AlO+、Al(OH)2+、AlOH2+和Al3+物种则可作为表面LAS位[2,3].对同种反应底物,固体酸表面的不同酸位很大程度上直接决定了反应的机理、走向和催化性能.因此,表征和理解固体酸催化剂的局部结构,表面酸位的性质、数量、强度、位置和可及性,对于更好地设计反应过程,以及实现更高的目标反应选择性和产量是至关重要的.
不同于可以被酸碱指示计直接表征的液体酸,固体酸的性质很难被直接表征.目前,国际上通用的表征固体酸酸性的方法有很多种,例如在质子惰性溶剂中进行酸碱滴定、直接和探针分子吸附的红外光谱(IR)分析,以及氨气吸附的程序升温脱附测试(NH3-TPD)等[4].然而,这些方法中的大多数无法区分不同类型的酸位点、酸强度或酸量.例如,在常规NH3-TPD表征方法中,除了表面酸位酸性强度以外,许多额外因素(例如助催剂、吸附位点几何形状,以及吸附碱性气体的扩散等)都会改变氨气的解吸温度的峰值(较高温度下的峰值表示有更强酸性的酸位)[5],这导致NH3-TPD很难提供定性和定量的酸度分析来确定每个活性酸位点的催化活性(单位时间内单个活性位点的转化数,TOF).固体核磁共振(SSNMR)技术很大程度上解决了酸性位点表征中的上述挑战.因为SSNMR不但可以揭示固体酸表面酸位的形成和局部结构,而且可以确定表面酸位的类型、强度、可及性和浓度.进一步地,除了表征以外,原位SSNMR技术(例如13C MAS NMR[6-9]、129Xe MAS NMR[10]),也是解析催化反应深层机理的一种重要手段.因此,SSNMR可以作为一个全面分析固体酸酸位特性,研究酸催化机理的手段,对于获得催化剂活性酸位点的TOF、评估催化剂催化性能至关重要.
在固体酸中,BAS通常由活性羟基质子提供,它们可以由1H SSNMR谱图直接鉴定和表征.
在魔角旋转(MAS)的帮助下[11],1H MAS NMR目前的分辨率可以区分固体酸中的不同羟基,这有利于识别不同的具有微小差别的BAS.此外,一些阳离子活性中心通常导致LAS的产生,某些LAS可以通过SSNMR谱图直接分析,例如使用11B、27Al、31P SSNMR可分析硼、铝或者磷物种导致的表面LAS.而另一些LAS则需要借助碱性探针分子来进行鉴定:LAS吸附并与探针分子反应后,可以用1H、13C、27Al、31P等SSNMR波谱中峰位置的变化来表征探针分子与催化剂表面酸位点的反应,进而对表面LAS进行鉴定;另外,一些探针分子吸附的SSNMR谱上不同峰的化学位移位置可用来表征酸强度和可接近性;同时,结合外标的应用,SSNMR谱上不同峰的积分面积还可用来识别不同酸位的浓度.
目前,随着SSNMR谱仪的普及,SSNMR波谱在材料和生物学表征方面的应用越来越广泛.本篇综述集中于SSNMR实验方法和用于表征非均相催化剂表面局部结构和酸度的一般策略,旨在推广这种可靠方法的广泛应用,使该领域的研究人员,尤其是初入本领域的研究人员受益.第一部分重点阐述新型SSNMR方法论,常规操作和实验方法;第二、三部分分别着重综述了直接SSNMR和结合探针分子的SSNMR用于表征固体酸的局部结构,表面酸位的类型、浓度、强度和可及性的研究;第四部分阐述了利用原位SSNMR技术,通过氢氘交换实验来表征非均相催化反应中固体酸表面酸位反应活性的研究.
1 用于固体酸表征的SSNMR技术及常规操作流程
基于各种原子核不同的共振频率,NMR波谱可以只显示选定的原子核信号,而屏蔽其他干扰核的信号.相比其他分析手段,SSNMR在定性和定量分析固体酸不同表面酸位点时有着明显优势.通常情况下,物质中原子核的自旋方向是随机的,并提供总和为0的净电荷.然而当这些原子核被转移到具有外部磁场的环境中时,它们将顺着(低能级)或逆着(高能级)外部磁场的方向自旋,产生不为0值的净电荷.在外加射频共振频率下,能量转移可以发生在这些具有不同能级的原子核之间,并被记录为电信号,称为自由感应衰减(FID).通过傅里叶变换,FID时域信号可以转换为富含结构和动力学相关信息的频域谱[12].
然而,不同于液体NMR分析,固体样品的化学位移各向异性等相互作用无法被固体分子间相对较慢的布朗运动平均掉,这导致SSNMR谱图通常有着极大的线宽.自20世纪50年代起,随着高分辨SSNMR技术的发展,其灵敏度已经被提高了几个数量级,并且可获得谱峰线宽相对较窄的谱图.例如,MAS NMR技术使固体样品绕着旋转轴以相对于外部磁场(0)方向的魔角(= 54.7˚)高速旋转,从而可以有效减小由化学位移各向异性、偶极耦合等相互作用所导致的谱线展宽,使得SSNMR谱图中的谱线收窄(图1)[13].虽然MAS可以大幅提高部分丰核(例如1H和31P)谱的分辨率,然而对于天然丰度较低的自旋核(例如13C和15N),MAS带来的分辨率提高不足以提供可供分析的SSNMR谱.交叉极化(CP)NMR技术可以显著提高非丰核S的灵敏度,它是把极化能量从丰核I转移到非丰核S,从而使得非丰核的NMR信号大幅增强.但在CP实验中,丰核I和非丰核S之间的偶极耦合无法被分子热运动平均掉,因此CP实验灵敏度很大程度上取决于丰核I与非丰核S的旋磁比或丰核I的天然丰度[14].进一步地,随着用于SSNMR的新型CP脉冲序列——quantification of CP(QCP)和quantitative CP(QUCP)等的开发,获得基于CP的可用于定量分析的SSNMR谱图已成为可能[15,16].
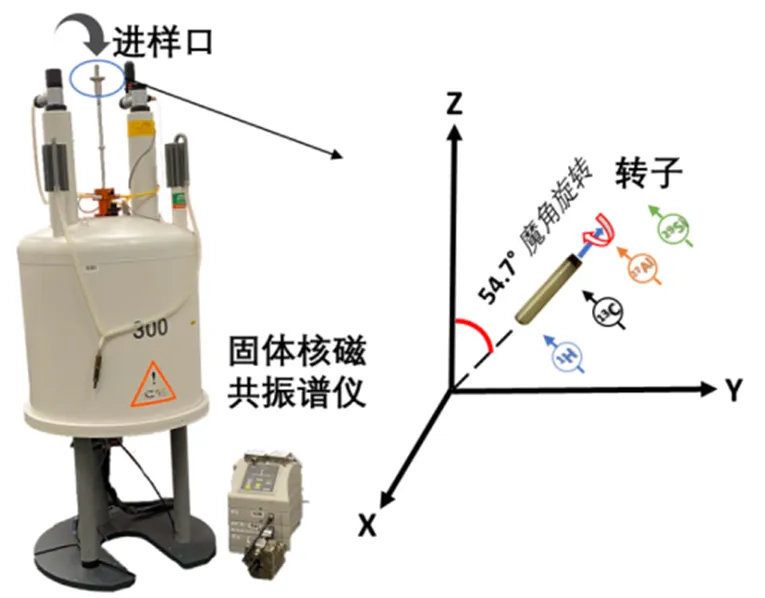
图1 固体魔角旋转核磁共振装置示意图
对于自旋量子数为1/2(=1/2)的原子核(例如1H,13C,15N,29Si和31P)来说,直接单脉冲(SP)MAS NMR即可实现完美的谱线收窄.1H MAS NMR已被广泛用于直接表征固体酸中的BAS.固体酸中具有不同局部环境和结构的羟基会在1H NMR谱上产生不同的化学位移,谱峰的强度和位置可用来表征相关BAS的浓度和强度.但是,对于部分与LAS相关的且> 1/2的四极核而言,例如27Al(=5/2)和11B(=3/2),SP MAS NMR实验中MAS操作虽然可以有效平均化学位移各向异性,但无法压制四极核的二阶四极耦合作用(second-order quadrupolar interaction),这会导致SSNMR信号信噪比急剧降低,甚至掩盖部分物种信息.目前,对于四极核,在仅用一维SSNMR技术条件下,可以使用以下三种方法来获得有较好信噪比的MAS NMR谱:(i)使样品吸水饱和(full hydration)[17].
与四极核相邻的水分子的存在可以增加四极核的各向同性(isotropy),以及局部结构对称性,进而减小四极耦合常数,缩窄由四极耦合作用导致的非对称谱线展宽.(ii)使用短激发脉冲(short exaction pulse).不同的四极核物种具有差距极大的弛豫表现(1relaxation),短激发脉冲有利于减小由不同弛豫表现带来的不同物种间的信号强度差异,进而有利于获得可用于定量分析四极核物种的高信噪比谱图.(iii)使用大于静态谱线展宽的MAS频率[18].更快的MAS频率有利于缩窄谱线展宽,因为使用小于静态谱线展宽的MAS频率有可能导致边带(side band)与实际样品信号重合.
如图2所示,在使用MAS NMR技术对固体酸进行表征时,第一步通常是通过真空脱水预处理样品(200~450 ℃)以消除水分对催化剂样品表面的干扰,因为物理吸附的水的1H NMR信号(H4~6)会影响固体酸表面BAS的定量评估[19].随后,固体酸应在惰性气体手套箱中被转移到NMR转子中以进行后续NMR实验.对于需要探针分子协助的SSNMR分析,在样品被转移到手套箱之前,还应在真空管路中进行进一步的探针分子原位负载.之后,样品应在合适的加热或室温条件下继续抽真空以脱附物理吸附的探针分子[20].为了达到研究目的,应该仔细优化探针分子的负载量和加热/解吸温度.例如,在BAS上以1:1的比例负载氘化苯分子是采用原位1H MAS NMR谱比较沸石和无定形硅铝材料表面BAS的活性和酸强度必不可少的一环[21].在使用三甲基氧化膦(TMPO)作为探针分子表征固体酸表面酸位种类、强度和数量时,过量负载而未脱附的物理吸附TMPO会导致31P MAS NMR谱上出现干扰峰(P34~38)[22].
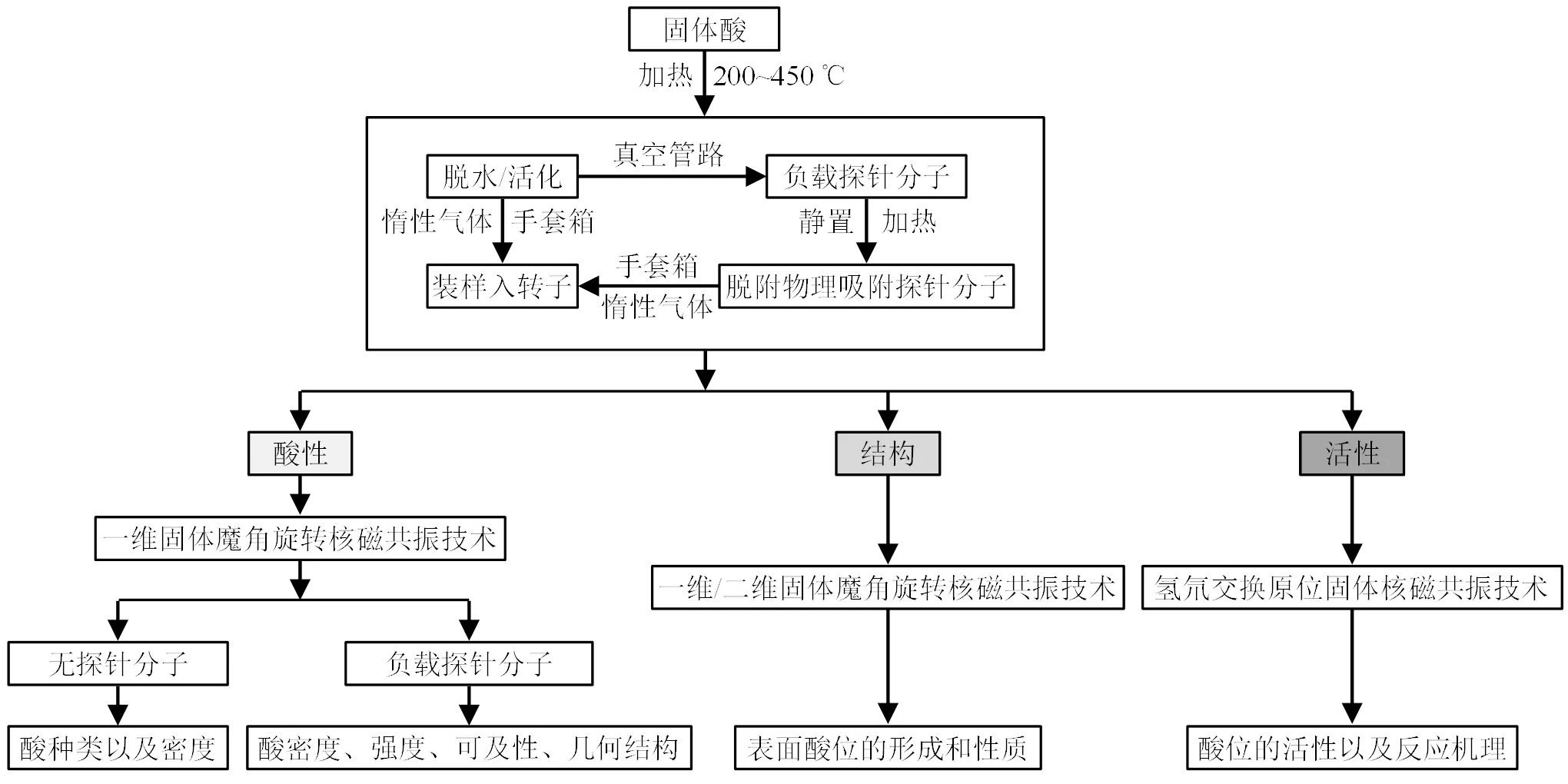
图2 固体核磁共振技术表征固体酸的常规操作流程
2 SSNMR在催化剂局部结构以及表面酸位表征中的应用
在燃料工业中,固体酸的普及主要归因于存在于其表面的强BAS.这些强BAS由存在于固体酸催化剂表面的多种羟基所提供,它们可以使反应物质子化[1].由于BAS由表面羟基(-OH)形成,并且1H核的自然丰度接近100%,因此,只需要几分钟扫谱时间即可获得的1H MAS NMR波谱,是鉴定BAS的可靠且快速的方法.对于具有不同局部结构和化学环境的氢原子核而言,分子的结构特征(例如电负性,磁各向异性和氢键的存在等)影响着外部磁场对它们的作用强度.多样的原子核局部结构导致了在不同原子核的周围存在着不同的电子屏蔽效应.一般而言,对于有着越强屏蔽效应的原子核,NMR吸收峰出现在有更高的外部磁场强度条件下.也就是说,具有不同化学环境的1H核可在1H SSNMR谱的不同化学位移处被观测到[23,24].
固体酸的1H SSNMR谱中各个信号的化学位移可以用来清楚地识别表面羟基或BAS的类型.表1总结了固体酸各种表面羟基基团的典型1H SSNMR化学位移.对于沸石催化剂而言,位于H1.2~2.3范围内的信号可归属于在晶体表面或缺陷位的非酸性硅烷醇羟基(Si(OH))[25],非骨架不存在相互作用的非酸性铝羟基(Al(OH))可以在H2.1~2.8范围内观察到[26],而出现在H3.3~4.4范围内的1H NMR信号可以归属于在沸石骨架超笼(super cage)中的桥接羟基基团(Si(OH)Al)[27-29].这些基团通常是固体酸中有可及性和催化活性的BAS[30,31].而当这些桥接羟基基团位于沸石方纳石笼(sodalite cage)中时,基于Si(OH)Al基团的BAS的1H MAS NMR信号会向低场(downfield)移动至H4.6~8.0范围,这是由于相邻的骨架氧通过氢键或静电相互作用干扰了桥连羟基基团的电子云密度,引发了更强的电子屏蔽效应导致的.一个典型的H-ZSM-5沸石分子筛的1H MAS NMR谱图如图3(a)所示,如上所述的所有羟基均可被观测到[32].另外,除了桥接羟基导致的BAS,最近的一维SSNMR实验表明H-ZSM-5分子筛上经过合成后处理(post-synthesis processing)的吸水的六配位铝同样可以作为BAS中心并提供质子,它们的信号可在H5~7范围内被观测到[33].进一步地,如果引入适当的外标或者内标,代表不同物种的1H SSNMR信号的积分面积可用于定量计算不同种类BAS在固体酸中的浓度比.例如,使用目前比较流行的标定化合物三甲基硅烷基笼形聚倍半硅氧烷(Q8M8),不同羟基的浓度可通过(1)式得到[44]:

图3 固体核磁共振用于表征表面酸性位点.(a)脱水的H-ZSM-5沸石在室温下的1H魔角旋转固体核磁共振谱.(b)沸石Y脱铝程度分别为i) 5%、ii) 10%、iii) 15%、iv) 20%,温度在373 K条件下的27Al魔角旋转固体核磁共振谱[32,43]
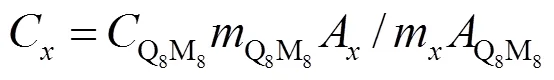
二氧化硅-氧化铝材料,尤其是具有高结晶度的沸石分子筛和无定形二氧化硅-氧化铝(ASA)组合物,是目前非常受欢迎且被广泛应用的固体酸.通常而言,ASA中的氧化铝相以及沸石分子筛中的非骨架铝物质(EFAl)提供了催化剂表面的LAS位点.因为27Al的自然丰度为100%.具有高灵敏度的27Al MAS NMR是直接评估基于铝物种的LAS的可行方法之一.如图3(b)所示,在沸石分子筛Y脱铝过程中形成的骨架外的六配位铝(AlVI)通常是LAS,在27Al MAS NMR谱中位于Al-2.0.而骨架内的四配位铝(AlIV)一般是BAS(Si(OH)AlIV)的组成部分,NMR吸收峰位于Al60.1处[44].因此,基于铝物种(或硼、磷等)的BAS或LAS可以通过直接SSNMR被区分清楚.类似于前文所述的1H MAS NMR定量测量,在使用外标化合物(例如氯化铝等)之后,部分LAS的浓度可以利用27Al MAS NMR测量.
除了上述相对简单直接的1D NMR分析,固体酸表面酸性位的形成和局部结构还可以通过多维(2D或3D)SSNMR来分析.例如,通过二维异核多量子相关(D-HMQC)NMR技术,不同原子核(例如1H-27Al、1H-29Si等)和不同物种间的空间相关性可以被表征[45-47].由此,沸石分子筛和ASA组合物等的BAS位形成可以通过1H和27Al不同物种之间的相关性来表征.如图4所示,在2D27Al-1H D-HMQC NMR上观测到了多个等高线中心,这证明了在ASA组合物中不同铝物种与氢物种之间存在空间邻近性[45].其中,等高线中心(Al50,H1.9)的信号代表了典型的由硅烷醇基团(H1.9,Si(OH))与空间邻近的四配位铝物种(Al50,AlIV)形成的BAS.同时,观测到的等高线中心(Al30(AlV),H1.9(Si(OH)))的信号代表着使用2D D-HMQC NMR技术表征出了一种新型的基于五配位铝的BAS(SiOH---AlV).另外,2D双量子(DQ)MAS NMR技术的使用可进一步证明相同原子核不同物种间的空间关系(例如1H-1H、27Al-27Al等).基于此,对于MFI分子筛,在1H-1H DQ MAS NMR谱上观察到的自相关峰(H4.3,H8.6)证明了在MFI孔道内不同的BAS具有空间邻近性.并且相比于独立的BAS,这些具有空间邻近性的BAS被进一步证明在增强表面BAS强度上具有协同作用[48].同样的,使用此方法,ASA组合物表面强BAS的形成被证明是由四配位铝和五配位铝同时邻近同一个硅烷醇基团(AlV---Si(OH)---AlIV)而形成的[21].进一步通过三维17O{1H,27Al}双共振(TRAPDOR)NMR实验得知,沸石分子筛上由桥连羟基组成的BAS的硅烷醇基团上的氧核与相关铝物种之间的距离为0.188~0.2 nm;然而ASA组合物BAS硅烷醇基团上的氧核与相关铝物种之间的距离则长达0.294~0.4 nm[49].由三维双共振实验证明的铝物种与羟基空间距离的差距很大程度上解释了沸石分子筛和ASA组合物的BAS酸性强度差别的形成原因.同时,基于空间相关性的表征,2D NMR谱图揭示了在某些固体酸上有空间邻近性/相互作用的BAS与LAS可协同导致表面位点的酸性增强[50,51].基于超高场NMR的发展,Jefferey L. White教授团队[52]最近使用35.2 T NMR谱仪发现了在ZSM-5分子筛上存在的第二种骨架四配位铝(AlIV-2).与普通骨架四配位铝相比,由于出现在较低的化学位移值,并且表现出更强的四极耦合作用,AlIV-2被认为是由不完全键接的骨架(SiO)4-n-Al(OH)形成.这种特殊的骨架四配位铝的形成与否被证明可通过合成后处理来控制.与常规表征可见的骨架四配位铝类似地,AlIV-2同样被认为与BAS的形成相关,并且AlIV-2的存在可提高ZSM-5分子筛对某些特定反应的催化活性的性能已得到佐证[52].

图4 无定形二氧化硅-氧化铝组合物的二维27Al-1H异核多量子相关核磁共振谱.样品在723 K下经12 h脱水处理,并在附加18.8 T外部磁场条件下记录数据[45]
除了使用常规的1H、27Al和29Si SSNMR技术,在过去十年,彭路明教授团队突破性的使用自然丰度较低的17O对BAS结构进行了深度表征.依靠多种二维1H-17O双共振技术,他们首次直接观测到了脱水分子筛HY和H-ZSM-5上的Si-17O(H)-Al[53-55].基于以上观测,对BAS上O-H键长进行了计算,进而促进了对酸位结构-酸性的理解[55].对于非分子筛类型的固体酸,比如作为常用LAS的部分金属氧化物而言,使用17O MAS NMR技术也可以提供类似的局部结构信息[56].例如使用上述技术,彭路明教授团队首次观察到单斜晶和四方氧化锆(ZrO2)纳米粒子表面上的低配位氧离子表现为高频17O NMR信号;使用类似的技术,他们也观测了氧化铝纳米颗粒在脱水和吸水后的动态结构改变.这些研究都极大加深了相关人员对各种材料的局部结构-酸性-性能关系的理解[57,58].
不止于静态观测,SSNMR技术还可以用来观测各种酸催化剂在特定条件下的动态局部结构改变.徐舒涛教授和刘中民教授等使用包括原位NMR技术在内的各种手段对此进行了深入探究.例如,在暴露于H217O的硅铝磷酸盐(SAPO)中,他们在二维17O MAS NMR谱中观测到代表Si-17O-Al和P-17O-Al 物种的特征峰.这暗示着SAPO中T-O-T键的动态可逆断裂和形成是通过气态水与分子筛骨架之间的相互作用而发生的[59],这一新发现提供了对分子筛在水中动力学特性的新见解.除了催化剂本身的局部结构改变,通过原位SSNMR技术,吸附在表面位点的各种物种的实时变化情况也可被表征.刘中民教授团队[7]通过原位13C MAS NMR在2017年表征了在甲醇制烃(MTO)过程中分子筛表面吸附的物种的实时变化与反应,解释了C1物种如何在分子筛表面参与初始碳-碳键的形成以及第一个碳-碳键形成的直接机理,这对于设计更高效的催化剂有着极大的帮助.
动态核极化(DNP)NMR波谱的发展对固体酸结构全面表征起到了不可忽视的促进作用.它可用来探测那些包含极低自然丰度核的酸性位点.此技术可将自旋极化从电子转移到目标原子核,进而使信号强度放大至千倍.例如,使用119Sn DNP MAS NMR技术可以检测到两种类型的LAS位点:一个是四面体配位的Sn位点(Sn-420 ~-443);另一个是伪八面体构型的Sn位点(Sn-700).这些代表LAS的信号是常规NMR手段完全无法检测的[60].
3 基于探针分子的催化剂表面酸位的SSNMR研究
具有不同碱性强度的各种探针分子可以被用来表征固体酸催化剂表面酸位的种类、强度和可及性.在此方面,郑安民教授和邓风教授等着重发展了磷探针分子,例如三甲基膦(TMP)和三烷基膦氧化物(R3PO),并且开发了一系列基于磷探针分子的可靠的31P NMR波谱常规酸性表征方法,对固体和液体催化剂的酸度进行全面表征[61-64].
一般而言,在探针分子被吸附之后,由探针分子与表面酸位相互作用(例如氢键,质子化等)而导致的结构变化和原子核周围电子云密度的变化等会让探针分子或表面酸位的化学位移出现不同程度的偏移.根据变化后的化学位移或者化学位移偏移量,可定性或定量的分析固体酸表面酸位.
借助探针分子,一些通常难以被常规手段区分出来的酸位可以被SSNMR波谱表征.特别是对于那些虽然存在于不同的化学环境中,但在波谱上却表现出相似或重叠的化学位移的表面酸位来说,探针分子提供了一个准确识别并区分它们的可能性.例如,在ASA组合物中,非酸性硅烷醇羟基的化学位移位于H1.7~2.3,而含有邻近四配位铝并提供BAS的硅烷醇羟基的化学位移也分布在此范围[65].如果没有探针分子,化学位移的高度重叠导致各种不同的硅烷醇羟基很难被区分,表面BAS的含量也因此无法被准确计算.借助强碱性探针分子[例如氨(NH3)],酸位的存在与否可被轻松确认.这是因为强碱性探针分子仅与有酸性的Si(OH)产生相互作用,并引起化学位移的相应变化[40].弱碱性探针分子[例如氘化乙腈(CD3CN)]则可用于区分BAS强度的细微差异.例如,离子交换Y型分子筛的各种表面BAS的细微强度差异可被探针分子氘化乙腈表征得到.在表面BAS吸附氘化乙腈之后,表面BAS的化学位移分布位于H3.6~9.6,而酸性越强的BAS的化学位移越向低场偏移(偏移量更大)[66].一个典型的实例是,以氘代乙腈和TMP作为探针分子,侯广进教授等[67]结合多种NMR技术,全面表征了BAS在丝光沸石(MOR)表面的位点分布和微观构型.进一步地,他们利用乙腈分子和BAS的1H-15N偶极相互作用并结合理论计算,研究了MOR不同孔道的限域效应差别,这些表现很大程度上影响着酸催化剂的催化性能.
除了酸性强度以外,表面酸性位点的类型也可以通过探针分子进行区别.TMP是一种目前较流行的用于区分固体酸上酸种类的探针分子,郑安民教授和邓风教授等对此在2017年做了极为详尽的综述介绍[61],因此本文不作过多赘述.简而言之,由于磷原子上存在孤对电子,当TMP吸附在LAS上时,孤对电子被LAS吸引并使得磷核周围的电子云密度减小,产生去电子屏蔽作用.而BAS则可以为TMP贡献一个质子形成络合物(CH3)3P-H+.因此,被吸附在LAS和BAS上的TMP的31P NMR化学位移会有明显差别.研究发现,通常被吸附在BAS上的TMP的31P NMR化学位移位于P-2 ~-5,而被LAS吸附的TMP的31P NMR化学位移则出现在P-20 ~-60范围内[61].此外,31P核和1H核之间的耦合常数(-coupling)可以通过31P SSNMR谱获得,并进一步用于BAS强度的鉴定:更大的耦合常数通常代表着更强的BAS强度[68].表2例举了部分常用探针分子以及基于化学位移变化的表面酸位特性的判定.

表2 部分常用探针分子以及基于化学位移变化的酸位特性判定
* Super acid代表H0值低于-11.93(100%硫酸)的那些超强酸位,/ 代表无法明显区分.
除了酸性种类和酸性强度以外,表面酸位的可及性直接决定着目标酸反应的发生与否.所以,表征固体酸上不同酸位的可及性对于选择反应物、设计催化剂,以及催化反应有着指导性作用.有着不同分子动力学直径的R3PO是非常重要的可用来判定酸位可及性的探针分子.一个典型的例子是使用TMPO和三丁基氧化膦(TBPO)来确定沸石分子筛孔道内外不同酸位对于不同反应物的可及性.比如,对于工业上广泛应用的微孔直径为0.60 nm的ZSM-5型分子筛而言,分子动力学直径为0.55 nm的TMPO可以与ZSM-5分子筛外表面以及孔道内部的酸位相互作用;然而对分子动力学直径为0.82 nm的TBPO而言,只有外表面的酸位是可及的.表3列出了文献报道中相对常用的几种可表征基于硅铝材料的固体酸(如改性分子筛、无定形硅铝材料等)的表面酸位不同属性的探针分子,它们在不同侧重点上各有优势[25,35,51,61,62,64,67,68].值得提出的是,在表征催化剂酸性过程中,探针分子的选择和负载量往往需要仔细斟酌.例如,对于那些表面具有石纳笼桥接羟基形成BAS的分子筛而言,氨气往往不是最合适的探针分子,因为氨气吸附在BAS上通常呈现的位于H6~8的信号易与石纳笼桥接羟基本身的质子信号重合.对于探针分子负载量,最新的研究表明,过量的TMPO负载可在NMR谱上给出误导性信号,进而导致酸性表征的不准确性[62].

表3 用于固体酸酸性特性表征的探针分子a

4 表面酸位的氢氘交换活性测试
氢氘交换(H/D exchange)被广泛用于表征固体酸的催化反应活性.在反应过程中,BAS上质子与氘化反应物的氘,或者氘代BAS上的氘与反应物的质子可发生氢氘交换.一般而言,催化剂上的活性酸位越多,氢氘交换发生越快.实时原位1H SSNMR可以显示氢氘交换过程中质子信号强度随时间的变化,并且出现在不同化学位移的质子信号的变化可表示催化剂上不同位点的氢氘交换速率.基于此,表面酸性位点的活性可以被计算及比较,部分相关的反应机理据此可以得到清楚解释.
例如,氘代苯(C6D6)与ASA组合物之间的氢氘交换实验可在40 ℃下使用高温探头并通过原位1H MAS NMR进行[21].如图5(a)所示,谱图清楚地展示了固体酸催化剂BAS的质子和氘代苯的氘之间的交换过程;随着表面BAS质子(H1.8)的消耗,苯上质子(H7.3)的信号在不断增强.
对1H MAS NMR谱图进行的定量评估可用来计算氢氘交换速率[75].在计算完如图5(a)所示的交换氢的信号积分面积值随时间的变化曲线后,氢氘交换速率可通过拟合如图5(b)所示的指数关系曲线(2)式来获得[40]:
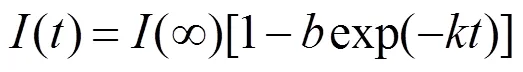

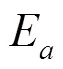

图5 40 ℃条件下,氘代苯与无定形二氧化硅-氧化铝组合物之间的氢氘交换.(a)原位1H魔角旋转核磁共振叠加谱;(b)氘代苯与分子筛H-ZSM-5(红色)、二氧化硅-氧化铝组合物SA/50(蓝色)、二氧化硅-氧化铝组合物SA/10(黑色)中酸位之间氢氘交换速率的动力学研究[21]
5 总结与展望
随着工业生产发展需求的进一步加大,以及目前对化工行业的绿色可持续发展的重视,固体酸作为工业上尤其是能源工业上一种重要的催化剂,其结构及酸性的定性和定量分析越来越重要.特别是一些关键的反应参数(例如反应速率和活化能)的确定需要知道固体酸上每种类型酸位的准确浓度和强度.这些信息可以用来指导合成新型的绿色固体酸催化剂.
SSNMR技术作为一种强大的波谱表征手段,经过近40年的持续发展,已可对固体酸表面酸位,尤其是BAS进行全面的表征,包括浓度、强度、结构、可及性和催化活性.然而,到目前为止,LAS的全面表征仍然具有挑战性.一般来说,在吸附探针分子后,一维SSNMR波谱可表征表面LAS.然而,对于很多提供LAS的四极核阳离子来说,谱图分辨率不足,不足以区分有着不同化学环境的物种.例如在27Al SSNMR研究中,铝位点通常涉及强四极耦合作用,从而严重降低了谱图分辨率.在许多情况下,二氧化硅-氧化铝中同时存在多种LAS铝位点.即使使用一维SSNMR波谱,由四极耦合作用导致的谱线展宽致使很难区分它们的不同功能.相比于常规一维SSNMR技术,先进的DNP以及二维NMR技术在波谱分辨率提高上有明显优势,然而它们在鉴定固体催化剂和探针分子“客体-主体”相互作用时仍需要借助多种NMR技术的结合,这可能会大大增加实验与分析的复杂性.因此,这些先进的NMR技术仍需要进一步仔细研究.
总而言之,目前SSNMR波谱是对固体酸进行定性和定量研究的有力工具.本综述中描述的各种实验方法和技术可以用于表征除二氧化硅-氧化铝以外的各种固体酸催化剂的酸性和局部结构,这将有助于加深对多相催化系统的“结构-酸性-活性”关系的基本理解.
黄骏感谢悉尼大学SOAR资金(SOAR fellowship)、悉尼纳米中心重大挑战项目(Sydney Nano Grand Challenge)和国际项目发展基金(International Project Development Funding)的支持.杨文杰感谢悉尼大学国际奖学金战略计划(USydIS Strategic)的支持.
无
[1] TANABEK. Solid acids and bases: their catalytic properties[M]. Elsevier, 2012.
[2] HUANG J, JIANG Y, MARTHALA VR, et al. Regioselective H/D exchange at the Side-Chain of ethylbenzene on dealuminated zeolite H-Y studied by in situ MAS NMR-UV/Vis spectroscopy[J]. ChemPhysChem, 2008, 9(8): 1107-1109.
[3] YU Z, LI S, WANG Q, et al. Brønsted/lewis acid synergy in H-ZSM-5 and H-MOR zeolites studied by1H and27Al DQ-MAS solid-state NMR spectroscopy[J]. J Phys Chem C, 2011, 115(45): 22320-22327.
[4] ASTRUC D. Heterogeneous catalysis[M]. Organomet Chem Catal, 2007, 457-486.
[5] GORTE R J, CROSSLEY S P. A perspective on catalysis in solid acids[J]. J Catal, 2019, 375: 524-530.
[6] WANG R D, XU B B, SONG Y H, et al. Methanol-water interaction in photocatalytic methanol reforming─An operando NMR study[J]. Chinese J Magn Reson, 2021, 38(1): 43-57.
王睿迪, 徐贝贝, 宋艳红, 等.原位核磁共振技术研究光催化甲醇重整过程中甲醇与水的相互作用[J]. 波谱学杂志, 2021, 38(1): 43-57.
[7] WU X Q, XU S T, ZHANG W N, et al. Direct mechanism of the first carbon-carbon bond formation in the methanol-to-hydrocarbons process[J]. Angew Chem Int Ed, 2017, 129(31): 9167-9171.
[8] YE M, YANG Y N, ZHANG R, et al.Effects of co-catalysts and wavelength of light on the products of photocatalytic methanol reforming: An operando NMR study[J]. Chinese J Magn Reson, 2019, 36(4): 490-501
叶曼,杨以宁,张燃, 等. 原位核磁共振技术研究共催化剂类型以及光照波长对甲醇光催化重整产物的影响[J]. 波谱学杂志, 2019, 36(4): 490-501.
[9] CHEN Y X, GONG K, JIAO F, et al. C-C bond formation in syngas conversion over zinc sites grafted on ZSM-5 Zeolite[J]. Angew Chem Int Ed, 2020, 59(16): 6529-6534.
[10] XU S T, ZHANG W P, LIU X C, et al. Enhanced in situ continuous-flow MAS NMR for reaction kinetics in the nanocages[J]. J Am Chem Soc, 2009, 131(38): 13722-13727.
[11] WANG J X, FENG J W, CHEN J F, et al. Design and fabrication of a magic-angle spinning rotor for solid-state nuclear magnetic resonance probe[J]. Chinese J Magn Reson, 2019, 36(4): 446-455.
王佳鑫,冯继文,陈俊飞,等.魔角旋转固体核磁共振探头中转子的研制[J]. 波谱学杂志, 2019, 36(4): 446-455.
[12] KEELER J. Understanding NMR spectroscopy[M]. John Wiley & Sons, 2011.
[13] LOWE I. Free induction decays of rotating solids[J]. Phys Rev Lett, 1959, 2(7): 285.
[14] HUNGER M. Solid-state NMR spectroscopy[M]. //(CHESTER A W, DEROUANE E G, Eds.), Zeolite Characterization and Catalysis: A Tutorial, Springer Netherlands: Dordrecht, 2009, 65-105.
[15] LIANG L X, DENG F, HOU G J. Quantitative cross polarization magic-angle spinning NMR spectroscopy in solids[J]. Chinese J Magn Reson, 2020, 37(1): 1-15.
梁力鑫,邓风,侯广进.固体核磁共振魔角旋转条件下的定量交叉极化技术(英文)[J]. 波谱学杂志, 2020, 37(1): 1-15.
[16] HOU G J, DING S W, ZHANG L M, et al. Breaking the T1 constraint for quantitative measurement in magic angle spinning solid-state NMR spectroscopy[J]. J Am Chem Soc, 2010, 132(16): 5538-5539.
[17] LI S H, ZHENG A M, SU Y C, et al. Extra-framework aluminium species in hydrated faujasite zeolite as investigated by two-dimensional solid-state NMR spectroscopy and theoretical calculations[J]. Phys Chem Chem Phys, 2010, 12(15): 3895-3903.
[18] LUAN Z H, CHENG C F, HE H Y, et al. Thermal stability of structural aluminum in the mesoporous molecular sieve MCM-41[J]. J Phys Chem, 1995, 99(26): 10590-10593.
[19] KENNEDY G J, AFEWORKI M, CALABRO D C, et al.1H MAS NMR (magic-angle spinning nuclear magnetic resonance) techniques for the quantitative determination of hydrogen types in solid catalysts and supports[J]. Appl Spectrosc, 2004, 58(6): 698-704.
[20] WANG Z C, JIANG Y J, JIN F Z, et al. Strongly enhanced acidity and activity of amorphous silica-alumina by formation of pentacoordinated AlV species[J]. J Catal, 2019, 372: 1-7.
[21] WANG Z C, LI T, JIANG Y J, et al. Acidity enhancement through synergy of penta-and tetra-coordinated aluminum species in amorphous silica networks[J]. Nat Commun, 2020, 11: 225.
[22] ZHENG A, DENG F, LIU S. Acidity characterization of solid acid catalysts by solid-state31P NMR of adsorbed phosphorus-containing probe molecules[M]. //WEBB G A. Annu Rep NMR Spectrosc. APNMR, Academic Press. 2014, 47-108.
[23] LI S H, LAFON O, WANG W Y, et al. Recent advances of solid-state NMR spectroscopy for microporous materials[J]. Adv Mater, 2020, 32(44): 2002879.
[24] LI S H, ZHOU L, ZHENG A M, et al. Recent advances in solid state NMR characterization of zeolites[J]. Chinese J Catal, 2015, 36(6): 789-796.
[25] GABRIENKO A A, DANILOVA I G, ARZUMANOV S S, et al. Strong acidity of silanol groups of zeolite beta: Evidence from the studies by IR spectroscopy of adsorbed CO and1H MAS NMR[J]. Microporous Mesoporous Mater, 2010, 131(1-3): 210-216.
[26] BORONAT M, CORMA A. Factors controlling the acidity of zeolites[J]. Catal Lett, 2015, 145(1): 162-172.
[27] PAZE C, ZECCHINA A, SPERA S, et al. Comparative IR and1H-MAS NMR study of adsorption of CD3CN on zeolite H-β: evidence of the presence of two families of bridged Bronsted sites[J]. Phys Chem Chem Phys, 1999, 1(10): 2627-2629.
[28] BORONAT M, CORMA A. Factors controlling the acidity of zeolites[J]. Catal Lett, 2015, 145(1): 162-172.
[29] BARAN R, MILLOT Y, ONFROY T, et al. Influence of the nitric acid treatment on Al removal, framework composition and acidity of BEA zeolite investigated by XRD, FTIR and NMR[J]. Microporous Mesoporous Mater, 2012, 163: 122-130.
[30] GAO X Z, ZHANG Y, WANG X M, et al. Structure and Acidity changes in ultra-stable Y zeolites during hydrothermal aging: A solid-state NMR spectroscopy study[J]. Chinese J Magn Reson, 2020, 37(1): 95-103.
高秀枝,张翊,王秀梅, 等. NMR研究超稳Y分子筛水热老化过程中结构与酸性的变化[J]. 波谱学杂志, 2020, 37(1): 95-103.
[31] GABRIENKO A, DANILOVA I G, ARZUMANOV S S, et al. Direct measurement of zeolite Brønsted acidity by FTIR spectroscopy: Solid-state1H MAS NMR approach for reliable determination of the integrated molar absorption coefficients[J].J Phys Chem C, 2018, 122(44): 25386-25395.
[32] CHEN K Z, ABDOLRHAMANI M, SHEETS E, et al. Direct detection of multiple acidic proton sites in zeolite HZSM-5[J]. J Am Chem Soc, 2017, 139(51): 18698-18704.
[33] ABDOLRAHMANI M, CHEN K, WHITE J. Assessment, control, and impact of brønsted acid site heterogeneity in zeolite HZSM-5[J]. J Phys Chem C, 2018, 122(27): 15520-15528.
[34] XU J, WANG Q, LI S H, et al. Solid-state NMR characterization of acid properties of zeolites and solid acid catalysts[M]. //Solid-state NMR in zeolite catalysis. Springer, 2019, 159-197.
[35] HAIJJAR R, MILLOT Y, MAN P P, et al. Two kinds of framework Al sites studied in BEA zeolite by X-ray diffraction, Fourier transform infrared spectroscopy, NMR techniques, and V probe[J]. J Phys Chem C, 2008, 112(51): 20167-20175.
[36] ESCRIBANO V S, GARBARINO G, FINOCCHIO E, et al.-Alumina and amorphous silica-alumina: structural features, acid sites and the role of adsorbed water[J]. TOP CATAL, 2017, 60(19, 20): 1554-1564.
[37] CREPEAU G, MONTOUILLOUT V, VIMONT A, et al. Nature, structure and strength of the acidic sites of amorphous silica alumina: an IR and NMR study[J]. J Phys Chem B, 2006, 110(31): 15172-15185.
[38] BRUNNER E. Characterization of solid acids by spectroscopy[J]. Catal Today, 1997, 38(3): 361-376.
[39] DEC S F, HERRING A M. Solid-state1H NMR study of structures and dynamics of proton sites in group II salts of 12-tungstophosphoric acid and related compounds[J]. J Phys Chem C, 2018, 122(27): 15539-15557.
[40] HUANG J, JIANG Y J, REDDG MARTHALA V A, et al. In situ1H MAS NMR investigations of the H/D exchange of alkylaromatic hydrocarbons on zeolites HY, La, Na-Y, and H-ZSM-5[J]. Microporous Mesoporous Mater, 2007, 99 (1, 2): 86-90.
[41] RIEMER T, SPIELBAUER D, HUNGER M, et al. Superacid properties of sulfated zirconia as measured by Raman and1H MAS NMR spectroscopy[J]. J Chem Soc Chem Comm, 1994, 10: 1181-1182.
[42] GUN’KO V M, ZARKO V V,TUROV V V, et al. Characterization of fumed alumina/silica/titania in the gas phase and in aqueous suspension[J]. J Colloid Interface Sci, 1999, 220(2): 302-323.
[43] BORGES L D, DE MACEDO J. Solid-state dealumination of zeolite Y: Structural characterization and acidity analysis by calorimetric measurements[J]. Microporous Mesoporous Mater, 2016, 236: 85-93.
[44] JIANG Y J, HUANG J, DAI W L, et al. Solid-state nuclear magnetic resonance investigations of the nature, property, and activity of acid sites on solid catalysts[J]. Solid State Nucl Magn Reson, 2011, 39 (3-4): 116-141.
[45] WANG Z C, JIANG Y J, LAFON O, et al. Brønsted acid sites based on penta-coordinated aluminum species[J]. Nat Commun, 2016, 7: 13820.
[46] LI S H, LI J, ZHENG A M, et al. Solid-state NMR characterization of the structure and catalytic reaction mechanism of solid acid catalysts[J]. ACTA PHYS-CHIM SIN, 2017, 33 (2): 270-282.
[47] YANG W J, WANG Z C, HUANG J, et al. Qualitative and quantitative analysis of acid properties for solid acids by solid-state nuclear magnetic resonance spectroscopy[J]. J Phys Chem C, 2021, 125(19): 10179-10197.
[48] SONG C H, CHU Y Y, WANG M, et al. Cooperativity of adjacent Brønsted acid sites in MFI zeolite channel leads to enhanced polarization and cracking of alkanes[J]. J Catal, 2017, 349: 163-174.
[49] PERRAS F A, WANG Z C, KOBAYASHI T, et al. Shedding light on the atomic-scale structure of amorphous silica-alumina and its Brønsted acid sites[J]. Phys Chem Chem Phys, 2019, 21(35): 19529-19537.
[50] GAO P, WANG Q, XU J, et al. Brønsted/Lewis acid synergy in methanol-to-aromatics conversion on Ga-modified ZSM-5 zeolites, as studied by solid-state NMR spectroscopy[J]. ACS Catal, 2018, 8 (1): 69-74.
[51] PENG L M, GREY C P. Diphosphine probe molecules and solid-state NMR investigations of proximity between acidic sites in zeolite HY[J]. Microporous Mesoporous Mater, 2008, 116(1-3): 277-283.
[52] CHEN K Z, HORSTMEIER S, NGUYEN V T, et al. Structure and catalytic characterization of a second framework Al(IV) site in zeolite catalysts revealed by NMR at 35.2 T[J]. J AmChem Soc, 2020, 142(16): 7514-7523.
[53] PENG L M, LIU Y, KIM N. Detection of Brønsted acid sites in zeolite HY with high-field17O-MAS-NMR techniques[J]. Nat Mater, 2005, 4(3): 216-219.
[54] PENG L M, HUO H, GAN Z H.17O MQMAS NMR studies of zeolite HY[J]. Microporous Mesoporous Mater, 2008, 109(1-3): 156-162.
[55] PENG L M, HUO H, LIU Y, et al.17O magic angle spinning NMR studies of Brønsted acid sites in zeolites HY and HZSM-5[J]. J Am Chem Soc, 2007, 129(2): 335-346.
[56] SHEN L, PENG L M.17O solid-state NMR studies of oxygen-containing catalysts[J]. Chinese J Catal, 2015, 36(9): 1494-1504.
[57] SHEN L, WU X P, WANG Y, et al.17O solid-state NMR studies of ZrO2nanoparticles[J]. J Phys Chem C, 2019, 12 (7): 4158-4167.
[58] SHEN L, WANG Y, DU J H, et al. Interactions of-alumina with water via multinuclear solid-state NMR spectroscopy[J]. ChemCatChem, 2020, 12(6): 1569-1574.
[59] SUN T T, XU S T, XIAO D, et al. Water-induced structural dynamic process in molecular sieves under mild hydrothermal conditions: Ship-in-a-bottle strategy for acidity identification and catalyst modification[J]. Angew Chem Int Ed, 2020, 132(46): 20853-20862.
[60] GUNTHER W R, MICHAELIS V K, CAPORINI M A, et al. Dynamic nuclear polarization NMR enables the analysis of Sn-Beta zeolite prepared with natural abundance119Sn precursors[J]. J Am Chem Soc, 2014, 136(17): 6219-6222.
[61] ZHENG A M, LIU S B, DENG F.31P NMR chemical shifts of phosphorus probes as reliable and practical acidity scales for solid and liquid catalysts[J]. Chem Rev, 2017, 117(19): 12475-12531.
[62] WANG Y X, XIN S H, CHU Y Y, et al. Influence of trimethylphosphine oxide loading on the measurement of zeolite acidity by solid-state NMR spectroscopy[J]. J Phys Chem C, 2021, 125(17): 9497-9506.
[63] XU J, DENG F. Solid-state NMR in interdisciplinary research[J]. Acta Phys Chim Sin, 2020, 36(4): 1912074-0.
徐君; 邓风.多学科交叉研究中的固体核磁共振[J]. 物理化学学报, 2020, 36(4): 1912074-0.
[64] ZHENG A M, HUANG S J, LIU S B,et al. Acid properties of solid acid catalysts characterized by solid-state31P NMR of adsorbed phosphorous probe molecules[J]. Phys Chem Chem Phys, 2011, 13(33): 14889-14901.
[65] ZHENG A M, ZHANG H L, LU X, et al. Theoretical predictions of31P NMR chemical shift threshold of trimethylphosphine oxide absorbed on solid acid catalysts[J]. J Phys Chem B, 2008, 112(15): 4496-4505.
[66] HUANG J, JIANG Y J, REDDY MARTHALA V R, et al. Concentration and acid strength of hydroxyl groups in zeolites La, Na-X and La, Na-Y with different lanthanum exchange degrees studied by solid-state NMR spectroscopy[J]. Microporous Mesoporous Mater, 2007, 104(1-3): 129-136.
[67] GONG K, LIU Z M, LIANG L X, et al. Acidity and local confinement effect in mordenite probed by solid-state NMR spectroscopy[J]. J Phys Chem Lett, 2021, 12(9): 2413-2422.
[68] LUO Q, DENG F, YUAN Z Y, et al. Using trimethylphosphine as a probe molecule to study the acid sites in Al-MCM-41 materials by solid-state NMR spectroscopy[J]. J Phys Chem B, 2003, 107(11): 2435-2442.
[69] ENGELHARDT G. Solid state NMR spectroscopy applied to zeolites[M]. //Studies in surface science and catalysis, Elsevier: 2001, 137, 387-418.
[70] HUANG J, JIANG Y J, REDDY MARTHALA V R, et al. Characterization and acidic properties of aluminum-exchanged zeolites X and Y[J]. J Phys Chem B, 2008, 112(10): 3811-3818.
[71] HAW J F, NICHOLAS J B, XU T, et al. Physical organic chemistry of solid acids: lessons from in situ NMR and theoretical chemistry[J]. Acc Chem Res, 1996, 29(6): 259-267.
[72] SU X, XU S T, TIAN P, et al. Investigation of the strong Brønsted acidity in a novel SAPO-type molecular sieve, DNL-6[J]. J Phys Chem C, 2015, 119(5): 2589-2596.
[73] GUNTHER W R, MICHAELIS V K, GRIFFIN R C, et al. Interrogating the Lewis acidity of metal sites in beta zeolites with15N pyridine adsorption coupled with MAS NMR spectroscopy[J]. J Phys Chem C, 2016, 120(50): 28533-28544.
[74] CHU Y Y, YU Z W, ZHENG A M, et al. Acidic strengths of Brønsted and Lewis acid sites in solid acids scaled by31P NMR chemical shifts of adsorbed trimethylphosphine[J]. J Phys Chem C, 2011, 115(15): 7660-7667.
[75] YI X F, DING L H, LI G C, et al. Insights into the reaction mechanism of propene H/D exchange over acidic zeolite catalysts from theoretical calculations[J]. Catal Sci Technol, 2016, 6(16): 6328-6338.
[76] KUBOTA T, OSUGA R, YOKOI T, et al. Consideration of acid strength of a single oh group on zeolites by isotope exchange reaction with ethane at high temperatures[J]. TOP CATAL, 2017, 60 (19-20): 1496-1505.
[77] SOMMER J, HABERMACHER D, JOST R, et al. Activation of small alkanes on solid acids. An H/D exchange study by liquid and solid-state NMR: the activation energy and the inhibiting effect of carbon monoxide[J]. J Catal, 1999, 181(2): 265-270.
[78] KAZANSKY V B. Adsorbed carbocations as transition states in heterogeneous acid catalyzed transformations of hydrocarbons[J]. Catal Today, 1999, 51(3-4): 419-434.
Analysis of Local Structure, Acidic Property and Activity of Solid Acids by Solid-State Nuclear Magnetic Resonance Spectroscopy
,*
Laboratory for Catalysis Engineering, School of Chemical and Biomolecular Engineering, Sydney Nano Institute, the University of Sydney, NSW 2006, Australia
Solid acid is one of the most widely applied heterogeneous catalysts for industrial hydrocarbon conversion and biomass refining. It is crucial to understand the nature of solid acid such as its local structure and acidic properties. Such knowledge renders effective design of solid acid with better activity and stability for the desired reaction. Recently, solid-state nuclear magnetic resonance (SSNMR) spectroscopy has been applied as a powerful standard method for characterizing the local structure and acidic nature of solid acid in both qualitative and quantitative manners. Additionally, the applications of advanced two-dimensional SSNMR methodologies further reveal the symmetry of surface sites, spatial relationship of different sites, and thereby unmasking the structure-activity relationship. In this review, we summarize the general methods and SSNMR techniques for the routine characterization, focusing on the progresses in the understanding of local structure and acidic properties of solid acids via the application of SSNMR with or without probe molecules.
Brønsted acid sites, Lewis acid sites, solid acid, acid site structure, solid-state nuclear magnetic resonance (SSNMR) spectroscopy
O482.53
A
10.11938/cjmr20212913
2021-04-28;
2021-06-16
Australian Research Council Discovery Projects (DP150103842, DP180104010).
* E-mail: jun.huang@sydney.edu.au.
