PD-1单药联合益气除痰中药维持治疗PD-L1表达阴性的晚期肺腺癌1例
2021-12-10陈芝强陈文敏林瑞婷孙玲玲余玲郑心婷
陈芝强, 陈文敏, 林瑞婷, 孙玲玲, 余玲, 郑心婷
1.广州中医药大学第一临床医学院,广东 广州 510000;2.广州中医药大学第一附属医院肿瘤中心,广东 广州 510000
全球发病率和致死率最高的癌症当属肺癌,其中,有85%的患者被诊断为非小细胞肺癌(Nonsmall Cell Lung Cancer,NSCLC)[1]。NSCLC根据组织分型主要包含为腺癌(40%)、鳞癌(25%)和大细胞癌[1]。对于早期NSCLC,可通过根治性手术治疗,五年生存率可达到50%以上[2]。然而,在我国由于NSCLC的发病特点以及社会经济等原因,大约有2/3的患者在确诊时已为晚期,使得治愈率大大降低,五年生存率不到15%[3]。
近年来,高选择性和低毒性的分子靶向治疗已成为临床上肺癌的常规治疗手段之一[1],但由于基因突变的限制性,只有约20%~40%的NSCLC患者有机会接受表皮生长受体酪氨酸酶抑制剂(Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitors,EGFR-TKI)治疗[4],而其常见的不良反应以及不可避免的耐药性亦阻碍了患者长期获益。将免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)引入NSCLC的治疗再一次改变了局面。第一个被发现的免疫检查点是CTLA-4,针对其开发出的抑制剂——伊匹单抗,在黑素瘤的治疗中显现出生存获益[5-7]。此后,随着其他免疫检查点的发现,ICIs在越来越多地参与了包括NSCLC在内的其他肿瘤的治疗。目前,被批准用于NSCLC治疗的ICIs有程序性死亡受体1(programmed cell death protein1,PD-1)抑制剂,如帕博利珠单抗、纳武利尤单抗,以及程序性死亡-配体1或2(PD-L1或PD-L2)抑制剂,如阿替利珠单抗。
本案例中,我们应用PD-1抑制剂配合益气除痰中药治疗肺腺癌术后肾上腺转移患者1例,经X线计算机体层成像仪(CT)疗效评估为完全缓解(complete response,CR),至目前为止,无进展生存期(progression-free survival,PFS)已长达2年,总生存期(overall survival,OS)已达4年。现报告如下。
1 案例介绍
患者邓某,男,53岁,2019年4月12日我院初诊。主诉:右上肺癌术后2年余,发现右侧肾上腺转移1年。既往吸烟史10余年,30支/天,2017年6月戒烟至今。身高165 cm,体重73 kg。卡氏评分(karnofsky performance status,KPS)80分。父亲肠癌病史。
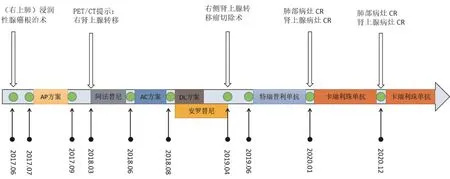
图1 诊疗经过流程图Figure 1 reatment process flow chart
患者2017年6月因反复咳嗽咳痰于广州市某医院CT提示右肺上叶占位,肿物大小约17mm×21mm,考虑肺癌。后于2017年6月7日行胸腔镜右上肺癌根治术,术后病理提示:(右上肺)浸润性腺癌(50%为实体型,40%为腺泡样型,10%为贴壁型),癌组织累及脏层胸膜;免疫组化:CK7、TTF-1弥漫阳性(+++),P40、CgA、Syn、P63(-),Napsin-A大部分阳性(++),Ki-67阳性率70%~80%(+)。未见淋巴结转移,TNM分期为T2NOMO IB期。ECOG评分为1分。2017年7月14日基因检测示:HER2 Exon20突变丰度19.93%,TP53 Exon7突变丰度34.54%,表皮生长因子受体EGFR(-),间变性淋巴瘤激酶ALK(-),PD-L1(TPS=0%,IPS=0%),突变负荷TMB:16.13Muts/Mb,微卫星稳定(MSS)。
综合以上结果,遂于2017年7月7日至2017年9月12日完成4疗程的AP化疗(顺铂+培美曲塞),2018年3月4日复查PET-CT结果提示:考虑右肾上腺转移。疗效评估为:病情进展(progressive disease,PD)。遂于2018年3月31日至2018年6月15日期间口服马来酸阿法替尼(40mg每日一次);2018年6月20日、2018年7月15日行2程AC化疗(卡铂+培美曲塞),2018年8月5日开始行5程DL化疗(多西他赛+洛铂)。
2018年8月5日至2019年4月12日期间患者口服盐酸安罗替尼胶囊(12mg每日一次),未出现不良反应。2019年4月9日复查PET-CT示:1.右肺癌术后及化疗后,右侧肾上腺高代谢病灶,多考虑为转移,较前相仿。2.右侧肺门支气管残端未见明显高代谢肿瘤复发征象。
首诊症见:咳嗽,咯白色泡沫状痰,胸闷,伴活动后气促,右侧腰酸腰痛,活动后尤甚,纳可,眠一般,二便调,舌暗红,苔薄白,脉沉细。查体:卡氏评分80分。右肾区压痛,叩击痛;全身未扪及肿大淋巴结;双肺呼吸音清,右上肺呼吸音稍弱,双肺未闻及干、湿性啰音,无胸膜摩擦音。
中医诊断:肺癌病,气滞血瘀证;西医诊断:右上肺腺癌术后右肾上腺转移(rT0N0M1b,IVA期,EGFR野生型,PD-L1阴性)。
考虑患者残留右肾上腺转移灶,于2019年4月28日在全麻下行后腹腔镜下右侧肾上腺部分切除术,术后病理(图2)示:(右肾上腺)转移性腺癌(肺来源),免疫组化:CK7(+),TTF-1(+),Napsin-A(-),Inhibin-α(-),ALK(D5F3,-),PD-L1(<1%)。中医治以清热活血、化瘀散结为法,处方:浙贝母15 g,陈皮10 g,法半夏10 g,土鳖虫6 g,桃仁10 g,川芎10 g,地龙10 g,僵蚕10 g,壁虎6 g,桔梗10 g,杜仲10 g,牛膝15 g,猫爪草30 g,蒲公英30 g,山慈菇15 g,龙葵草30 g,甘草6 g。共28剂,每日1剂,水煎至200ml,早晚分服。
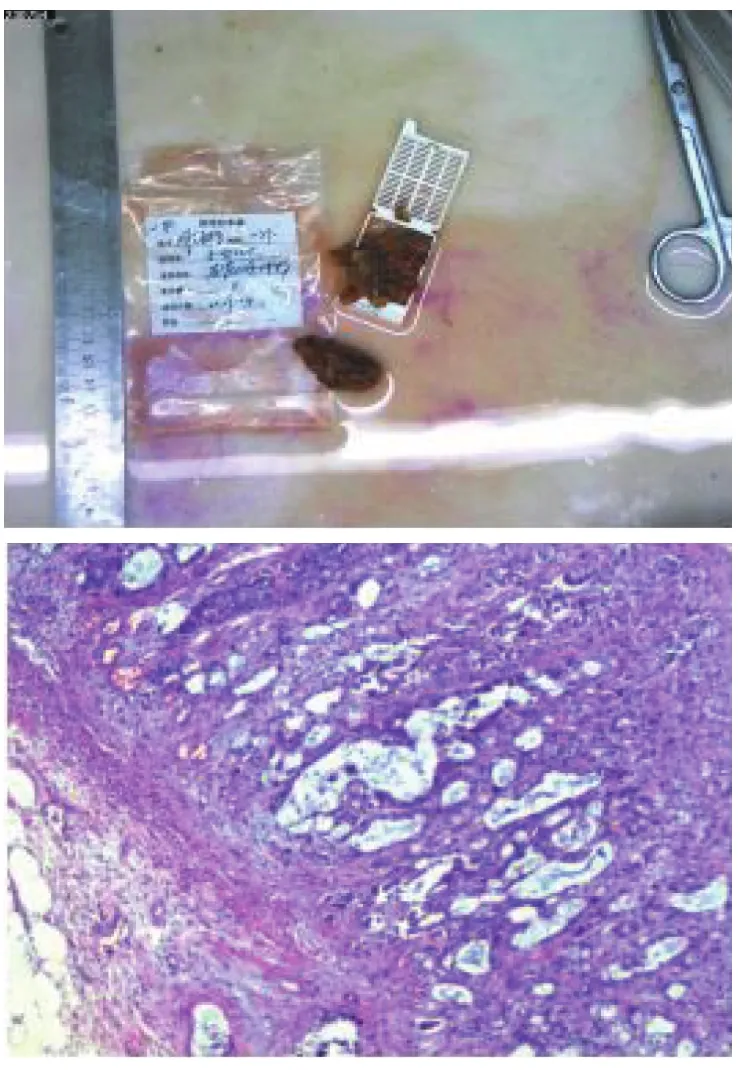
图2 右侧肾上腺转移瘤病理图Figure 2 Pathological picture of metastatic tumor of right adrenal gland
2019年6月10日二诊:患者咳嗽,咯痰较前好转,右侧腰部疼痛较前明显改善,仍有少许胸闷,伴活动后气促,舌淡红,苔薄白,脉细。处方以初诊方去杜仲、牛膝、川芎,加党参25 g、白术15 g、茯苓25 g,共28剂,每日1剂,水煎至200m l,早晚分次服。2019年6月18日胸腹部增强CT示:①右肺癌术后改变,未见明确复发征象;②右肾上腺转移瘤术后改变,转移瘤可能性大,大小约27×15mm。
西医治疗上,考虑患者已多线耐药,结合既往基因检测报告,于2019年6月15日开始行第1程PD-1单药免疫治疗,具体方案:特瑞普利单抗240mg静脉注射第一天,每14天为一个疗程,完成4个疗程后,2019年9月胸腹部增强CT评价为①右肺癌术后改变,疗效评价为完全缓解(complete response,CR);②右肾上腺转移瘤术后改变,转移瘤较前明显缩小(现约12mm×7mm,原约27 mm×15 mm),疗效评价为部分缓解(partical response,PR)。
2019年9月13日三诊:患者胸闷气促较前改善,无明显咳嗽咳痰,配合西医治疗,删减调整原方内容,以党参25 g、白术15 g、茯苓25 g健补脾胃,桑白皮15 g、葶苈子15 g泻肺平喘,陈皮10 g、法半夏10 g理气燥湿化痰,山慈菇15 g、龙葵草30 g、蒲公英30 g、猫爪草30 g清热解毒,壁虎6 g、僵蚕10 g、地龙10 g化痰散结,辅以甘草6 g调和诸药。共28剂,每日一剂,水煎至200ml,早晚分服。
西医治疗继续当前方案,共行10程特瑞普利单抗免疫治疗后,于2020年1月21日复查胸腹部增强CT提示:右肺癌及右侧肾上腺均未见明显肿瘤复发征象。肺部疗效评估为CR,肾上腺疗效评估为CR(图3)。因当时有赠药政策,综合情况是卡瑞丽珠平均价格更便宜。考虑经济影响,2020年1月22日开始改用卡瑞利珠单抗继续单药免疫治疗,具体方案:卡瑞利珠单抗注射液200mg静脉注射第一天,每14天为一个疗程。2020年4月14日、2020年7月6日、2020年10月9日复查胸腹部CT,大致同前。肺部原发灶疗效评估为CR,肾上腺转移灶CR。现已完成卡瑞利珠单抗维持治疗38程,期间一直规律服用中药治疗。至2021年6月10日末次随访,患者一般情况可,无特殊不适,KPS评分90分。患者多线治疗后以免疫治疗单药维持治疗,直至目前为止,无进展生存期已长达2年,患者总生存期现已达4年。

图3 右侧肾上腺转移瘤诊疗变化图Figure 3 Changes in treatment of metastatic tumor of right adrenal gland
2 讨论
中医认为,肺癌是一种局部属实,全身属虚的疾病[8]。肺癌的发病,离不开肺和脾,两脏的病理生理相互影响。“脾为生痰之源,肺为贮痰之器”,肺脾功能失常,是导致痰浊积聚,气滞血瘀,毒聚邪留,渐成癌瘤的原因。林丽珠等依据中医学理论并结合临床经验,总结出“益气除痰”大法,并以此为原则,以四君子汤为基础,临证中结合除痰散结药和活血化瘀药,达到益气除痰、肺脾同治,化瘀散结、气血兼顾的效果[9]。“扶正祛邪”,增强机体免疫是中医治疗恶性肿瘤的重要法则,这与现代医学中通过打破免疫耐受、克服肿瘤免疫逃逸的机制从而重新唤醒免疫细胞来清除癌细胞、增强肿瘤微环境抗肿瘤免疫力的肿瘤免疫治疗的基本治疗思路契合一致,两种疗法殊途同归。临床试验表明,益气除痰法联合化疗能够显著改善中晚期肺癌患者的生活质量,延长患者生存期,减轻化疗副反应,起到“增效减毒”之效[10-12]。本例患者经过多种西医手段治疗后,仍然复发转移,是余邪未尽,邪毒未清的表现。于是初诊以祛邪为主,治以清热活血、化瘀散结为法,方中地龙、僵蚕、壁虎解毒散结,浙贝母、陈皮、法半夏、桔梗化痰散结,川芎、土鳖虫、桃仁行气活血化瘀,山慈菇、龙葵草、猫爪草、蒲公英清热解毒,杜仲、牛膝补益肝肾。二诊时患者腰痛症状较前改善,仍有咳嗽、胸闷,予维持前法,加上党参、茯苓、白术以加强健脾益气除痰的作用。三诊时患者胸闷气促较前改善,无明显咳嗽咳痰,继续清热解毒、散结祛瘀、健脾化痰,随证再加上葶苈子、桑白皮泻肺平喘。经中医益气除痰法治疗后,患者症状明显好转,疗效维持稳定,可见益气除痰法在控制肿瘤复发、延长患者生存期方面的重要作用。
PD-1是一种在活化的T细胞上表达,并与浸润肿瘤细胞的免疫细胞上表达的配体PD-L1或PD-L2相结合的免疫抑制受体[13]。ICIs通过影响PD-1/PD-L1轴,阻断肿瘤与T细胞之间的抑制信号,激活人体抗肿瘤作用[14-15]。在转移性NSCLC的治疗中,帕博利珠单抗等联合化疗均显示出优于单用化疗的临床优势[16-19]。目前,ICIs联合化疗或在部分人群中单药治疗已成为部分NSCLC的一线及二线治疗标准。在keynote189和impower130研究中,帕博利珠单抗联合化疗作为野生型转移性NSCLC患者的一线治疗方案,PFS分别达到了8.8个月和7个月,均高于对照组[20-21]。Kong等[22]报道了一例肺腺癌并肝多发转移的患者,先后接受了吉非替尼和奥希替尼治疗后,病情进展,后线选择“卡瑞利珠单抗200mg q3w+阿帕替尼125mg qd”,一个疗程后原发灶即显著缩小,转移灶无进展,至随访结束,患者整体症状改善明显,PFS达到7个月。本例患者在第三线开始单药免疫治疗,PFS达到了2年,超过了既往报道的病例和研究结果。
基础研究表明,高成瘤性的肿瘤再生细胞(Tumor repopulating cells,TRC)通过犬尿氨酸转移诱导CD8+T细胞表达PD-1,从而实现免疫逃逸[23]。尽管keynote和checkmate研究的亚组分析均显示PD-L1高表达(TPS≥50%)比低表达(1%<TPS<50%)受益更明显[24-26],但总体上看,不论在PD-L1高表达还是低表达的人群中,ICIs联合化疗的疗效均优于单用化疗组[25]。值得注意的是,本例患者的PD-L1表达为阴性,但其病灶仍对PD-1抑制剂有较好的反应。本案例中,患者在第三线治疗中开始应用免疫疗法及中医药联合,患者整体情况改善,无明显不适,PFS达2年,OS达4年。这是我们已知的首例PD-1抑制剂联合中医药益气除痰法治疗PD-L1表达阴性的NSCLC,并且疗效显著的案例。
