过氧化物的复习及考查
2021-12-09韩万中
韩万中


从高一学习钠的重要化合物时,再次接触到过氧化物。此时,教师往往从Na与O2的反应实验导入讲述Na2O2的制备,然后再对比学习Na2O2与Na2O的颜色、构成、化学性质及其用途。到“化学键”时,教师通过书写Na2O2与H2O2的电子式启发学生积极思维,让其悟出其结构中的O和O之间的连接方式,从而建立起过氧键的概念。再到选择性必修二“物质结构与性质教学”时,重回过氧键话题:比较同一周期元素C、N、O三种元素形成的氢化物
CHHHCHHH、HN··HN··HH
、HO····O····
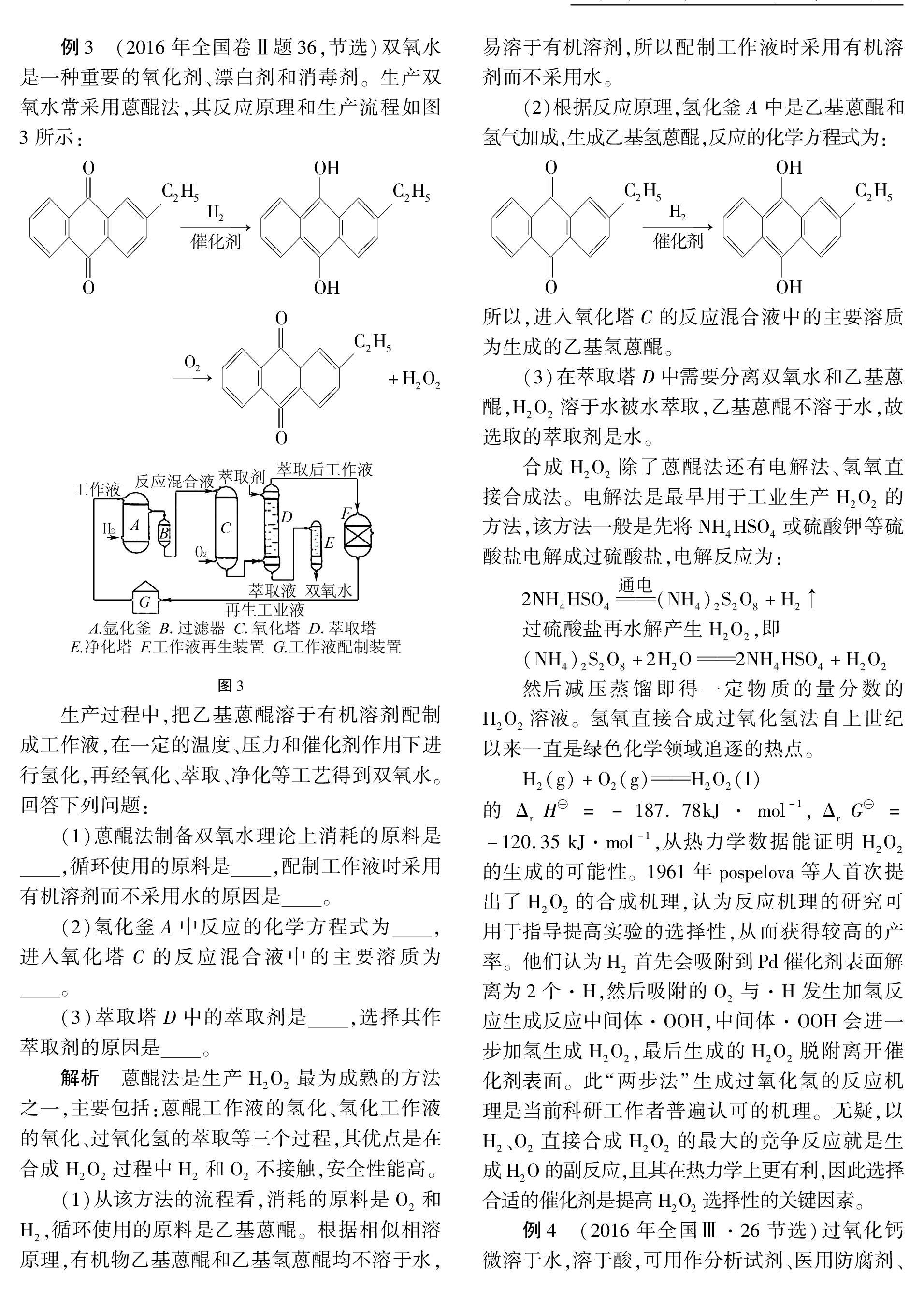
H,很多学生基于原子半径大小认为键长C—C>N—N>O—O,所以键能C—C 过氧键中因O为特殊的-1价,常在各类考试中倍受命题人的青睐,本文欲从其性质检验、合成方法及种类等方面给予分析说明,培养学生模型认知、证据推理及应用创新能力。 一、认识过氧键的化学性质 过氧化物含有过氧键,既存在热不稳定性又存在氧化还原不稳定性。以H2O2为例: H2O2(l)H2O(l)+12O2(g) ΔrH=-98.2 kJ·mol-1 ΔrG=-119.2 kJ·mol-1 热力学数据表明H2O2水溶液或纯净物可自发地发生歧化反应。但实际上,H2O2的动力学分解较慢,加入催化剂或光照能使其分解速率加快,纯H2O2加热到315℃时猛烈分解成H2O和O2。H2O2中氧的化合价居于O2及H2O(或OH-)中氧的化合价之间,因此它既可作氧化剂又可作还原剂。例如: H2O2+2I-+2H+I2+2H2O 4H2O2+PbSPbSO4+4H2O H2O2+Cl22HCl+O2 且其氧化性或还原性的强弱还与溶液的酸碱性有关。H2O2的结构与性质可以作为分析和理解其他含过氧键物质性质的模型。 例1 我国科学家屠呦呦因成功从黄花蒿中提取青蒿素而获得2015年诺贝尔奖。青蒿素的结构式如图1所示。 从黄花蒿中提取青蒿素的流程如图2所示: 研究团队经历了使用不同溶剂和不同温度的探究过程,实验结果见表1。 (1)用水作溶剂,提取无效的原因是。 (2)研究发现,青蒿素分子中的某个基团对热不稳定,是治疗疟疾的药效的主要官能团。据此分析用乙醚作溶剂,提取效率高于乙醇的原因是。 (3)提取青蒿素的过程中,应考虑物质的等性质。 说明 青蒿素属于一种过氧有机物,其中的过氧官能团结构特性决定其不稳定性,题目中给出的“某个基团对热不稳定”等信息是分析和解决问题的题眼。 解析 本题以我国科学家屠呦呦成功提取青蒿素获得诺贝尔奖为背景,围绕青蒿素提取过程中的物理、化学条件,创设了真实而有意义的试题情境,不仅有利于考查学生证据推理和化学信息处理能力,也有利于激发学生的科学精神和社会责任,落实“立德树人”的根本任务。青蒿素结构中因无羟基、醛基或羧基等亲水基,所以在水中的溶解能力很差,水浸提取无效。青蒿素分子中的过氧键热稳定性较差,乙醚沸点比较低,蒸馏提取所需温度较低,—O—O—键不被破坏。综合上述分析,提取青蒿素应考虑其溶解性、热稳定性以及萃取剂的沸点等性质。 答案:(见解析) 例2 (2021年“八省联考”河北卷题13)乙醚是常用的有机试剂,久置容易产生过氧化物,带来安全隐患,以下不可用来定性检出过氧化物的试剂是( )。 A.K3[Fe(CN)6]溶液 B.弱酸性淀粉KI溶液 C.Na2Cr2O7和稀H2SO4溶液 D.(NH4)2Fe(SO4)2的稀H2SO4溶液和KSCN溶液 解析 本题以中学实验室常见药品乙醚的安全使用为素材,考查物质检验实验设计及试剂选择。过氧化物具有氧化性,能氧化I-生成单质碘,I2遇淀粉变蓝色,B项正确;过氧化物也能氧化Fe2+,生成的Fe3+使KSCN溶液变红色,D项正确;过氧化物还有还原性,在酸性条件下氧化性较强的Na2Cr2O7能将过氧化物氧化生成O2,Cr2O2-7被还原成为Cr3+,溶液变为绿色, C项正确; K3[Fe(CN)6]溶液遇Fe2+生成蓝色沉淀 Fe3[Fe(CN)6]2,不能检验过氧化物,A项错误。 答案:A 说明 乙醚放置时,瓶中存留的少量空气,能将乙醚分子中与氧相连的碳原子氧化,用化学方程式表示为:CH3CH2OCH2CH3+O2 CH3CH2OCHCH3OOH 在加熱或剧烈振荡时,过氧键断裂,产生自由基,自由基引发链反应,促使反应很快进行,放出大量热,引发爆炸。 二、认识过氧化物的形成途径 在高一初学钠的化学性质时,教师在进行Na的燃烧实验后,教师告知学生产物主要是Na2O2。此时,有的教师还向学生补充说明工业制备过氧化钠的方法:将金属钠加热熔化,通入一定量已除去CO2的干燥空气,加热并维持温度在180℃~200℃之间,钠被氧化成Na2O,进而增加空气流量,迅速升温至300℃~400℃即可得到Na2O2。至“原子结构与元素的性质”学习碱金属元素时,教材中给出: 4Li+O2△2Li2O 教师往往会强调说明Li在氧气中燃烧生成物是Li2O。那么,能否说不存在Li2O2这种物质呢?答案是否定的。Li在氧气中燃烧生成Li2O,只能说在该反应条件下产物Li2O最稳定,但不能简单地认为Li2O2是不存在的。资料表明Li2O2是一种制造热电偶的良好材料,可基于 2LiOH+H2O2Li2O2+2H2O 在乙醇介質中制备。 对比Na2O2、Li2O2的制备方法可知,Na在氧气中燃烧生成的Na2O2,其过氧键是O2直接形成的;而LiOH与H2O2反应制得的Li2O2,过氧键则是导入H2O2分子中“现成”的过氧键。 例3 (2016年全国卷Ⅱ题36,节选)双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图3所示: 生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题: (1)蒽醌法制备双氧水理论上消耗的原料是,循环使用的原料是,配制工作液时采用有机溶剂而不采用水的原因是。 (2)氢化釜A中反应的化学方程式为,进入氧化塔C的反应混合液中的主要溶质为。 (3)萃取塔D中的萃取剂是,选择其作萃取剂的原因是。 解析 蒽醌法是生产H2O2最为成熟的方法之一,主要包括:蒽醌工作液的氢化、氢化工作液的氧化、过氧化氢的萃取等三个过程,其优点是在合成H2O2过程中H2和O2不接触,安全性能高。 (1)从该方法的流程看,消耗的原料是O2和H2,循环使用的原料是乙基蒽醌。根据相似相溶原理,有机物乙基蒽醌和乙基氢蒽醌均不溶于水,易溶于有机溶剂,所以配制工作液时采用有机溶剂而不采用水。 (2)根据反应原理,氢化釜A中是乙基蒽醌和氢气加成,生成乙基氢蒽醌,反应的化学方程式为: 所以,进入氧化塔C的反应混合液中的主要溶质为生成的乙基氢蒽醌。 (3)在萃取塔D中需要分离双氧水和乙基蒽醌,H2O2溶于水被水萃取,乙基蒽醌不溶于水,故选取的萃取剂是水。 合成H2O2除了蒽醌法还有电解法、氢氧直接合成法。电解法是最早用于工业生产H2O2的方法,该方法一般是先将NH4HSO4或硫酸钾 等硫酸盐电解成过硫酸盐,电解反应为: 2NH4HSO4通电(NH4)2S2O8+H2↑ 过硫酸盐再水解产生H2O2,即 (NH4)2S2O8+2H2O2NH4HSO4+H2O2 然后减压蒸馏即得一定物质的量分数的H2O2溶液。氢氧直接合成过氧化氢法自上世纪以来一直是绿色化学领域追逐的热点。 H2(g)+O2(g)H2O2(l) 的ΔrH=-187.78kJ·mol-1,ΔrG= -120.35 kJ·mol-1,从热力学数据能证明H2O2的生成的可能性。1961年pospelova等人首次提出了H2O2的合成机理,认为反应机理的研究可用于指导提高实验的选择性,从而获得较高的产率。他们认为H2首先会吸附到Pd催化剂表面解离为2个·H,然后吸附的O2与·H发生加氢反应生成反应中间体·OOH,中间体·OOH会进一步加氢生成H2O2,最后生成的H2O2脱附离开催化剂表面。此“两步法”生成过氧化氢的反应机理是当前科研工作者普遍认可的机理。无疑,以H2、O2直接合成H2O2的最大的竞争反应就是生成H2O的副反应,且其在热力学上更有利,因此选择合适的催化剂是提高H2O2选择性的关键因素。 例4 (2016年全国Ⅲ·26节选)过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题: (一)碳酸钙的制备(如图4所示) 石灰石(含少量铁的氧化物) (1)步骤①加入氨水的目的是。 (二)过氧化钙的制备(如图5所示) CaCO3稀盐酸、煮沸、过滤② (2)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是。 (3)步骤③中反应的化学方程式为,该反应需要在冰浴下进行,原因是。 (4)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是,产品的缺点是。 解析 本例为经典的实验室制法,以大理石为原料,先提纯碳酸钙;然后,加盐酸溶解得到CaCl2,再加人过氧化氧和氨水(冰水浴中)制得过氧化钙晶体,化学反应将H2O2的过氧键转移给Ca2+。 (1)由流程可知,加盐酸是将石灰石中的 CaCO3、铁的氧化物溶解,步骤①的双氧水是将Fe2+氧化为Fe3+,加氨水则是调节溶液pH使Fe3+形成氢氧化物沉淀而被除去;滤液中加氨水是中和过量的盐酸、抑制碳酸铵水解,使Ca2+沉淀完全。 (2)步骤②加入稀盐酸后CaCO3与之反应生成CO2,CO2的溶解会使溶液呈酸性,CaO2能与CO2反应,所以需将溶液煮沸以除去溶液中的CO2。 (3)步骤③的反应是制取产品的核心反应,可根据流程信息及元素守恒写出其化学方程式: CaCl2+2NH3·H2O+H2O2 CaO2↓+2NH4Cl+2H2O 反应体系中的氨水起到什么作用,可用热力学原理来说明。若无NH3·H2O或其不足,CaCl2与 H2O2直接反应: CaCl2+H2O2CaO2+2HCl ΔrH=62.2 kJ·mol-1 ΔrG=71.7kJ·mol-1 K=1.18×10-14 数据表明CaCl2很难与 H2O2直接反应得到CaO2。氨水参与后: CaCl2+2NH3·H2O+H2O2 CaO2↓+2NH4Cl+2H2O ΔH=-46.6kJ·mol-1 ΔG=-28.8kJ·mol-1 K=3.87×105 氨水的耦合直接影响CaO2制备的方向和限度。冰浴控制既能防止反应温度升高引起H2O2分解、氨水挥发,又能使该制备反应平衡向着生成CaO2的方向移动,提高产品的产量。 (4)该工艺可称为氧化钙法,优点是原料来源丰富、操作简单,但石灰石含有铁元素杂质,对过氧化物分解有催化作用,纯度降低。 答案:(1)调节溶液pH使Fe(OH)3沉淀;过滤分离;(2)酸;除去溶液中溶解的CO2;(3)CaCl2+2NH3·H2O+H2O2CaO2↓+2NH4Cl+2H2O;温度过高时过氧化氢分解;(4)去除结晶表面水分;(5)工艺简单、操作简单;纯度较低。 三、了解过氧化物的种类 广义的过氧化物不仅包括过氧化氢、金属过氧化物,而且还包括过氧酸及过氧酸盐、有机过氧化物,结构中含有过氧离子是其共同特征。周期表中 ⅠA、ⅡA、ⅢB、ⅣB族元素以及其他过渡元素能形成金属过氧化物,如MgO2、CaO2、CrO5()等;常见的过氧酸及过氧酸盐有过二硫酸及其盐类,过二磷酸( H4P2O8),以及钛、铬等复杂的过氧酸;有机过氧化物有过氧化二叔丁基()、过氧乙酸、过氧化苯甲酰等,其氧化性比金属过氧化物更强,都是易燃、易爆的物质。 例5 (2017年全国卷Ⅰ题27解析)Li2Ti5O15是利用钛铁矿合成锂离子电池正极极材料Li4Ti5O12的中间物质。已知Li2Ti5O15中Ti 的化合价为+4,则其中过氧键的数目为。 解析 联想Na2O2的电子式,每2个O-1之间存在1个过氧键。假设在化学式为Li2Ti5O15中的 O-2与O-1 个数分别为x、y,由原子守恒得x+y=15,再由化合物中化合价代数和为0的规则,得2x+y=1×2+4×5,聯立两个方程,解之y=8,故Li2Ti5O15中4个过氧键。 像前文提及的(NH4)2S2O8,其中的S2O2-8曾在山东2020年普通高中学业水平等级考试中(模拟卷)考查过,有些学生因思维定式认为O显-2而错将S认定+7价。由S的最外层电子数可知S最高正价为+6,逆推出S2O2-8中的O不全是-2,进而得出含有过氧键的结论,其结构式为 OSOOOOSOOO 2-。 《普通高中化学课程标准(2017年版)》要求教学时“结合真实情境中的应用实例或通过实验探究”物质的性质,从物质的微观层面理解其组成、结构和性质的联系,进而形成结构决定性质,性质决定应用的观念。过氧化物虽不是化学的核心物质,但它却是有意义的、实在的化学,创设基于过氧化物的实验、生产应用的真实情景,对提高学生学生积极联想和创造性思维能力、分析和解决实际化学问题的能力具有一定的意义。 (收稿日期:2021-10-04)
