关于碳酸钠与碳酸氢钠的核心知识突破
2021-12-09牛婷婷
牛婷婷

一、物质性质比较
碳酸钠和碳酸氢钠均属于钠的化合物,对应水溶液均为碱性,性质探究应重点关注其化学性质。相同点是两者与酸反应均可以产生二氧化碳气体,与石灰水反应产生白色沉淀。不同点是碳酸钠不与烧碱反应,碳酸氢钠可与烧碱反应生成碳酸钠和水;碳酸钠可与氯化钙反应生成白色沉淀,碳酸氢钠不与其反应。
二、与酸反应剖析
剖析一:两者与酸反应产生CO2气体的速率是不同的,NaHCO3溶液与酸反应,第一步即可产生气体,故速率快,而Na2CO3在第二步时才会放出气体,故若将浓度相同的盐酸滴入等体积等物质的量浓度的2种溶液中,NaHCO3溶液放出的CO2速率较快。
剖析二:根据与酸反应的化学方程式可知,Na2CO3、NaHCO3与酸反应产生CO2的物质的量之比均为1∶1,显然等质量情况下与足量酸反应,Na2CO3与酸反应产生的CO2体积大,等物质的量的2种物质,产生的气体体积相等。
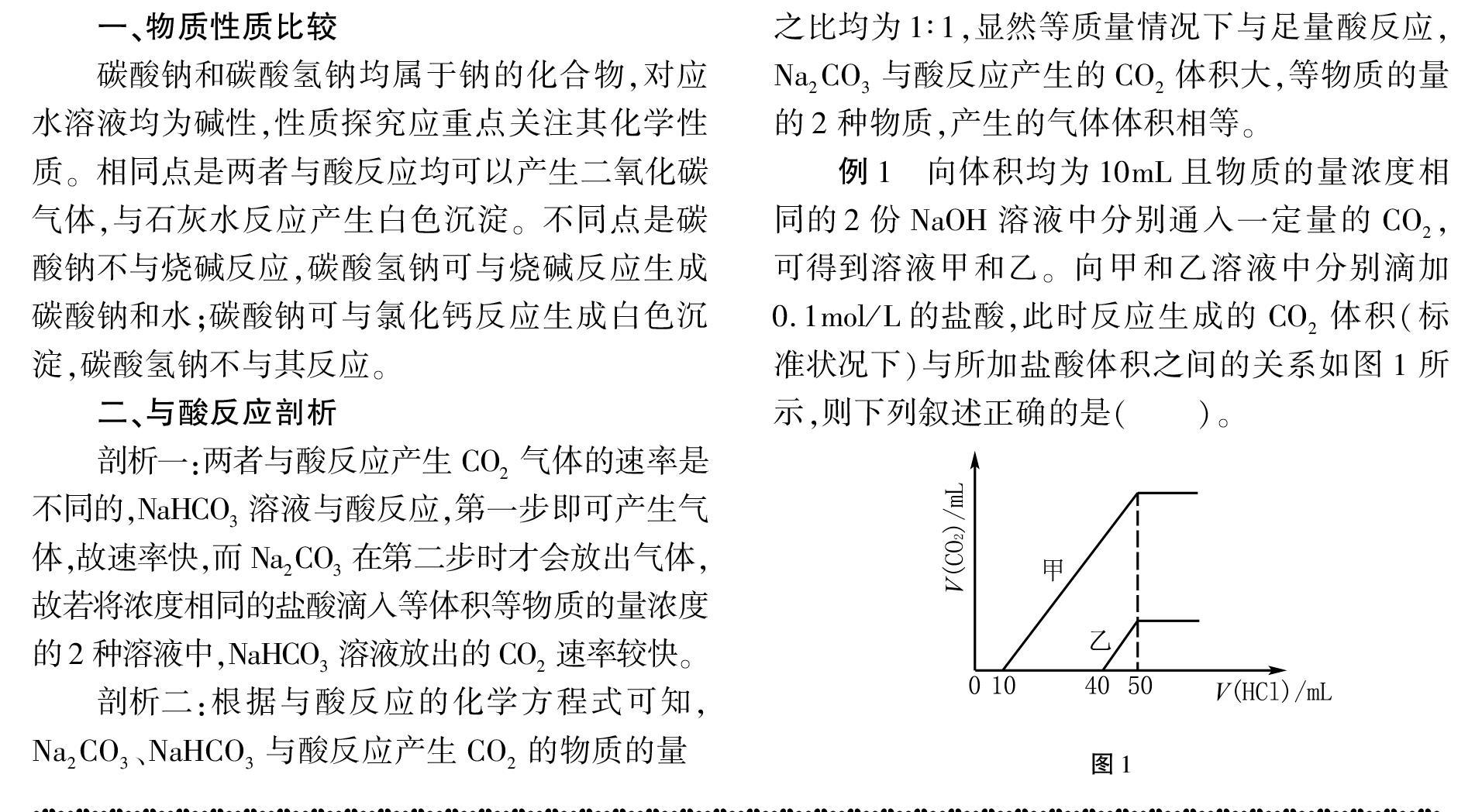
例1 向体积均为10mL且物质的量浓度相同的2份NaOH溶液中分别通入一定量的CO2,可得到溶液甲和乙。向甲和乙溶液中分别滴加0.1mol/L的盐酸,此时反应生成的CO2体积(标准状况下)与所加盐酸体积之间的关系如图1所示,则下列叙述正确的是( )。图1
A. 原NaOH溶液的物质的量浓度为0.5mol/L
B. 当0 OH-+H+H2O C. 乙溶液中含有的溶质为Na2CO3、NaHCO3 D. 乙溶液中滴加盐酸后,可产生CO2体积的最大值为11.2mL(标准状况下) 解析 A选项,根据图像可知,V(HCl)=50mL时,可得产物NaCl,由原子守恒可得 n(NaOH)=0.005mol,則原溶液c(NaOH)=0.5mol/L,正确;B选项,在NaOH中通入一定量的CO2,溶液中溶质的组成可能为NaOH和Na2CO3、Na2CO3和NaHCO3、Na2CO3、NaHCO3 4种情形。由图中HCl用量与产生的CO2气体体积关系可知甲溶液的溶质为Na2CO3和NaHCO3,故当0< V(HCl)<10mL时,甲溶液中没有CO2产生,离子方程式为 CO2-3+H+HCO-3 B错误; C选项,NaOH溶液中通入CO2,溶质不可能为NaOH和NaHCO3,由图像可知,乙溶液的溶质为NaOH和Na2CO3,错误; D选项,乙溶液中滴加HCl,产生CO2的反应阶段为 HCO-3+H+H2O+CO2↑ 反应消耗了10mL的盐酸,可知生成n(CO2)= 0.001mol,故标准状况下CO2气体的体积为 22.4mL,错误。 综上可知,正确的是A。 三、鉴别与除杂分析 鉴别方法可分为两种:固体-加热法和溶液-试剂法,为固体时可利用与澄清石灰水反应以及热稳定性差异来加以鉴别;为溶液时,可通过沉淀转化和气体转化差异来鉴别。 物质除杂同样有两种情形:除去NaHCO3溶液中混有的Na2CO3杂质,可通入CO2气体;除去Na2CO3中混有的NaHCO3杂质,可加入适量的NaOH溶液。 例2 现要除去括号中的杂质,选项所选用的试剂或方法错误的是( )。 A. Na2CO3溶液(NaHCO3):加入适量的NaOH溶液 B. NaHCO3溶液(Na2CO3):通入过量CO2气体 C. Na2O2粉末(Na2O):将混合物在氧气中加热 D. Na2CO3溶液(Na2SO4溶液):加入适量的Ba(OH)2溶液,然后过滤沉淀 解析 A选项,NaHCO3可与NaOH反应生成Na2CO3,故可用适量NaOH溶液除去NaHCO3杂质,正确;B选项,Na2CO3可与CO2反应生成NaHCO3,故可通入过量的CO2气体除去Na2CO3杂质,正确;C选项,在加热条件下,Na2O能与氧气反应生成Na2O2,故可将混有Na2O2和Na2O粉末在氧气中加热,从而除去Na2O杂质,正确;D选项,Na2CO3和Na2SO4溶液均可与Ba(OH)2溶液反应生成沉淀,故D选项的除杂方法不可行,错误。综上可知,错误的是D。 四、二者相互转化 碳酸钠与碳酸氢钠之间可以相互转化,掌握其转化方法十分必要,转化思路如图2所示。 Na2CO3 CO2、H2O;H+(少量) 固体加热;溶液(NaOH) NaHCO3 例3 下列为物质的转化关系以及给定条件,其中不可实现的是( )。 A. Al2O3NaOH(aq)NaAlO2CO2Al(OH)3 B. SO2/点燃SO3H2OH2SO4 C. 饱和NaCl(aq)NH3、CO2NaHCO3△Na2CO3 D. MgCl2(aq)石灰乳Mg(OH)2煅烧MgO 解析 A选项,Al2O3与NaOH反应可生成NaAlO2,NaAlO2与CO2反应可生成Al(OH)3,转化关系及条件对应正确;B选项,硫燃烧可生成SO2,不能生成SO3,转化关系错误;C选项,在饱和的NaCl溶液中先通入氨,然后通入CO2,可生成NaHCO3,而NaHCO3加热分解可生成Na2CO3,转化关系及条件对应正确;D选项,MgCl2溶液与石灰乳反应可生成Mg(OH)2,而Mg(OH)2的性质不稳定,通过加热可分解为MgO,转化关系及条件对应正确。综上可知,不可实现的是B。 (收稿日期:2021-09-08)
