不同蛋白水平饲料对大规格松浦镜鲤越冬后体质量损失、体成分、抗氧化及蛋白合成基因表达的影响
2021-12-09范泽吴迪李晨辉张圆圆李晋南王连生
范泽 吴迪 李晨辉 张圆圆 李晋南 王连生

摘要:研究不同饲料蛋白水平(24%、26%、28%、30%、32%、34%)对大规格松浦镜鲤越冬前后生长、体成分、抗氧化及蛋白合成基因表达的影响,前期进行完大规格松浦镜鲤对饲料蛋白质适宜需要量的研究试验后,在每个网箱中保留规格齐整,质量为(694.55±64.72) g的20尾大规格鲤鱼进行越冬试验,共18个网箱(2.0 m×2.0 m×2.0 m),时间为2019年10月31日至2020年4月28日。越冬期间水温3~8 ℃。结果表明,26%蛋白组的体质量损失率及肥满度下降比显著低于24%、32%、34%蛋白组(P<0.05),24%蛋白组的肝体比下降比显著高于其他各组(P<0.05)。各组间存活率无显著差异(P>0.05)。26%蛋白组越冬后肌肉粗蛋白含量显著高于24%蛋白组,且其下降比显著低于24%蛋白组(P<0.05)。24%组和32%组的肌肉水分含量显著高于26%组(P<0.05),32%组肌肉水分增加比显著高于26%和34%组(P<0.05)。26%蛋白组鲤鱼肝胰脏的过氧化氢酶和过氧化物酶活性显著高于其他各组(P<0.05),超氧化物歧化酶活性显著高于30%蛋白组(P<0.05),谷胱甘肽含量显著高于24%蛋白组(P<0.05)。34%蛋白组的丙二醛含量显著高于其他各组(P<0.05)。26%蛋白组的越冬后肌肉雷帕霉素受体基因表达量显著高于24%、34%蛋白组(P<0.05)。26%蛋白组的肌肉4E结合蛋白1基因表达量显著高于其他各组(P<0.05)。26%蛋白组的肌肉S6K蛋白激酶及蛋白激酶B基因表达量显著高于除24%蛋白组外的其他各组(P<0.05)。越冬试验发现,26%蛋白组鲤鱼越冬效果最佳,体质量损失率及肥满度下降比均为最低,鱼体能够储存更多的蛋白质,使机体获得较强的抗氧化能力和较低的氧化应激水平,拥有较强的自身内源蛋白质合成能力。
关键词:越冬;饲料蛋白;松浦镜鲤;体质量损失率;抗氧化;蛋白质合成
中图分类号:S963.1;S965.116 文献标志码: A
文章编号:1002-1302(2021)21-0174-07
收稿日期:2021-04-14
基金项目:国家自然科学基金(编号:31802305);中央级公益性科研院所基本科研业务费专项(编号:HSY202111Q);国家现代农业产业技术资助项目。
作者简介:范 泽(1992—),男,内蒙古扎兰屯人,硕士,研究实习员,主要从事水产动物营养与饲料研究。 E-mail:dankey1534417945@163.com。
通信作者:王连生,博士,副研究员,长期从事水产动物营养与饲料研究。E-mail:wangliansheng@hrfri.ac.cn。
鲤鱼作为池塘养殖的主要品种,2017—2019年其产量稳居国内第4名,已成为我国主导水产淡水养殖品种之一[1]。作为我国鲤鱼主养区,“三北”(东北、华北、西北)地区的鲤鱼年产量约占池塘养殖总量的50%~60%。这些地区与其他鲤鱼养殖地区最主要的差异在于冬季更为漫长寒冷。因此,在这些地区越冬成为鲤鱼养殖非常重要的一个阶段,当年鱼种的越冬体质量损失势必会降低越冬成活率和影响鱼体生理生化状态的恢复,进而影响翌年鱼种的生长和品质,致使养殖收益降低。深入研究越冬对鲤鱼生理生化状态的影响是推动鲤鱼健康养殖的基础且也是必要的工作。目前,有关越冬影响鲤鱼生理机能变化已有相关研究[2]。除此之外,越冬前投喂饲料的质量及营养水平也影响着鱼体在越冬过程中的生理生化水平,但有关饲料营养对鲤鱼越冬的影响鲜有报道。
蛋白质作为渔用饲料中最重要的营养成分,不仅决定着各组织器官的生长和修复,也是组成酶、激素和抗体等生物活性物质的主要成分[3]。饲料中适宜的蛋白水平能够促进鱼类的生长和维持机体正常代谢,但过低或过高的蛋白水平均会影响机体的正常生长发育[4-6]。目前,从研究指标来看,饲料蛋白水平对鲤鱼影响的研究主要集中于生长性能、体成分[7]、消化酶活性、抗氧化能力[8]等方面,缺乏针对越冬的试验研究。
松浦镜鲤于2008年通过全国水产原种和良种审定委员会审定,在10多年的推广过程中,养殖规模和分布地域逐年扩大,取得了良好的经济效益和社会效益,已成為我国鲤鱼主要的养殖品种[9]。笔者所在课题组在先前的研究中发现大规格松浦镜鲤(246.00±17.36) g对饲料蛋白质最适需求量分别为26%[10]。本试验在前期研究基础上探讨饲料蛋白水平对大规格松浦镜鲤越冬前后生长、体成分、抗氧化及蛋白合成基因表达的影响,研究饲料蛋白水平与鲤鱼越冬的关系,为鲤鱼在北方越冬期及越冬后的健康养殖提供科学依据和基础,为开发有利于鲤鱼越冬的饲料提供理论依据。
1 材料与方法
1.1 试验饲料
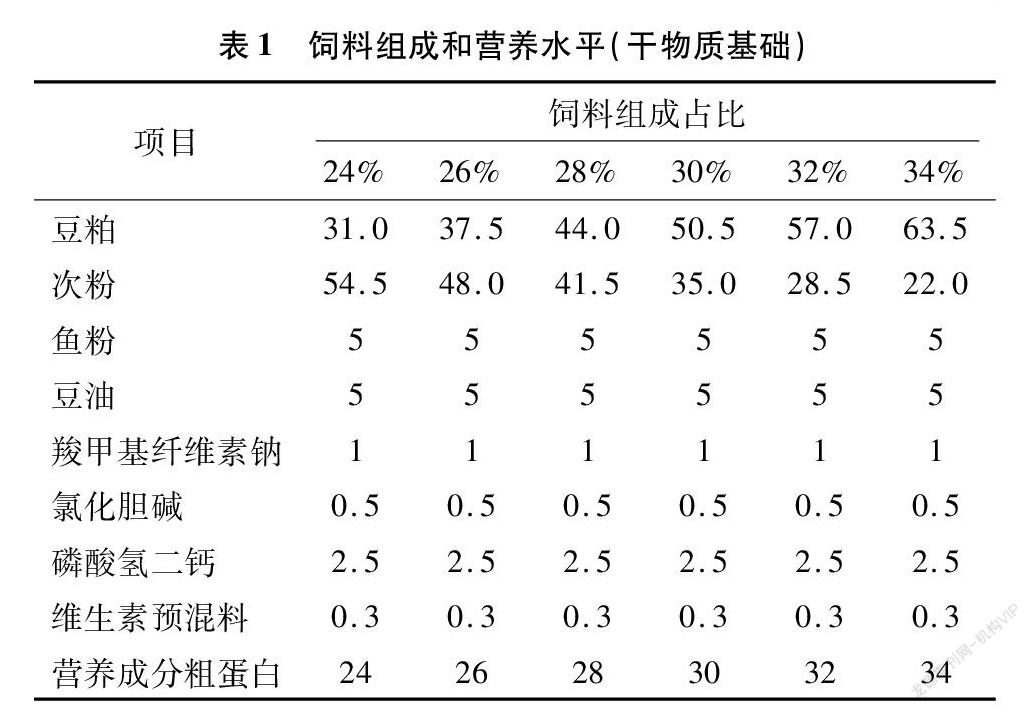
以鱼粉、豆粕为蛋白质源,豆油为脂肪源,通过设置不同水平的豆粕及次粉配制24%、26%、28%、30%、32%、34%等6组蛋白水平的试验饲料,其组成及营养水平见表1。饲料制作在哈尔滨市合禾饲料有限责任公司完成,首先将所有干性原料经粉碎机后,过60目筛,按逐级放大原则使用混匀机搅拌混匀,后依据饲料配方比例加入豆油,在混匀机中充分混合后使用饲料制粒机制成直径为3.00 mm的沉性颗粒饲料。
1.2 试验鱼及饲养管理
在进行完大规格松浦镜鲤对饲料蛋白质适宜需要量的研究试验后(2019年10月底),在每个网箱中保留规格齐整,质量为(694.46±64.72) g的20尾大规格鲤鱼进行越冬试验,共18个网箱(2.0 m×2.0 m×2.0 m),越冬期间不投喂任何食物,只进行水温检测。越冬试验时间为2019年10月31日至2020年4月28日。越冬期间水温3~8 ℃。
1.3 样本采集
越冬周期结束后对试验鱼进行计数并对所有试验鱼进行称质量,以计算存活率及增质量率;从每箱中随机取3尾鱼,对其体长进行测量,以计算肥满度;试验鱼于冰盘中迅速解剖取其肝胰脏及肌肉,样本转入-20 ℃超低温冰箱中保存备用。
1.4 试验方法
1.4.1 生长指标计算 养殖试验增质量率=(养殖试验平均终末体质量-养殖试验平均初始体质量)×100%/(养殖试验平均初始体质量);养殖试验肥满度(g/cm3)=(养殖试验平均终末体质量)/(养殖试验平均终末鱼体长)3;养殖试验肝体比=(养殖试验结束时肝胰脏质量)×100%/(养殖试验平均终末体质量);越冬后体质量损失率=(养殖试验平均终末体质量-越冬后平均体质量)×100%/(养殖殖试验平均终末体质量);越冬后肥满度(g/cm3)=(越冬后平均体质量)/(越冬后平均终末鱼体长)3;肥满度下降比=(养殖试验肥满度-越冬后肥满度)×100%/(养殖试验肥满度);越冬后肝体比=(越冬后肝胰脏质量)×100%/越冬后平均终末体质量;肝体比下降比=(养殖试验肝体比-越冬后肝体比)×100%/养殖试验肝体比;
肌肉粗蛋白下降比=(越冬前粗蛋白含量-越冬后粗蛋白含量)×100%/越冬前粗蛋白含量;肌肉粗脂肪增加比=(越冬后粗脂肪含量-越冬前粗脂肪含量)×100%/越冬前粗脂肪含量;肌肉水分增加比=(越冬后水分含量-越冬前水分含量)×100%/越冬前水分含量;越冬存活率=(越冬后试验鱼尾数)×100%/(越冬前试验鱼尾数)。
1.4.2 肌肉成分的测定 粗脂肪含量采用索氏抽提法(GB/T 6433—1994饲料粗脂肪测定方法)进行测定,水分及灰分分别采用常压恒温烘干法(GB 6435—1986饲养水分的测定方法)测定,550 ℃ 灼烧法 (GB/T 6438—2007饲料中粗灰分的测定)进行测定。
1.4.3 肝胰脏抗氧化酶活性的测定 粗酶液的制备:肝胰脏在冰生理盐水中漂洗,除去血液,滤纸拭干,用移液管加入9倍于组织块质量的预冷匀浆介质(0.85%生理盐水),使用电动匀浆器进行匀浆,4 ℃ 4 500 r/min离心15 min,取上清液于 -80 ℃ 冰箱备用。肝胰脏中的超氧化物歧化酶、过氧化氢酶、过氧化物酶活性和谷胱甘肽、丙二醛含量使用南京建成生物工程研究所试剂盒测定(货号分别是:A001-3、A007-1-1、A084-1-1、A006-2-1、A003-1)。
1.5 蛋白质代谢相关基因的相对表达量测定
越冬周期结束后每个网箱随机取3尾鱼,取其肝胰脏于液氮中研磨。利用Trizol法提取各组织总RNA,参照TaKaRa PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)(Code No:RR047A)说明书,将总RNA反转录为cDNA。
根据GenBank中现有的鲤鱼雷帕霉素靶蛋白、4E-结合蛋白1、磷脂酰肌醇-3-激酶、蛋白激酶B、S6K蛋白激酶及β-actin保守序列设计引物。所有引物均由生工生物工程(上海)股份有限公司合成(表2)。
实时荧光定量PCR反应根据SYBR Premix Ex TaqTM(Tli RNaseH Plus)(Code:RR420A)试剂盒说明书进行,采用SYBR Green染色法,在Applied Biosystems 7500 Real Time PCR System实时PCR检测系统下进行。为了避免擴增批次间存在差异,目的基因与其对应的内参基因同时扩增,每个模板均做3个重复,得到3个CT值,取其平均值作为最终CT值,后运用比较CT法(ΔΔCT)对所得数据进行分析比较进而得到各模板中各基因的相对表达量,计算公式为:相对表达量=2-ΔΔCT=2-[(CT处理-CT内参)-(CT对照-CT内参)]。
1.6 数据统计
所有数据均用Excel 2007及SPSS 22进行分析处理。利用Excel软件制作各指标的标准曲线,并利用标准曲线计算得出各样品中对应指标的活性含量。所有数据均以“平均值±标准差”表示,并利用SPSS 19.0统计软件进行单因素方差分析(One-way ANOVA),差异达到显著水平(P<0.05),则进行Duncans新复极差法多重比较。
2 结果与分析
2.1 不同蛋白水平饲料对松浦镜鲤越冬后鱼体质量及存活率的影响
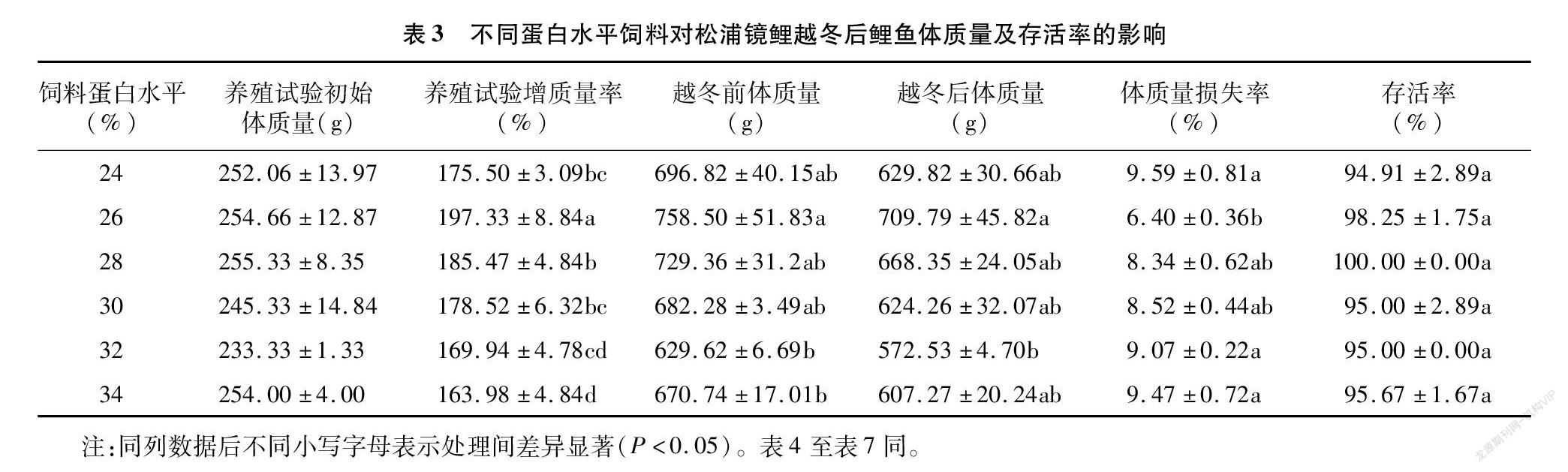
从表3可以看出,越冬前的8周养殖试验中,26%蛋白组的平均质量为(758.50±51.83) g,显著高于32%蛋白组(629.62±6.69) g、34%蛋白组(670.74±17.01) g(P<0.05),26%蛋白组增质量率为(197.33±8.84)%显著高于其他各组(P<0.05)。越冬后,各蛋白水平组鲤鱼体质量呈现一定比例下降,其中26%蛋白组的越冬后体质量为(709.79±45.82) g,显著高于32%蛋白组(572.53±4.70) g,其体质量损失率为(6.37±1.02)%显著低于24%、32%、34%蛋白组(P<0.05)。越冬存活率在各组间无显著差异(P>0.05),以24%蛋白组为最低(94.91±2.89)%。
2.2 不同蛋白水平饲料对松浦镜鲤越冬后形体指标的影响
从表4可以看出,各蛋白水平组的肥满度和肝体比均表现出一定比例的下降。越冬前,各组间肥满度无显著差异(P>0.05),而越冬后,26%蛋白组的肥满度为(3.57±0.12) g/cm3,显著高于其他各组(P<0.05),其下降比为(1.64±0.49)%,显著低于其余各组。越冬前,各组间肝体比亦无显著差异,而越冬后,26%蛋白组为(1.54±0.15)%和28%蛋白组为(1.53±0.19)%的肝体比显著低于其他各组(P<0.05)。24%蛋白组的肝体比下降比为(24.77%±7.63%)显著高于其他各组(P<0.05),其他各组间无显著差异(P>0.05)。
2.3 不同蛋白水平饲料对松浦镜鲤越冬后肌肉营养成分的影响
从表5可以看出,各蛋白水平组越冬后肌肉粗蛋白呈现一定比例的下降,其中26%蛋白组越冬后肌肉粗蛋白含量为(15.74±0.07)%最高,显著高于24%蛋白组(7.25±0.32)%,且其下降比为最低(7.45±1.44)%,显著低于其余各组(P<0.05)。各蛋白水平组越冬后肌肉粗脂肪呈现一定比例的增加,28%蛋白组的越冬后肌肉粗脂肪含量为(6.15±0.73)%显著高于24%蛋白组(5.37±0.30)%和30%蛋白组(5.15±0.16)%(P<0.05),32%蛋白组的粗脂肪增加比为(134.90±11.14)%显著高于其他各组(P<0.05)。各蛋白水平组越冬后肌肉水分整体呈现一定比例的增加,但各组间水分增加比并无显著差异(P<0.05),24%蛋白组的越冬后肌肉水分含量为(79.00±0.31)%显著高于28%蛋白组(77.54±0.49)%(P<0.05),32%组肌肉水分增加比显著高于26%和34%组(P<0.05)。
2.4 不同蛋白水平饲料对松浦镜鲤越冬后肝胰脏抗氧化酶活性的影响
从表6可以看出,越冬后26%蛋白组鲤鱼的过氧化氢酶和过氧化物酶活性显著高于其他各组(P<0.05),超氧化物歧化酶活性显著高于30%蛋白组(P<0.05),谷胱甘肽含量显著高于24%蛋白组(P<0.05)。越冬后34%蛋白组的丙二醛含量显著高于其他各组(P<0.05)。
2.5 不同蛋白水平饲料对松浦镜鲤越冬后蛋白合成相关基因表达的影响
从表7可以看出,26%蛋白组的越冬后肌肉雷帕霉素靶蛋白基因相对表达量与28%蛋白组并列最高,显著高于24%、34%蛋白组(P<0.05)。26%蛋白组的越冬后肌肉4E-结合蛋白1基因相对表达量最高,显著高于其他各组(P<0.05)。26%蛋白组的越冬后肌肉蛋白激酶B基因相对表达量最高,显著高于除24%蛋白组以外的其他各组(P<0.05)。
3 讨论与结论
松浦镜鲤是在德国镜鲤选育系基础上进一步培育出的,无论在鳞被、生长,还是在抗逆、抗病方面较德国镜鲤具有较为显著的优势[11]。于淼从形态学、组织学及生化组成等3个方面综合分析了越冬对松浦镜鲤生存、生长的影响[12]。本试验从越冬前饲料蛋白供给水平入手研究饲料营养对鲤鱼越冬的潜在影响。
实际应用领域中体质量、肥满度、肝体比常作为评估鱼体生理生化或营养状况的重要参数。在本试验中,越冬后各蛋白组的体质量损失率在6.37%~9.49%,其中以26%蛋白组的体质量损失率为最低;各蛋白组的肥满度下降比在5.89%~23.61%,其中以26%蛋白组为最低,而于淼发现越冬后松浦镜鲤(248.87 ±15.75) g的体质量损失率达10.8%,肥满度降低比达23.26%[12]。而这种差异可能主要源于2个方面:(1)一般而言,鱼规格大且肥满度高,则越冬效果好[13]。在本研究中松浦镜鲤越冬前体质量均为(694.55±64.72) g,而后者的松浦镜鲤越冬前体质量均为(248.87±15.75) g,规格差异影响了二者的越冬效果;(2)除规格外,越冬前饲料营养供给会影响鱼类的越冬效果。Charo-Karisa等发现,40%蛋白水平的饲料相较于天然饵料能够显著提升尼罗罗非鱼(Oreochromis niloticus)的耐寒性[14]。本试验发现,当越冬前饲料蛋白水平在26%时,松浦镜鲤的体质量损失率为(6.37±1.02)%,相较于于淼的研究结果[12],体质量损失率大约降低3.5%,而当饲料蛋白水平低于26%或高于30%时,体质量损失率则会显著上升,表明越冬前适宜饲料蛋白供给能够促进鱼类平稳越冬,饲料蛋白供给过多或过少均会影响鱼类越冬效果。在形态学指标中,肝体比可直接反映鱼类营养状态。越冬期间由于低温和饥饿的双重限制,鱼体分解肝脏内的能源物供能,降低肝质量,肝体比也随之降低[15-16],本试验结果同样印证了上述观点。但需要指出的是本试验发现不同蛋白组间肝体比下降比存在较大差异,其中以24%蛋白组的下降比显著高于其他各组,这可能与越冬前饲料蛋白供给过少影响鲤鱼鱼体营养物质储备有关,越冬期间需要大量消耗肝胰脏的储能物质,以维持机体正常的生理机能。
鱼的种类及食性、温度、越冬前营养状态、饥饿程度的差异均与越冬时鱼类营养物质利用的顺序先后和数量多少密切相关。于淼研究发现,在冰下阶段(170~325 d)肌肉蛋白质开始消耗,整个越冬期肌肉蛋白质含量下降比为5.35%,越冬后肌肉脂肪含量与体质量损失率呈显著负相关,说明越冬后肌肉蛋白水平能体现越冬期体质量损失程度[12]。本研究主要考察了饲料蛋白水平对整个越冬期肌肉营养物质的影响情况,初步探讨饲料外源营养如何影响松浦镜鲤内源营养在越冬期间的利用。经历整个越冬期,各蛋白组的肌肉粗蛋白含量均减少,下降比在8.97%~24.38%之间,以26%蛋白组的下降比为最低,24%蛋白组的下降比为最高,与于淼的研究结果[12]相比,本试验中各蛋白组松浦镜鲤的肌肉粗蛋白含量下降比均处于高位,表明规格差异可能是影响越冬过程中机体营养物质利用的关键因素。同时表明越冬前饲料蛋白供给过少会影响鱼体肌肉蛋白质的沉积及能量物质的储备,使得过多的蛋白质用于维持机体的正常能量供应,这一点也被越冬后肌肉脂肪含量的变化情况所证实。本试验发现,越冬后各蛋白组松浦镜鲤肌肉脂肪含量相较于越冬前显著提升,主要原因可能是越冬期间机体脂肪持续供能,致使越冬后期脂肪含量已处于较低水平,造成供能不足,因此机体动用蛋白质氧化分解供能,并转化为脂肪和糖類。蛋白质氧化分解的程度可能是影响松浦镜鲤越冬后代谢机能恢复的主要因素,但其具体作用机制需要进一步研究。此外,越冬期间各试验组松浦镜鲤肌肉水分含量明显增加,原因可能是体液将蛋白质和脂肪分解代谢后留出的空间充满,增加了肌肉水分含量[16]。这与其他鱼类饥饿状态下肌肉水分含量变化情况相似[17]。
越冬期间,鱼类需克服来自低温冷应激和食物匮乏的双重压力。相关研究表明,急性和慢性冷应激、长期饥饿都会引起鱼类组织中的氧化应激[18-20]。鲤鱼在长期冷应激后,肝脏和白肌中的抗氧化酶基因的表达也出现显著升高[21]。因此,氧化损伤和抗氧化能力能够反映越冬后鱼类的健康状况[22]。武文一研究发现,越冬前强化饲料中含有31.53%蛋白和4%脂肪,降低了越冬期间草鱼初始体质量(27.55±1.57) g产生的氧化应激,提升了鱼体的抗氧化能力,保证了草鱼的安全越冬[23]。本试验结果表明,无论是在抗氧化酶活性方面,还是氧化产物丙二醛含量方面,26%蛋白组均表现最优,使机体获得了较强的抗氧化能力和较低的氧化应激水平。因此,明确养殖鱼类越冬前最佳饲料蛋白质供给水平有助于鱼类在越冬期间拥有更强的抗氧化能力和免疫能力,有利于鱼类安全越冬。
低温冷应激影响蛋白质的分解和合成代谢[24]。鱼类生长是机体合成代谢不断积累的结果,低温冷应激除了通过限制鱼体摄食和消化吸收功能,减少合成代谢所需的营养原料而降低鱼类的生长速度外[25],还会通过影响机体蛋白质合成通路相关基因的表达,制约机体的蛋白合成能力[26]。雷帕霉素受体信号通路是影响鱼类蛋白质合成的主要信号通路,活化后的雷帕霉素靶蛋白可以调节2条平行的信号通路:4E-结合蛋白通路和S6激酶通路。雷帕霉素受体复合物直接磷酸化4E-结合蛋白和S6K蛋白激酶,从而促进蛋白合成[27-28]。鲁栋梁研究发现,在低温条件下饥饿3 d显著降低了斑马鱼雷帕霉素靶蛋白和S6K蛋白激酶蛋白的磷酸化水平及基因表达水平[26],揭示雷帕霉素受体信号通路对斑马鱼冷应激耐受机制有一定的调控作用,同时抑制雷帕霉素受体信号通路可能是饥饿激活各种冷应激耐受机制的调控途径。在笔者所在课题组前期的研究中發现,26%蛋白水平能够显著提升松浦镜鲤肌肉蛋白合成相关基因的表达[10]。在越冬后,无论是哺乳动物雷帕霉素靶栋(mTOR)信号通路上游的磷脂酰肌醇-3-激酶和蛋白激酶B基因表达量,还是雷帕霉素靶蛋白基因表达量,以及下游的4E-结合蛋白和S6K蛋白激酶基因表达量,同样均以26%蛋白组为最高,表明越冬前适宜的饲料蛋白供给能够显著增强机体蛋白合成能力,有助于机体在越冬期间自身内源蛋白质的合成,这与肌肉粗蛋白含量结果相吻合。此外,与鲁栋梁的短期低温冷应激试验[26]不同,首先越冬前期机体脂肪和糖原为主要功能原料,后期肌肉蛋白质参与供能[12],内源蛋白质消耗促进机体内源蛋白质合成,因此雷帕霉素受体信号通路被激活,相关蛋白和基因表达量上升;其次,越冬后期水温逐渐上升,鲤鱼能够通过摄取底泥中残留的营养物质,逐步满足蛋白质合成所需的营养原料[12],进而激活雷帕霉素受体信号通路。但饲料蛋白质调控越冬期松浦镜鲤的肌肉蛋白质合成的机体作用机制仍需进一步研究。
越冬前饲料蛋白水平为26%对大规格松浦镜鲤安全越冬作用最为明显,效果最佳。在整个越冬期,26%蛋白组能够使体质量损失率及肥满度降低比最小化,使鱼体能够储存更多的蛋白质,并获得较强的抗氧化能力和较低的氧化应激水平,拥有较强的自身内源蛋白质合成能力。
参考文献:
[1]农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.中国渔业统计年鉴:2020[M]. 北京:中国农业出版社,2020.
[2]于 淼,胡雪松,李池陶,等. 松浦镜鲤越冬期的形态、组织结构及生化组成变化[J]. 中国水产科学,2015,22(3):460-468.
[3]Jobling M.National Research Council (NRC):nutrient requirements of fish and shrimp[J]. Aquaculture International,2012,20(3):601-602.
[4]Teles A O,Couto A,Enes P,et al. Dietary protein requirements of fish-a meta-analysis[J]. Reviews in Aquaculture,2020,12(3):1445-1477.
[5]Su H A,Han T,Li X Y,et al. Dietary protein requirement of juvenile kelp grouper (Epinephelus moara)[J]. Aquaculture Research,2019,50(12):3783-3792.
[6]Ye W,Han D,Zhu X M,et al. Comparative study on dietary protein requirements for juvenile and pre-adult gibel carp (Carassius auratus gibelio var. CAS Ⅲ)[J]. Aquaculture Nutrition,2017,23(4):755-765.
[7]孙金辉,范 泽,程镇燕,等. 降低饲料中蛋白质水平对鲤生长性能及肌肉营养成分的影响[J]. 中国饲料,2016(19):33-38.
[8]孙金辉,范 泽,张美静,等. 饲料蛋白水平对鲤幼鱼肝功能和抗氧化能力的影响[J]. 南方水产科学,2017,13(3):113-119.
[9]石连玉,李池陶,葛彦龙,等. 黑龙江水产研究所鲤育种概要[J]. 水产学杂志,2016,29(3):1-8.
[10]Fan Z,Wu D,Li J N,et al. Dietary protein requirement for large-size Songpu mirror carp (Cyprinus carpio Songpu)[J]. Aquaculture Nutrition,2020,26(5):1748-1759.
[11]李池陶,张玉勇,贾智英,等. 松浦镜鲤与德国镜鲤选育系(F4)的可量性状、鳞片数比较[J]. 水产学杂志,2009,22(2):53-55,61.
[12]于 淼.松浦镜鲤越冬期的形态、组织学结构及生化组成变化研究[D]. 上海:上海海洋大学,2015:1-2.
[13]Fullerton A H,Garvey J E,Wright R A,et al. Overwinter growth and survival of largemouth bass:interactions among size,food,origin,and winter severity[J]. Transactions of the American Fisheries Society,2000,129(1):1-12.
[14]Charo-Karisa H,Rezk M A,Bovenhuis H,et al. Effects of rearing conditions on low-temperature tolerance of Nile tilapia,Oreochromis niloticus,juveniles[J]. Aquaculture,2005,249:115-123.
[15]宋昭彬,何学福.鱼类饥饿研究现状[J]. 动物学杂志,1998,33(1):48-52.
[16]贾明亮.低温胁迫对奥尼罗非鱼的生长、肌肉组成和血液生理生化指标的影响[D]. 湛江:广东海洋大学,2010.
[17]Kojima J T,Leito N J,Menossi O C C,et al. Short periods of food restriction do not affect growth,survival or muscle development on pacu larvae[J]. Aquaculture,2015,436:137-142.
[18]Tseng Y C,Chen R D,Lucassen M,et al. Exploring uncoupling proteins and antioxidant mechanisms under acute cold exposure in brains of fish[J]. PLoS One,2011,6(3):e18180.
[19]Rossi A,Bacchetta C,Cazenave J.Effect of thermal stress on metabolic and oxidative stress biomarkers of Hoplosternum littorale (Teleostei,Callichthyidae)[J]. Ecological Indicators,2017,79:361-370.
[20]Bayir A,Sirkecioglu A N,Bayir M,et al. Metabolic responses to prolonged starvation,food restriction,and refeeding in the brown trout,Salmo trutta:Oxidative stress and antioxidant defenses[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2011,159(4):191-196.
[21]Gracey A Y,Fraser E J,Li W,et al. Coping with cold:an integrative,multitissue analysis of the transcriptome of a poikilothermic vertebrate[J]. PNAS,2004,101(48):16970-16975.
[22]Wu P,Qu B A,Feng L,et al. Dietary histidine deficiency induced flesh quality loss associated with changes in muscle nutritive composition,antioxidant capacity,Nrf2 and TOR signaling molecules in on-growing grass carp (Ctenopharyngodon idella)[J]. Aquaculture,2020,526:735399.
[23]武文一. 越冬脅迫对草鱼的影响及其应对的营养饲料策略研究[D]. 杨凌:西北农林科技大学,2020:29-30,59-60.
[24]许友卿,郑一民,丁兆坤. 冷应激对水生动物代谢的影响及调控研究进展[J]. 中国水产科学,2017,24(5):1149-1159.
[25]Sun Z J,Xia S D,Feng S M,et al. Effects of water temperature on survival,growth,digestive enzyme activities,and body composition of the leopard coral grouper Plectropomus leopardus[J]. Fisheries Science,2015,81(1):107-112.
[26]鲁栋梁.饥饿提高斑马鱼(Danio rerio)冷应激耐受的机制探究[D]. 上海:华东师范大学,2019:11.
[27]辛 芳,王 雷,刘 梅,等. 水产动物雷帕霉素受体信号通路的研究进展[J]. 海洋科学,2016,40(1):147-154.
[28]Ma X M,Blenis J.Molecular mechanisms of mTOR-mediated translational control[J]. Nature Reviews Molecular Cell Biology,2009,10(5):307-318.
