白刺链霉菌CT205诱变及其制剂对芹菜根腐病的生防效果
2021-12-09从炳成王小姣李梦雅文丽王世梅
从炳成 王小姣 李梦雅 文丽 王世梅


摘要:以生防菌株白刺链霉菌CT205为材料,通过诱变选育高效突变菌株,并探索其生物制剂对芹菜根腐病的防控效果。菌株CT205经UV-LiCl复合诱变获得一株遗传稳定、相对高效的突变菌株U-L-4,液体发酵其活性物质产量达到42 mg/L,较野生菌株提高55.56%。利用突变株U-L-4固体发酵,制备生物有机肥,通过田间试验防控芹菜土传病害,结果表明,施用放线菌生物有机肥可有效防控芹菜根腐病,显著促进植株生长,芹菜产量增加75.00%,芹菜根际病原真菌-尖胞镰刀菌数量显著降低,改善了芹菜根际微生物群落组成。研究结果可为生防制剂防控土传病害提供理论依据。
关键词:诱变育种;生物防控;芹菜根腐病;微生物群落;白刺链霉菌
中图分类号: S436.36 文献标志码: A
文章编号:1002-1302(2021)21-0138-05
收稿日期:2021-03-23
基金项目:国家自然科学基金(编号:41671256);江苏省泰州市科技支撑计划(农业)项目(编号:TN202015)。
作者简介:从炳成(1995—),男,山东滨州人,硕士研究生,研究方向为土壤微生物。E-mail:2019103123@njau.edu.cn。
通信作者:王世梅,博士,教授,主要从事微生物发酵与土传病害生物防治。E-mail:smwang@njau.edu.cn。
芹菜是伞形科耐寒性蔬菜,营养价值高,具有降血压、清肠利便、利尿消肿等作用[1-2]。近年来芹菜连作普遍,土传根腐病时常发生,严重影响产量[3]。芹菜根腐病致病菌主要有尖孢镰刀菌(Fusarium oxysporum)、侧雄腐霉菌(Pythium paroecandrum)及核盘菌(Sclerotinia sclerotiorum)等,病原菌的孢子或菌核可在土壤中潜伏多年,常规的物理及化学手段难以有效根除,生物防控绿色、高效,近年通过生防制剂防控土传病害的有效案例多有报道[4]。
放线菌在防控土传病害、促进植株生长等方面发挥着重要作用。文献报道,放线菌具有产生拮抗物质及改善根际微生物群落结构达到防控植物病害的作用[5-6]。由于微生物的遗传不稳定性,随着菌株传代次数的增加,拮抗菌产生活性物质的能力会下降,经过诱变处理可获得相对高产的菌株,单一诱变剂诱变微生物的方法很多,但突变株易发生回复突变[7],而多种诱变剂的复合诱变具有协同、高效的作用。白刺链霉菌(Streptomyces albospinus)CT205是实验室保存的一株抗菌谱广泛、对植物真菌病害具有良好防控效果的生防菌株,其代谢产生的活性物质为环己酰亚胺[8-9],本研究通过对菌株CT205进行物理和化学复合诱变获得相对高效的突变株,制备生防制剂,通过田间试验研究其对芹菜根腐病的生防效果。
1 材料与方法
1.1 材料
菌株S. albospinus CT205实验室保存。种子培养基:葡萄糖45.0 g,大豆粉30.0 g,酵母粉5.0 g,CaCO3 5.0 g,去离子水1 L,pH值 7.5;发酵培养基:蔗糖 20.0 g,可溶性淀粉 30.0 g,大豆粉 8.0 g,CaCO3 3.0 g,蛋白胨2.0 g,NaCl 2.0 g,MgSO4·7H2O 0.5 g,K2HPO4·7H2O 0.5 g,去离子水1 L,pH值8.0。
1.2 高效生防菌的诱变筛选
1.2.1 菌株CT205单孢子悬液制备 白刺链霉菌菌株CT205划线接种于PDA平板上,28 ℃培养,待分生孢子形成,刮取分生孢子制备孢子悬液,无菌脱脂棉过滤去除菌丝体,然后显微计数,将孢子浓度调整为108个/mL。
1.2.2 UV+LiCl复合诱变及突变株筛选 在直径90 mm培养皿中加入10 mL孢子悬液,磁力搅拌器放在距离紫外(UV)灯的垂直高度约30 cm处,培养皿放在磁力搅拌器上打开皿盖,适宜转速缓慢搅动,照射时间设置0.5、1、2、4、6 min等5个处理,照射结束暗处理30 min,孢子悬液系列稀释后,取10-3、10-4系列稀释液各100 μL,涂布在含有 0.1%~0.6% LiCl的PDA平板上培养,每个处理5個重复,28 ℃避光培养,设置空白处理对照。菌落长出后统计不同处理菌落致死率,选取致死率 70%~80%的处理,挑选与野生型菌落形态相似或不同的菌落[10]。先以酵母菌为指示菌通过拮抗圈检测拮抗活性进行初筛,然后通过摇瓶液体发酵进行复筛,即菌株的分生孢子接种在种子培养基中,在28 ℃ 170 r/min的摇床中培养48 h,然后转接到发酵培养基中于相同条件下培养96 h,发酵液 6 000 r/min 离心 10 min,取上清液,用生物活性法检测发酵上清液中活性物质的含量[11],在此基础上选择传代稳定、效价高的突变菌株制备固体制剂。
1.2.3 突变株U-L-4对芹菜根腐病病原菌的拮抗作用 芹菜根腐病病原菌尖孢镰刀菌(Fusarium oxysporum) J01由前期实验室分离保存,并经柯赫氏法则验证其致病性[11]。用平板对峙法测试诱变菌株U-L-4及野生株CT205对病原菌的拮抗效果。将诱变菌株与野生株、F. oxysporum J01分别接种在PDA平板于28 ℃培养7 d。用无菌打孔器打取直径5 mm的菌块,将病原菌菌块放置在PDA平板中央,以菌块为中心,在距离菌块 20 mm 处两侧对称接种生防菌株,并设置对照,每处理重复3次,28 ℃培养5 d,测定菌株对病原菌的抑制率。抑制率=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径)×100%。
1.2.4 突变株的固体发酵及生物有机肥制备 根据前期固体发酵条件的优化,固体发酵配方由以下比例组成,细土与沙 ∶麦麸 ∶花生饼 ∶椰糠 ∶小米 ∶肉骨粉=4 ∶2 ∶1 ∶1 ∶1 ∶1,料水比1 ∶0.8,混合搅拌均匀后,装袋121 ℃ 30 min灭菌,按10%的接种量接种种子液,分装浅盘,厚度2.0~2.5 cm,28 ℃ 培养14 d,取样稀释涂布测其活菌数。细土:取南京麒麟镇后村菜园土(黄棕壤)研磨处理,细土与沙过20目筛,肉骨粉由华中农业大学资环学院李国庆教授提供。固体发酵制备的菌剂,按10%比例复合有机肥制备生物有机肥,有机肥由淮安柴米禾生物科技公司提供。
1.2.5 田间试验 2019年9—11月,在南京溧水华城蔬菜种植合作社进行田间试验。土壤类型为马肝土,含全氮1.87 g/kg、速效磷172.4 mg/kg、速效鉀155.23 mg/kg、有机质26.77 g/kg,pH值7.18,土壤中尖孢镰刀菌计数为2.3×104 CFU/g。大棚种植前施用普通有机肥1 500 kg/hm2和三元复合肥(纯N、P2O5、K2O含量均为16%)、尿素(N>46%)、硫酸钾(K2O>52%)各300 kg/hm2,作基肥,撒施深翻整平、培垄。设置U-L-4生物有机肥(108 CFU/g)、木霉生物有机肥(淮安柴米禾生物科技公司提供,木霉有效活菌数108 CFU/g)和对照3个处理,大棚等面积分9块,每个处理3个重复,小区面积2×2 m2。U-L-4生物有机肥处理减施10%三元复合肥。
移栽35 d的芹菜苗,株距20 cm,生物有机肥处理每株穴施10 g。移栽种植后35 d,统计不同处理芹菜发病情况,取不同处理1×1 m2芹菜植株连根拔起,统计生物量,计算产量。取芹菜根际土,稀释涂布法测定土壤中细菌、放线菌、真菌以及尖孢镰刀菌的数量。尖孢镰刀菌用Komada选择性培养基(K2HPO4 1.0 g,MgSO4 0.5 g,KCl 0.5 g,Fe-EDTA 0.01 g,天门冬酰胺 2.0 g,D-半乳糖20.0 g,琼脂20.0 g,去离子水1 L,pH 值7.2~7.4)计数。
1.2.6 数据处理与统计 本研究数据利用Microsoft Office Excel 2010、SPSS BASE ver.25.0统计分析,在α=0.05水平上进行差异显著性分析。
2 结果与分析
2.1 高效诱变菌株的筛选
由图1可见,随着UV处理时间的延长,致死率不断增加,1~2 min致死率急剧上升,4~6 min致死率处于90%左右,6 min时致死率接近100%。
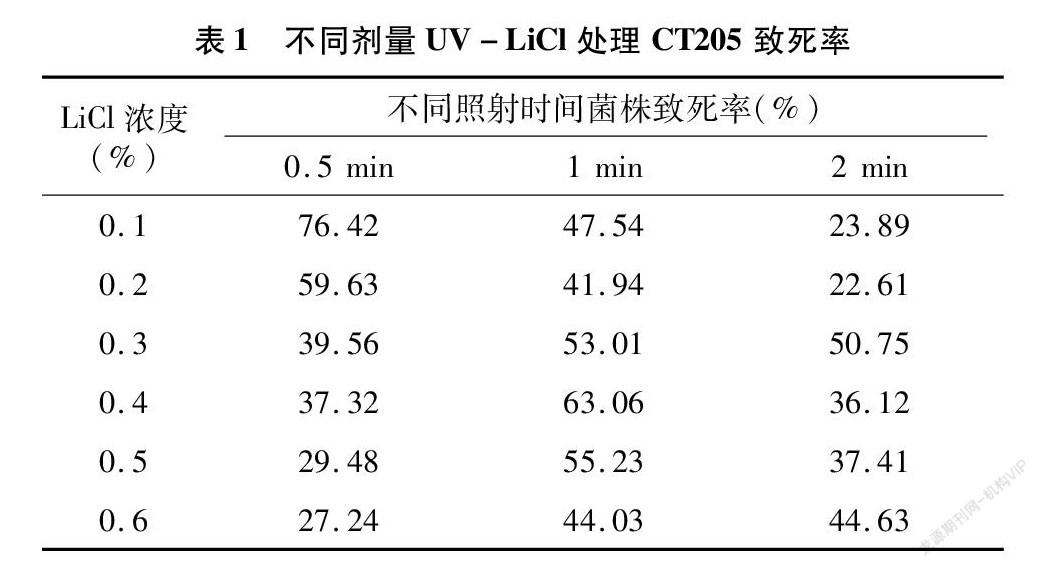
参考UV诱变处理的致死率结果,选择0.5、1、2 min 等3个UV照射剂量,进行UV-LiCl复合诱变处理,结果(表1)发现,经紫外照射0.5 min后,致死率伴随LiCl浓度的增加而出现下降的趋势,而1 min与2 min UV照射与0.1%~0.6%的LiCl诱变结合致死率无明显规律。根据致死率,选择在0.5 min UV和0.1% LiCl处理中挑选菌落。
共挑取105个菌落,通过与酵母菌拮抗试验对比得到20株正突变菌。5次传代培养后,发现有12株菌株拮抗能力下降。剩余8株菌株依次编号 U-L-1、U-L-2、U-L-3、…、U-L-8,分别测定2次液体发酵上清液中环己酰亚胺的含量,结果发现诱变株U-L-2与U-L-4的产量较高,达到42 mg/L左右,但传代后菌株U-L-2生长缓慢、分生孢子不丰富,最终选择U-L-4进行后续试验,其活性物质产量较野生菌株提高了55.56%(图2)。
2.2 突变株U-L-4对病原菌抑制效果
对峙试验结果表明,突变株U-L-4与野生型CT205均对芹菜根腐病病原菌尖孢镰刀菌表现出良好的抑菌效果(图3),与野生型CT205相比,诱变菌株的抑菌能力显著提高,对病原菌的抑菌率达到70.31%(表2),因此后续利用诱变菌株U-L-4进行固体发酵及对芹菜根腐病进行防控。
2.3 突变菌株U-L-4固体发酵及生物有机肥制备
菌株U-L-4种子液按10%接种量接种后 3 d,菌体在培养基上生长旺盛,基质表面出现白色菌丝体。接种后7 d,基质表面的白色变为灰色(图4),基质散发放线菌特有的“土腥味”,镜检发现大量菌丝及少量分生孢子。培养14 d,取样镜检发现大量分生孢子,然后活菌计数,U-L-4固体制剂活菌数达8.0×108 CFU/g。按10%比例复合有机肥制备生物有机肥。
2.4 田间试验结果
2.4.1 不同处理芹菜生物量及产量的差异 结果表明,施用U-L-4生物有机肥及木霉生物有机肥与对照相比,芹菜的株高、鲜质量等生物量显著增加(图5、表3)。对照处理的芹菜发病率为27.91%,经观察发病植株根基部出现一定程度的腐烂且有褐黄色水渍。木霉生物有机肥处理的芹菜发病率为6.67%,发病芹菜根基部出现断口,无明显水渍。U-L-4生物有机肥处理植株没有出现发病植株。经统计U-L-4生物有机肥处理和木霉生物有机肥处理的芹菜产量分别达到20 979、15 984 kg/hm2,分别比对照提高了75.00%、33.33%。
2.4.2 不同处理芹菜植株根际主要微生物数量变化 施用U-L-4生物有机肥及木霉生物有机肥处理芹菜根际主要微生物数量发生显著变化(表4)。U-L-4生物有机肥处理后,根际土中细菌数量较木霉及对照处理显著降低,放线菌数量较木霉及对照处理显著增加。U-L-4生物有机肥与木霉生物有机肥处理根际土壤中真菌的数量变化差异不显著,但与对照相比显著降低。比较各处理根际土壤中尖孢镰刀菌的数量变化,发现U-L-4生物有机肥及木霉生物有机肥均能显著降低尖孢镰刀菌的数量,但U-L-4生物有机肥处理的效果更好,尖孢镰刀菌的数量降低一个数量级,显著改善了芹菜根际微生物群落组成。
3 讨论与结论
微生物野生菌株效价低是常见问题,妨碍了功能微生物在实际生产中的应用[12]。诱变选育是筛选高效菌株的重要途径,常规诱变方法包括物理诱变、化学诱变、生物诱变、复合诱变等[13],其中复合诱变是使用2种以上或多次使用1种诱变剂的重要诱变手段,通常诱变剂之间具有协同作用。如 UV-LiCl 复合诱变, LiCl本身没有诱变作用, 但通过协同作用可以提高UV的诱变效果从而可获得更为高效的诱变菌株。李蕤等对木霉T6采用UV-LiCl复合诱变后获得一株产几丁质酶和葡聚糖酶能力显著提升的突变菌株[14]。在对微生物诱变选育时要在合适诱变致死率的处理中挑选诱变菌株进行研究,研究发现在70%~80%的诱变致死率中更易出现正突变菌株[15]。本研究采用UV-LiCl复合诱变在70%~80%的诱变致死率中筛选获得1株正突变菌株U-L-4,其抑菌活性物质产量较野生型提高了55.56%。
芹菜根腐病病原真菌可以在土壤中存活多年,土传病害一旦发生,难以有效防治[16]。土地熏蒸是一种化学防控措施,使用棉隆消毒剂对土地熏蒸有一定效果,但是在棉隆熏蒸消毒后,土壤中各类微生物数量急剧下降,对微生物群落结构造成严重破坏[17]。土传病害的生物防控是促进农业可持续发展的重要措施,开发使用生防制剂取代化学药剂成为当前土传病害的重要防控手段[18-19]。生防菌株可以通过影响植物根际微生物群落结构防控病害的发生[20]。杨可欣等研究发现,大豆接种芽孢杆菌 8-32 生物制剂处理后,土壤酶活增加,根际微生态发生变化,尖孢镰刀菌数量显著降低,大豆根腐病防控效果显著[21]。王宁等通过高通量测序发现,在施用木霉生物制剂制剂后,草莓根际真菌多样性降低,细菌多样性无明显变化,有害真菌数量减少,防控草莓土传病害效果达到65%[22]。何斐等报道,魔芋接种放线菌制剂处理后,土传病害防控效果显著,根际微生物区系发生显著变化,放线菌数量增加,有害真菌和细菌数量下降,魔芋根际微生物从“真菌型”和“细菌型”变为“放线菌型”[23]。本研究结果与之相似。目前功能微生物的筛选及生物有机肥的研发方兴未艾,新型生物有机肥的应用,有利于改良土壤,保护生态环境,提高农业种植水平和农作物产品品质。
本研究利用UV-LiCl复合诱变得到一株优良的突变菌株U-L-4。利用其制备的生物有机肥可有效防控芹菜根腐病,促进芹菜生长,提高芹菜产量,并显著降低根际土壤中病原真菌-尖孢镰刀菌的數量,改善了根际生态环境,芹菜增产75%。
参考文献:
[1]范双喜. 现代蔬菜生产技术全书[M]. 北京:中国农业出版社,2004:196.
[2]朱德蔚. 中国蔬菜品种志[M]. 北京:中国农业出版社,2001:758.
[3]石延霞,孟姗姗,陈 璐,等. 芹菜根腐类病害的病原菌鉴定及新型防治技术[J]. 中国蔬菜,2014(6):71-73.
[4] Spadaro D,Gullino M L. State of the art and future prospects of the biological control of postharvest fruit diseases[J]. International Journal of Food Microbiology,2004,91(2):185-194.
[5]Li H T,Zhou H,Duan R T,et al. Inducing secondary metabolite production by co-culture of the endophytic fungus Phoma sp. and the symbiotic fungus Armillaria sp.[J]. Journal of Natural Products,2019,82(4):1009-1013.
[6]段佳丽,薛泉宏,舒志明,等. 放线菌Act12与腐殖酸钾配施对丹参生长及其根域微生态的影响[J]. 生态学报,2015,35(6):1807-1819.
[7]涂 璇,薛泉宏,张宁燕,等. 辣椒疫病生防放线菌筛选及其对辣椒根系微生物区系的影响[J]. 西北农林科技大学学报(自然科学版),2007,35(6):141-146.
[8]梁 银,张谷月,王 辰,等. 一株拮抗放线菌的鉴定及其对黄瓜枯萎病的生防效应研究[J]. 土壤学报,2013,50(4):810-817.
[9]孙 敏,王小姣,丁宇涵,等. 白刺链霉菌(Streptomyces albospinus)CT205次生代谢产生活性物质的分离纯化及结构鉴定[J]. 中国抗生素杂志,2019,44(7):793-798.
[10]黄 薇,孔繁东,祖国仁,等. 高NK活性纳豆菌的诱变选育及产酶条件的研究[J]. 食品科技,2007,32(4):17-21.
[11]王小姣. Streptomyces albospinus CT205 诱变育种及在芹菜根腐病防控中的应用[D]. 南京农业大学,2020.
[12]陈志谊. 芽孢杆菌类生物杀菌剂的研发与应用[J]. 中国生物防治学报,2015,31(5):723-732.
[13]李荣杰. 微生物诱变育种方法研究进展[J]. 河北农业科学,2009,13(10):73-76,78.
[14]李 蕤,骆 军,虞 磊,等. 复合诱变筛选产细胞壁水解酶木霉菌株及产酶条件的优化[J]. 微生物学通报,2002,29(5):47-52.
[15]邹玉玲,薛海燕,汪江波,等. 钴60与紫外线复合诱变选育L-鸟氨酸高产菌株[J]. 华西药学杂志,2007,22(3):263-265.
[16]吕佩珂. 中国现代蔬菜病虫图鉴[M]. 北京:蓝天出版社,2010.
[17]高 苇,吴 峰,王 勇. 棉隆与生物有机肥协同防治芹菜根腐病及其对根际土壤微生物数量的影响[J]. 中国农学通报,2018,34(2):65-68.
[18]Xu X M,Jeffries P,Pautasso M,et al. Combined use of biocontrol agents to manage plant diseases in theory and practice[J]. Phytopathology,2011,101(9):1024-1031.
[19]郑 丽,桂 颖,王路遥,等. 生防菌剂“宁盾”对中药材茅苍术防病促生的大田剂量研究[J]. 江苏农业科学,2020,48(12):80-84.
[20]马媛媛,李玉龙,来航线,等. 连作番茄根区病土对番茄生长及土壤线虫与微生物的影响[J]. 中国生态农业学报,2017,25(5):730-739.
[21]杨可欣,王 欢,刘雪娇,等. 生防芽孢杆菌8-32对盆栽大豆土壤酶系和微生物区系的影响[J]. 大豆科学,2018,37(5):762-768.
[22]王 宁,刘 铜,靳亚忠,等. 木霉菌对土壤微生物多样性及草莓生长和发病的影响[J]. 江苏农业科学,2018,46(18):108-112.
[23]何 斐,张忠良,崔 鸣,等. 生防放线菌剂对魔芋根域微生物区系的影响[J]. 应用与环境生物学报,2015,21(2):221-227.
