思茅松毛虫3龄幼虫肠道可培养细菌的多样性
2021-12-09罗曼熊忠平熊智李选文李雕益包书军
罗曼 熊忠平 熊智 李选文 李雕益 包书军

摘要:采用纯培养法对采集自云南地区的思茅松毛虫(Dendrolimu kikuchii)3龄幼虫进行肠道细菌多样性的研究,这些研究资料与菌种数据为后研究思茅松毛虫发育奠定基础。对采自安宁市的150头思茅松毛虫3龄幼虫的肠道细菌进行分离与纯化,并且对所培养菌株的进行形态特征观察及生理生化指标测定,通过这种方法对菌株进行初步的鉴定,再结合16S rDNA分子鉴定技术进行分析,判定细菌多样性。结果显示,从3龄幼虫肠道中共分离到152株细菌,初步鉴定隶属于6个属9个类群,分别为62株芽孢杆菌属(Bacillus sp.)(3个类群)、35株微球菌属(Micrococcus sp.)(2个类群)、23株葡萄球菌属(Staphylococcus sp.)(1个类群)、11株链霉菌属(Streptomyces sp.)(1个类群)、12株不动杆菌属(Acinetobacter sp.)(1个类群)、9株泛菌属(Pantoea sp.)(1个类群)。其中,芽孢杆菌属具有最高的相对分离率为40.78%,为优势菌群。思茅松毛虫3龄幼虫肠道细菌的多样性丰富,通过分析细菌种类及各水平之间的相关性,为更深入研究细菌与思茅松毛虫的关系和为思茅松毛虫的防治奠定基础。
关键词:思茅松毛虫;肠道细菌;多样性;16S rDNA;分离
中图分类号: S182 文献标志码: A
文章编号:1002-1302(2021)21-0128-06
收稿日期:2021-03-16
基金项目:国家自然科学基金(编号:31660029)。
作者简介:罗 曼(1997—),女,河南信阳人,硕士研究生,主要从事肠道微生物研究。E-mail:819683586@qq.com。
通信作者:熊忠平,高级实验师,主要从事森林病虫害研究。E-mail:76250630@qq.com。
思茅松毛虫(Dendrolimu kikuchii)又名褚色松毛虫,属于鳞翅目(Lepidoptera)枯叶蛾科(Lasiocampidae)松毛虫属(Dendrolimus)[1]。其以松针为食,体形大,幼虫龄期长,且取食量较大,是我国南方松树的重要害虫之一,主要分布在云南、广西、四川、湖南等省(区)[2]。在云南滇中地区,思茅松毛虫1年发生1~2代,幼虫共7龄,其4龄幼虫开始越冬,主要危害思茅松等针叶树,且存在明显的寄生专化性[2]。
昆虫与微生物的关系十分复杂,微生物参与到昆虫生活的很多方面,而肠道微生物与宿主共生,相互合作[3]。体内的共生微生物对昆虫具有重要的生理功能,可通过消化代谢和营养与昆虫建立共生关系[4-7]。因此,研究思茅松毛虫与其肠道微生物之间的关系,可进一步研究共生菌种类与宿主的关系,最终筛选出培育防治思茅松毛虫的有效方法[8-9]。
目前,国内外有关昆虫肠道微生物多样性的研究已经发展到一定阶段。其中,刘小改通过高通测序技术研究稻纵卷叶螟幼虫肠道细菌微生物的多样性,发现稻纵卷叶螟幼虫期肠道微生物的物种丰富度较高,而卵期微生物的多样性较高[10]。陈金华等利用变性梯度凝胶电泳(DGGE)和限制性片段长度多态性(RFLP)方法研究桑粒肩天牛幼蟲肠道微生物多样性,发现桑粒肩天牛肠道微生物在丰富度和频度2个方面都显示出复杂的多样性[11]。而王娇莉采用DGGE及高通量测序检测核桃举肢蛾和桃蛀螟幼虫肠道细菌群落优势类群及丰度,发现核桃举肢蛾幼虫肠道多样性稍高于桃蛀螟幼虫肠道多样性,但差异不显著[12]。除此之外,前人研究的昆虫肠道微生物多样性还有豆天蛾[13]、日本龟蜡蚧[14]、华山松大小蠹[15]等。
现阶段针对肠道微生物的研究主要集中在白蚁[16-18]、蜜蜂[19-20]等与生活关联更大的昆虫中,而针对林业危害严重的昆虫肠道研究则较少见。试验采用纯培养技术和形态学对3龄幼虫肠道细菌进行初步的分离鉴定,再利用16S rDNA序列测定幼虫肠道的细菌种类,鉴定出幼虫肠道细菌的关键种群。在了解思茅松虫幼虫肠道细菌多样性及群落组成的基础上,弄清其中的关键共生菌种类,为进一步研究这些共生菌对宿主昆虫的生理功能,调节关键性的共生菌控制思毛松毛虫提供理论基础[21]。
1 材料与方法
1.1 试验材料
1.1.1 试验时间和地点
2018年10月至2019年5月在云南省安宁市草铺镇森林(24°31′~25°6′ N,102°8′~102°37′ E)进行试验。
1.1.2 试验材料的采集和处理
试验材料选用思茅松毛虫3龄幼虫,根据试验地点具体情况,在方圆2 km范围内随机挑选30个样品点,每个样品点采集6头健康的3龄思茅松毛虫幼虫及树枝并带回实验室饲养,为后续试验做准备。具体操作时再选取150头健康幼虫进行试验。
1.2 分离培养基与试剂、仪器
牛肉膏蛋白胨培养基(NA):牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂15~20 g,蒸馏水定容至 1 000 mL,pH值7.0~7.2,121 ℃灭菌20 min[22]。
培养基及生理生化鉴定所用分析纯、化学试剂,均购自西陇化工股份有限公司;Ezup 柱式细菌基因组DNA 抽提试剂盒,购自天根生化科技(北京)有限公司;PCR扩增体系试剂,购自硕擎生物科技有限公司。
1.3 肠道细菌的分离纯化
选取150头健康的3龄幼虫,在恒温22~24 ℃、恒湿80%~85%条件下,用无菌水喂养幼虫,40 h 后待其排空体内食物残渣后进行试验[23]。将思茅松毛虫幼虫置于冰上3~5 min,待其昏迷;采用70%乙醇擦拭虫体表面30 s,0.25%次氯酸钠冲泡 1 min,无菌水冲洗3次;将体表消毒好的虫子固定于无菌蜡盘上,在无菌环境下操作,使用灭菌后的细尖钳将昆虫腹部剖开,取出整个肠道,并立即用0.9%无菌NaCl溶液冲洗表面2次,然后将肠道取出后置于无菌离心管中,向离心管中加入1 mL PBS缓冲液研磨成匀浆,备用[22]。
将上述肠道匀浆吸取1 mL置于9 mL PBS缓冲液中,稀释成10-1,按照10的倍数梯度稀释,制成10-2、10-3、10-4、10-5的稀释液,吸取每个浓度稀释液100 μL分别涂布于NA培养基中,每个梯度涂3个平板,作为试验组。取最后一次清洗的无菌水100 μL涂布于NA培养基上,作为空白对照。涂板均匀后将培养平板倒置于37 ℃培养箱中培养,3 d后观察空白对照是否有菌落形成,若无菌落长出,则选择单菌落数在30~300个的培养皿,根据涂有肠道内容物悬液培养皿上的单菌落的不同特征,挑取单菌落至新的NA培养基平板上,采用分区划线法进行纯化,直至菌株形态基本一致,得到纯菌株。将得到的菌种保藏于NA斜面培养基中,4 ℃保存备用[22]。
1.4 3龄幼虫肠道可培养菌株的形态观察
将经分离纯化得到的纯菌株用平板划线法接种于新的NA平板上,在37 ℃下培养24~48 h,待菌落长成后,参考文献[23]对菌落进行染色,并在显微镜下观察菌株的形态,依据文献[24]对其特征进行描述鉴定。
1.5 3龄幼虫肠道可培养菌株的生理生化鉴定
按照朱旭芬等的微生物生理生化鉴定方法[25-26],对3龄幼虫肠道细菌进行生理生化鉴定。
1.6 3龄幼虫肠道细菌16S rDNA分子鉴定
1.6.1 肠道细菌基因组DNA提取及PCR扩增
将1 mL过夜培养的细菌菌液按照Ezup 柱式细菌基因组DNA 抽提试剂盒提取3龄幼虫肠道细菌基因组DNA。提取出的细菌基因组DNA用1.0% 琼脂糖凝胶检测,得到的片段符合细菌基因组DNA大小后,将检测合格的DNA产物作为16S rDNA序列扩增模板。选择的扩增引物为:正向引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和反向引物1492R(5′-GGTTACCTTGTTACGACTT-3′)[12]。PCR扩增体系为:25.0 μL的2×Taq PCR MasterMix;3.0 μL的模板DNA;10.0 μmol/L 正向引物27 F和反向引物1 492 R各1.0 μL;双蒸水补充至50.0 μL。PCR扩增程序为:94 ℃预变性 5 min;94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸3 min,30 個循环;72 ℃终延伸5 min,-20 ℃保存。取4.0 μL PCR扩增后的产物用1%琼脂糖凝胶进行电泳检测,将检测合格的PCR扩增产物送生工生物工程(上海)股份有限公司测序。
1.6.2 3龄幼虫肠道细菌系统发育树构建
测得的序列通过DNA MAN 6.0软件进行矫正及拼接,拼接完成后的16S rDNA序列在http://www.ncbi.nlm.nih.gov/中与GenBank数据库中的序列进行BLAST同源性比对,选出与菌株相似度最高的序列,运用软件MEGA 7.0构建Neighbor-Joining系统发育树,判定其分类学关系[22]。
多样性指数[28]的计算公式如下:
Shannon指数:H′=∑ki=1 (piln pi);
Simpson优势度指:DJ=-∑ki=1p2i;
Margalef丰富度指数:Ma=(S-1)/lnN。
式中:S表示某个3龄幼虫肠道细菌的种类数;N表示某个3龄幼虫肠道细菌的总量;pi表示某种3龄幼虫肠道细菌的相对分离率。
2 结果与分析
2.1 3龄幼虫肠道细菌的分离结果
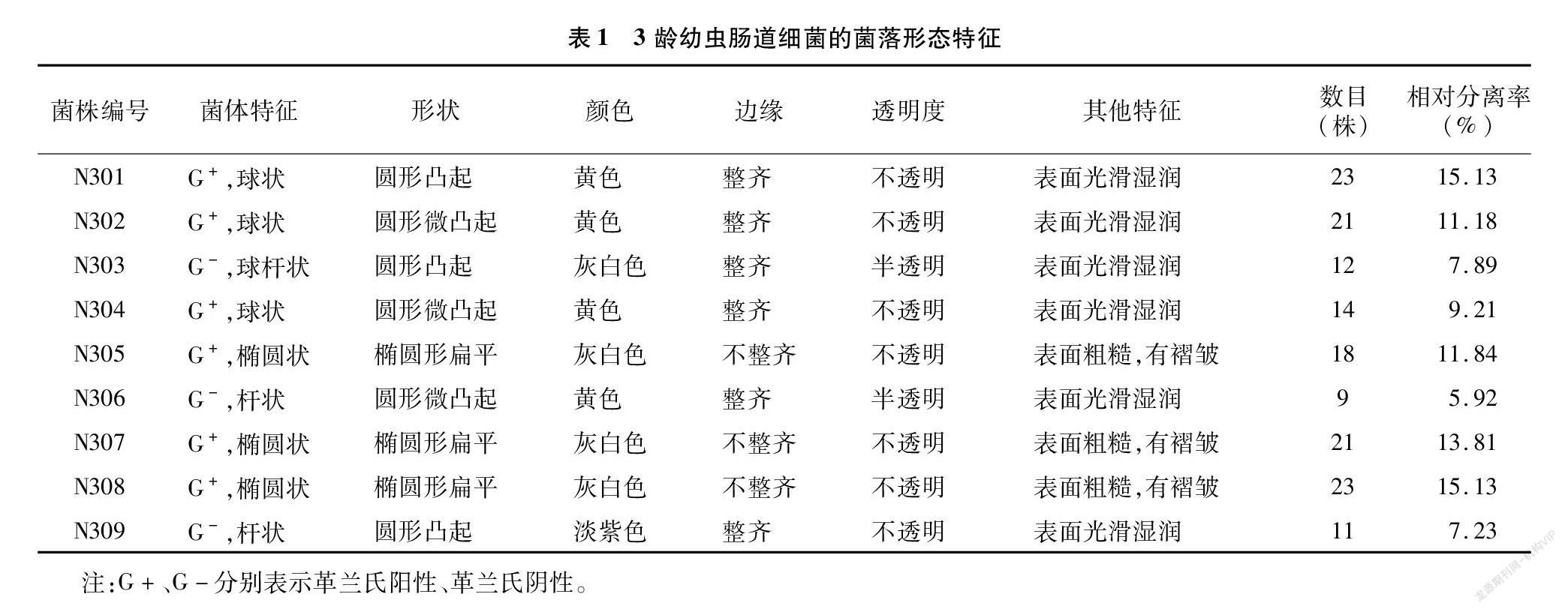
从150头3龄幼虫肠道中共分离得到152株细菌,根据菌落的形态特征共有9个类群,整理编号为N301~N309。对分离得到的9株细菌的菌落特征进行分析,由表1可知,9株菌株中多数菌株的革兰氏染色结果呈阳性,仅有3株呈阴性。其菌株的形状多样化,有球状、杆状、椭圆状等,其中球状居多,而N305、N307、N308为椭圆状,N306、N309为杆状;颜色多样化,有灰白色、黄色、紫色等,其中灰白色和黄色占大部分,只有N309颜色为灰白色;大部分菌株边缘整齐,但N305、N307、N308边缘不整齐,呈锯齿状;所有菌株都是不透明或者半透明的。
从思茅松毛虫3龄幼虫肠道细菌的相对分离比率(表1)可知,152株3龄幼虫肠道细菌中,思茅松毛虫3龄幼虫肠道细菌的Shannon多样性指数、Simpson优势度指数为、Margalef丰富度指数分别为2.1 486、0.8 785、1.5 924,说明思茅松毛虫3龄幼虫肠道细菌具有丰富的多样性。而N305、N307和N308的菌群相对分离率为40.78%,是思茅松毛虫3龄幼虫肠道细菌的优势菌群。
2.2 3 龄幼虫肠道细菌生理生化鉴定及多样性分析
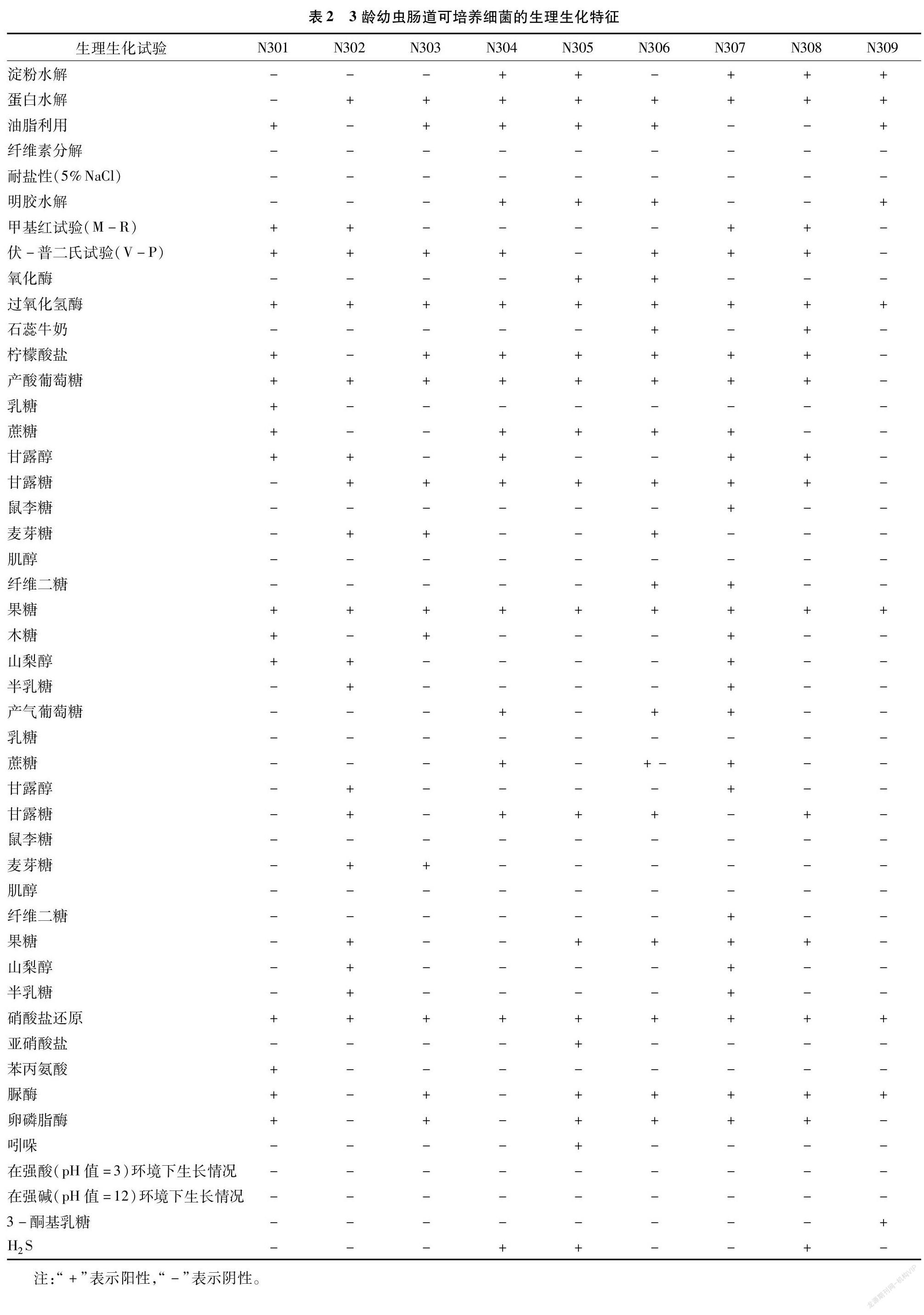
采用细菌生化试验对9种细菌群落进行淀粉水解等18种反应,发现有明显差异(表2)。
经过对生理生化指标的聚类分析可知,9个细菌类群可划分为2个遗传聚类组,N301自成一遗传聚类组,其他8个细菌类群为一聚类组,其中N302、N307属于一类,N309、N306分别各属于一类,N303、N308、N304、N305属于一类(图1)。
结合细菌的形态特征(表1)、生理生化特征(表2)、生理生化聚类(图1),查询细菌鉴定手册后,将分离到的9种细菌形态分析对比,初步鉴定结果:N305、N307、N308属于芽孢杆菌属的Bacillus sp.1、Bacillus sp.2、Bacillus sp.3,N301为葡萄球菌属(Staphylococcus sp.),N309为链霉菌属(streptomyces sp.),N302、N304为微球菌属(Micrococcus sp.1、Micrococcus sp.2),N303为不动杆菌属(Acinetobacter sp.),N306为泛菌属(Pantoea sp.)。其中N305、N307和N308的芽孢杆菌属相对分离率为40.78%,是思茅松毛虫3龄幼虫肠道细菌的优势菌群。部分菌株因菌种形态过于相似,需进一步进行后续分子生物学鉴定。
2.3 3龄幼虫肠道可培养细菌16S rDNA PCR扩增及16S rDNA分析结果
由图2可知,安宁市3龄幼虫分离纯化的肠道细菌基因组DNA,检测合格后,通过1.0%琼脂糖凝胶电泳检测,通过观察凝胶成像后,PCR扩增条带均在1 500 bp左右,条带清晰。
将所获9种细菌形态3龄幼虫肠道细菌16S rDNA序列在NCBI中比对,分离到的3龄幼虫肠道细菌与相应菌株的16S rDNA序列相似度在95%~100%之間。其中,N301、N302、N304、N306、N308序列相似度为99%; N303、 N305序列相似度为98%;N309序列相似度为97%;N307序列相似度为96%。这152株细菌隶属于6个属9个类群。
初步鉴定结果显示,N301为金黄色葡萄球菌(Staphylococcus capitis),N302为南极微球菌(Micrococcus antarcticus),N303为约翰逊不动杆菌(Acinetobacter johnsonii),N304为黄褐微球菌(M. luteus),N305为枯草芽孢杆菌(Bacillus subtilis),N306为成团泛菌(Pantoea agglomerans),N307为解淀粉芽孢杆菌(B. amyloliquefaciens),N308为贝莱斯芽孢杆菌(B. velezensis),N309为淡紫色链霉菌(Streptomyces lividans)。
2.4 系统发育树
将3龄幼虫肠道细菌的16S rDNA序列进行系统发育进化分析,构建系统发育树(图3)。由图3可知,思茅松毛虫3龄幼虫肠道可培养细菌归属于3个大类:第一大类为放线菌门,包括微球菌属(Micrococcus sp.)、链霉菌属(Streptomyces sp.);第二大类为变形菌门,包括不动杆菌属(Acinetobacter sp.)、泛菌属(Pantoea sp.);第三大类为厚壁菌门,包括芽孢杆菌属(Bacillus sp.)、葡萄球菌属(Staphylococcus sp.)。
3 结论与讨论
昆虫肠道微生物与宿主互惠共生,相互依存[5]。本研究以思茅松毛虫3龄幼虫为材料,通过对肠道可培养细菌进行一系列的菌落观察、生理生化试验和16S rDNA同源性分析,共分离得到152 株肠道可培养细菌,经测定隶属于6个属9个类群。进一步对其多样性做深入的分析,可知思茅松毛虫肠道可培养细菌具有丰富的多样性。
笔者所在课题组之前研究过3龄思茅松毛虫肠道好氧细菌的多样性,得到好氧细菌11株,经ARDRA聚类分析,在70%遗传相似度水平上归属4个类群,说明3龄松毛虫肠道内好氧细菌的多样性水平偏低[27]。而采自安宁地区的3龄幼虫分离得到152株肠道细菌,隶属于6个属、9个类群。2个试验有相似的结果,说明3龄思茅虫毛虫肠道微生物多样性确实偏低。可能是因为思茅松毛虫的草食性生活习性建立了肠道特定的营养环境,肠道微生物也通过复杂的调控过程。
枯草芽孢杆菌属于芽孢杆菌属,可在动物肠道或环境中分泌消化酶、维生素或抗菌物质,形成具有一定稳定性的微生物群系,影响动物肠道的微生物平衡[29-30]。本试验对3龄思茅松毛虫肠道微生物的多样性进行研究,发现枯草芽孢杆菌含量丰富。而解淀粉芽胞杆菌是一种与枯草芽胞杆菌亲缘关系很近的革兰阳性细菌,能生产纤溶酶等重要的专一性蛋白酶,因此推测解淀粉芽胞杆菌与思茅松毛虫肠道纤维素的消化相关[31-32],该特性在研究解淀粉芽孢杆菌与食纤维素类昆虫消化的关系方面具有重要意义。枯草芽孢杆菌和解淀粉芽胞杆菌都属于芽孢杆菌属,本研究中芽孢杆菌属的相对分离率最高,为40.78%,是3龄幼虫肠道细菌的优势菌属。经分析,芽孢杆菌属对思茅松毛虫生长发育都有很大影响,对研究芽孢杆菌属其他菌种与微生物肠道多样性的关系提供了研究基础。
思茅松毛虫是林业重要的害虫,对其肠道微生物的研究,可以补充昆虫肠道微生物资源库,也为其他相近种昆虫肠道微生物多样性研究提供参考。并进一步分析得出影响昆虫生长发育的肠道细菌种类,为思茅松毛虫的生物防治提供依据。
参考文献:
[1]侯陶谦. 中国松毛虫[M]. 北京:科学出版社,1987:32-34.
[2]萧刚柔. 中国森林昆虫[M]. 2版. 北京:中国林业出版社,1992:946-947.
[3]黄 云,詹先进,蓝家样,等. 昆虫肠道微生物的研究进展[J]. 湖北农业科学,2009,48(11):2888-2890.
[4]张 珊,熊忠平,张 俊,等. 思茅松毛虫肠道真菌分离鉴定 及水解酶活性初步研究[J]. 环境昆虫学报,2019,41(2):413-419.
[5]刘绍雄,王金华,熊 智,等. 青蒿乙醇提取物对5龄思茅松毛虫肠道细菌的抑制作用[J]. 江苏农业科学,2012,40(4):141-142.
[6]梅 承,范 硕,杨 红. 昆虫肠道微生物分离培养策略及研究进展[J]. 微生物学报,2018,58(6):985-994.
[7]张振宇,圣 平,黄胜威,等. 昆虫肠道微生物的多样性、功能及应用[J]. 生物资源,2017,39(4):231-239.
[8]陈勃生,鲁兴萌,邵勇奇. 鳞翅目昆虫肠道微生物的多样性及其与宿主的相互作用[J]. 昆虫学报,2017,60(6):710-722.
[9]相 辉,黄勇平. 肠道微生物与昆虫的共生关系[J]. 昆虫知识,2008,45(5):687-693.
[10]刘小改. 稻纵卷叶螟肠道细菌群落组成与多样性分析[D]. 重庆:西南大学,2017:11-29.
[11]陈金华,王中康,贺 闽,等. DGGE和RFLP方法分析桑粒肩天牛幼虫肠道微生物多样性[J]. 生物技术通报,2008(6):115-119,123.
[12]王娇莉. 核桃举肢蛾Atrijuglans hetaohei和桃蛀螟Dichocrocis punctiferalis幼虫肠道细菌组成及多样性研究[D]. 杨凌:西北农林科技大学,2016:39-42.
[13]吕 飞. 豆天蛾肠道细菌的初步研究[D]. 泰安:山东农业大学,2008:48-49.
[14]郝文英. 日本龟蜡蚧肠道微生物多样性分析及单宁降解菌筛选[D]. 太原:山西大学,2020:42-46.
[15]胡 霞. 华山松大小蠹肠道微生物群落多样性与幼虫肠道纤维素降解菌的研究[D]. 杨凌:西北农林科技大学,2014:25-32.
[16]孙新新,宁 娜,谭慧军,等. 白蚁肠道微生物多样性和作用研究进展[J]. 应用与环境生物学报,2017,23(4):764-770.
[17]Kundu P,Manna B,Majumder S,et al. Species-wide metabolic interaction network for understanding natural lignocellulose digestion in termite gut microbiota[J]. Scientific Reports,2019,9(1):16329.
[18]Poulsen M. Towards an integrated understanding of the consequences of fungus domestication on the fungus-growing termite gut microbiota[J]. Environmental Microbiology,2015,17(8):2562-2572.
[19]張晴晴,欧阳芳,戈 峰. 蜜蜂肠道微生物的多样性及功能研究进展[J]. 应用昆虫学报,2020,57(5):1064-1075.
[20]Motta E,Na M R. Impact of glyphosate on the honey bee gut microbiota:Effects of intensity,duration,and timing of exposure[J]. mSystems,2020,5(4):268-320.
[21]黄胜威. 暗黑鳃金龟幼虫肠道微生物分子多态性及纤维素降解菌多样性研究[D]. 武汉:华中农业大学,2012:61-63.
[22]孙佑赫,熊 智,王金华,等. 思茅松毛虫四龄幼虫肠道好氧细菌的ARDRA分析及鉴定[J]. 应用昆虫学报,2012,49(6):1618-1622.
[23]黄秀梨,辛明秀. 微生物学实验指导[M]. 2版.北京:高等教育出版社,2008:48-50.
[24]东秀珠,蔡妙英. 常用细菌鉴定手册[M]. 北京:科学出版社,2001:364-397.
[25]朱旭芬. 现代微生物学实验技术[M]. 杭州:浙江大学出版社,2011:269-275.
[26]周德庆,徐德强. 微生物学实验教程[M]. 3版. 北京:高等教育出版社,2013:350-352.
[27]康 柳,王金华,孙佑赫,等. 3龄思茅松毛虫幼虫肠道好氧细菌的分离及ARDRA多态性分析[J]. 湖北农业科学,2012,51(7):1481-1483.
[28]丁雅迪,刘绍雄,毛德昌,等. 思茅松菌根内生真菌多样性研究[J]. 江苏农业科学,2015,43(12):369-373.
[29]吴孔阳,娄亚芳,杨同香,等. 枯草芽孢杆菌功能及相关机制研究进展[J]. 黑龙江畜牧兽医,2020(23):55-58.
[30]王 琦,谢晓佩,吴庆侠,等. 牦牛源枯草芽孢杆菌的益生作用研究[J]. 江苏农业科学,2020,48(11):157-165.
[31]闫晓妮,马天有,杜仁佳,等. 解淀粉芽胞杆菌胞外抑菌活性物质研究现状[J]. 中国微生态学杂志,2018,30(2):229-234,249.
[32]何深宏,程方俊,罗 干,等. 解淀粉芽孢杆菌高产纤维素酶菌株的筛选与鉴定[J]. 福建农业学报,2020,35(7):781-787.
