江西铅山红芽芋超低温疗法脱毒苗的离体保存
2021-12-09张艺欣邓雨晴张清招曾会英聂学文龚寅陈丽丽侯莹陈小波陆春西韦宏默尹明华
张艺欣 邓雨晴 张清招 曾会英 聂学文 龚寅 陈丽丽 侯莹 陈小波 陆春西 韦宏默 尹明华


摘要:以江西铅山红芽芋超低温疗法脱毒苗为试验材料,从温度、培养基养分水平、培养基物理状态、渗透压调节剂、生长抑制剂、活性炭等方面对铅山红芽芋超低温疗法脱毒苗进行离体保存,从DNA分子标记、气孔参数、光合参数和叶绿素荧光参数等方面衡量江西铅山红芽芋超低温疗法脱毒苗离体保存后的遗传稳定性,并对江西铅山红芽芋超低温疗法脱毒苗离体保存后相关基因表达水平进行qRT-PCR检测。结果表明,5 ℃低温、1 mg/L多效唑(PP333)、18 g/L 蔗糖、0.6 g/L琼脂、1/8 MS、2 g/L 活性炭、20 g/L甘露醇、0.5 mg/L 脱落酸均有利于江西铅山红芽芋超低温疗法脱毒苗的离体保存,并且可以显著提高其离体保存过程中蔗糖合成酶、超氧化物歧化酶[Cu-Zn]、过氧化物酶、多胺氧化酶、衰老相关半胱氨酸蛋白酶、L-抗坏血酸氧化酶等基因的表达水平。与常温继代苗对照组相比,江西铅山红芽芋超低温疗法脱毒苗离体保存后复苏苗经SSR检测,电泳峰型一致,遗传距离为0,遗传相似系数为1,可以聚为一类;铅山红芽芋超低温疗法脱毒苗离体保存后复苏苗和常温继代苗对照组的气孔长径、短径、周长、气孔数量、气孔密度、净光合速率(Pn)、气孔导度(Gs)、细胞间CO2浓度(Ci)、蒸腾速率(Tr)、实际光化学效率ΦPSⅡ、捕获激发能效率Fv′/Fm′、光化学猝灭系数(qP)、非光化学猝灭系数NPQ均无显著差异。由此可见,铅山红芽芋超低温疗法脱毒苗离体保存可以保证其种质遗传稳定性。
关键词:江西铅山红芽芋;脱毒苗;超低温疗法;离体保存
中图分类号:S632.304+.3 文献标志码: A
文章编号:1002-1302(2021)21-0058-08
收稿日期:2021-07-22
基金项目:国家自然科学基金(编号:31960079、32060092);江西省上饶市科技局平台载体建设项目(编号:2020I001、2019I017);上饶师范学院校级自选课题(编号:202031);2021年大学生国家级创新创业训练计划(编号:202110416008)。
作者简介:张艺欣(1991—),女,江西上饶人,硕士,助教,主要从事植物生物技术研究。E-mail:474303981@qq.com。
通信作者:尹明华,硕士,教授,主要从事植物生物技术研究。E-mail:yinminghua04@163.com。
江西铅山红芽芋(Colocasia esculenta L. Schoot var. cormosus‘Hongyayu)属天南星科芋属多子芋类型,其食用部分以地下子芋和孙芋为主,主产于江西铅山,为国家地理标志农产品[1]。江西铅山红芽芋药食品质兼优,食用具有营养丰富、口感滑糯、肉质细腻等优点[2],药用则能补脾益肠止泻、增强人体免疫、润肠通便止秘[3]。江西铅山红芽芋多以子芋、孙芋进行无性繁殖,容易积累芋花叶病毒、黄瓜花叶病毒等病毒,使其种性严重退化,直接影响其产量、品相和品质,从而降低江西铅山红芽芋的生产效益,给江西铅山芋农创收脱贫造成极大损失[4]。笔者所在课题组通过超低温疗法和逆转录PCR(RT-PCR)检测获得了江西铅山红芽芋脱毒苗,并将其应用于大田生产[5]。结果表明,随着江西铅山红芽芋超低温疗法脱毒苗种植年限的延长,芋花叶病毒、黄瓜花叶病毒等病毒会重新侵染,同样会造成其种性再次退化[6]。由此可见,对江西铅山红芽芋超低温疗法脱毒苗种质进行一定条件的无变异保存具有重要的现实意义。
离体保存法作为植物种质资源圃的活体保存替代技术,是保证植物种质资源遗传多样性的一种新兴途径[7]。1975年Henshaw和Morel首次提出植物种质离体保存策略,并指出通过在培养基内添加生长抑制剂、调节渗透性物质、降低培养温度、添加活性炭等方法可以限制无菌苗生长,从而延长继代时间,实现植物种质的中期保存[8]。离体保存具有占用空间小、操作简便、所需人力物力少、延长继代周期、易于种质交流等特点,现已被应用于多种植物种质资源的离体保存[9]。为了克服江西铅山红芽芋超低温疗法脱毒苗大田种质逐年退化的缺点,保存江西铅山红芽芋超低温疗法脱毒苗种质,不断为江西铅山芋农提供优质脱毒苗,开展江西铅山红芽芋超低温疗法脱毒苗离体保存研究迫在眉睫。
本研究以江西铅山红芽芋超低温疗法脱毒苗为试验材料,从温度、培养基养分水平、培养基物理状态、渗透压调节剂、生长抑制剂、活性炭等方面对铅山红芽芋超低温疗法脱毒苗的离体保存进行研究,从DNA分子标记、气孔参数、光合参数和叶绿素荧光参数衡量江西铅山红芽芋超低温疗法脱毒苗离体保存后的遗传稳定性,并对江西铅山红芽芋超低温疗法脱毒苗离体保存后相关基因的表达水平进行qRT-PCR检测,以期为江西铅山红芽芋超低温疗法脱毒苗的种质离体保存优化、组培产业化及种质创新提供技术和理论支持。
1 材料与方法
1.1 试验材料
江西铅山红芽芋试管苗,由上饶师范学院生命科学学院提供。
1.2 试验方法
1.2.1 江西铅山红芽芋超低温疗法脱毒苗的获得 江西铅山红芽芋超低温疗法参照文献[5]的方法进行处理,江西铅山红芽芋超低温疗法再生苗的脱毒效果也参照文献[5]的方法进行RT-PCR检测。
1.2.2 江西铅山红芽芋超低温疗法脱毒苗的离体保存 江西铅山红芽芋超低温疗法脱毒苗的离体保存采用单因素试验进行设计,试验时间为2020年9月至2021年5月。单因素包括多效唑(PP333)、脱落酸(ABA)、活性炭(AC)、甘露醇、蔗糖、琼脂、MS大量元素和温度。多效唑离体保存培养基为MS+1.0 mg/L KT+0.2 mg/L NAA+0~2 mg/L PP333+30 g/L蔗糖+0.6 g/L琼脂,脱落酸(ABA)离体保存培养基为MS+1.0 mg/L KT+0.2 mg/L NAA+0~2 mg/L ABA+30 g/L蔗糖+0.6 g/L琼脂,活性炭离体保存培养基为MS+1.0 mg/L KT+0.2 mg/L NAA+0~2 g/L活性炭+30 g/L蔗糖+0.6 g/L琼脂,甘露醇离体保存培养基为MS+1.0 mg/L KT+0.2 mg/L NAA+0~80 g/L甘露醇+30 g/L蔗糖+0.6 g/L琼脂,蔗糖离体保存培养基为MS+1.0 mg/L KT+0.2 mg/L NAA+12~36 g/L蔗糖+0.6 g/L琼脂,琼脂离体保存培养基为MS+1.0 mg/L KT+0.2 mg/L NAA+30 g/L蔗糖+0~0.6 g/L琼脂,MS大量元素离体保存培养基为1/16~1 MS+1.0 mg/L KT+0.2 mg/L NAA+30 g/L蔗糖+0.6 g/L 琼脂,温度离体保存培养基均为MS+1.0 mg/L KT+0.2 mg/L NAA+30 g/L蔗糖+0.6 g/L琼脂,保存条件设为冰箱(5 ℃)和常温(25 ℃)黑暗2种。上述8个单因素试验每个处理接种15瓶,每瓶接种3个长1.0~1.5 cm的江西铅山红芽芋超低温疗法脱毒苗单芽,每个处理重復3次。培养温度为(25±1) ℃,光照度为1 500 lx,光照时间为14 h/d。离体保存时间设计为6个月,6个月后统计上述8个单因素试验每个处理的成活率,计算公式:成活率=存活数/接种数×100%。
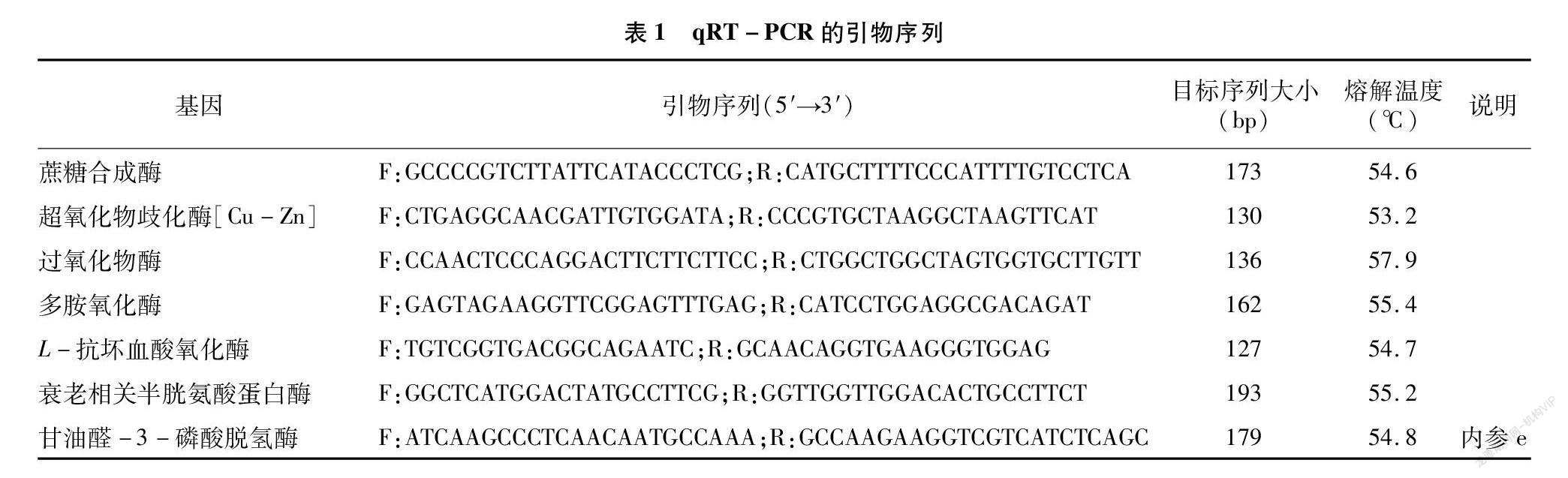
1.2.3 江西铅山红芽芋超低温疗法脱毒苗离体保存后相关基因表达的qRT-PCR检测 江西铅山红芽芋超低温疗法脱毒苗离体保存6个月后,按照文献[6]的方法对江西铅山红芽芋超低温疗法脱毒苗离体保存后相关基因(蔗糖合成酶、超氧化物歧化酶[Cu-Zn]、过氧化物酶、多胺氧化酶、衰老相关半胱氨酸蛋白酶、L-抗坏血酸氧化酶)在叶片中的表达水平进行qRT-PCR检测。引物设计见表1,每个样品以GAPDH为内参。
1.2.4 江西铅山红芽芋超低温疗法脱毒苗离体保存后复苏苗遗传稳定性的检测 在筛选得到“1.2.2”节中8个单因素的最优条件后,进行脱毒苗的培养,将培养成活的幼苗转移到MS+1.0 mg/L KT+0.2 mg/L NAA+30 g/L蔗糖+0.6 g/L琼脂培养基上进行复苏。复苏培养温度为(25±1) ℃,光照度为1 500 lx,光照时间为14 h/d。复苏50~60 d后,按照“1.2.2”节的8个最佳单因素试验条件得到江西铅山红芽芋超低温疗法脱毒苗成活苗的复苏苗(离体保存后重新接种到新培养基上长出的新苗)后,按照文献[10]的方法对其与江西铅山红芽芋超低温疗法脱毒苗的常温继代苗(对照组)进行遗传稳定性的SSR检测。10对引物(P10、P11、P18、P23、P24、XP3、XP5、XP7、XP8、XP10)的序列见表2。PCR反应体系(共20 μL):14.8 μL ddH2O,0.4 μL dNTP,2 μL缓冲液(500 mmol/L KCl,pH值8.3的100 mmol/L Tris-HCl,15 mol/L MgCl2),0.3 μL F(20 μmol/L),0.3 μL R(20 μmol/L),2 μL DNA模板,0.2 μL Taq DNA聚合酶。SSR PCR扩增程序:94 ℃ 5 min;94 ℃ 30 s,54 ℃ 35 s,72 ℃40 s,35个循环;72 ℃ 3 min。
气孔参数的分析。按照“1.2.2”节的8个最佳单因素试验条件得到江西铅山红芽芋超低温疗法脱毒苗成活苗的复苏苗后,采用透明胶粘贴法[11]对其与江西铅山红芽芋超低温疗法脱毒苗的常温继代苗(对照组)进行测定和分析。
光合生理的测定。按照“1.2.2”节的8个最佳单因素试验得到江西铅山红芽芋超低温疗法脱毒苗成活苗的复苏苗后,用LI-6400便携式光合仪按照文献[12]的方法对其与江西铅山红芽芋超低温疗法脱毒苗的常温继代苗(对照组)进行检测。
1.3 数据处理和统计方法
本试验所有数据均表示为“平均值±标准差”,数据用SPSS 19.0软件进行单因素方差分析(one-way ANOVA),再进行最小显著性差异法(LSD)检验,P<0.05表示差异显著。
2 结果与分析
2.1 不同因素对江西铅山红芽芋超低温疗法脱毒苗离体保存后成活率的影响
本研究发现,多效唑、脱落酸、活性炭、甘露醇、蔗糖、琼脂、MS大量元素和温度对江西铅山红芽芋超低温疗法脱毒苗离体保存后的成活率具有显著影响。从图1可以看出,5 ℃低温、添加1 mg/L PP333、添加18 g/L蔗糖、添加0.6 g/L琼脂、1/8 MS、添加2 g/L活性炭、添加20 g/L甘露醇、添加0.5 mg/L ABA有利于江西铅山红芽芋超低温疗法脱毒苗的离体保存。
2.2 不同因素对江西铅山红芽芋超低温疗法脱毒苗离体保存后相关基因表达水平的影响
从表3可以看出,5 ℃低温、1 mg/L PP333、18 g/L蔗糖、0.6 g/L琼脂、1/8 MS、2 g/L活性炭、20 g/L甘露醇和0.5 mg/L ABA均可显著提高江西铅山红芽芋超低温疗法脱毒苗离体保存后蔗糖合成酶、超氧化物歧化酶[Cu-Zn]、过氧化物酶、多胺氧化酶、衰老相关半胱氨酸蛋白酶、L-抗坏血酸氧化酶在叶片中的表达水平。
2.3 江西铅山红芽芋超低温疗法脱毒苗离体保存后复苏苗的SSR检测
江西铅山红芽芋超低温疗法脱毒苗离体保存后,在8个单因素的最佳条件下(5 ℃低温、1 mg/L PP333、18 g/L蔗糖、0.6 g/L琼脂、1/8 MS、2 g/L活性炭、20 g/L甘露醇和0.5 mg/L ABA)得到的8种复苏苗,利用荧光标记毛细管电泳检测复苏苗和1个对照组扩增产物的等位基因片段。10对引物的9个样品[8个最佳单因素处理(5 ℃低温、1 mg/L PP333、18 g/L蔗糖、 0.6 g/L琼脂、 1/8 MS、2 g/L活性炭、20 g/L甘露醇和0.5 mg/L ABA)得到的复苏苗和1个对照组]的电泳峰形相同。从图2可以看出,9个样品的电泳峰形一致。经POPGENE 32软件和UPGMA法分析可知,9个样品的遗传距离为0,遗传相似系数为1,9个样品聚为一类,表明9个样品无遗传变异,铅山红芽芋超低温疗法脱毒苗离体保存可以保证其种质的遗传稳定性。
2.4 江西铅山红芽芋超低温疗法脱毒苗离体保存后复苏苗的气孔参数分析
从表4可以看出,在8个最佳单因素处理(5 ℃低温、1 mg/L PP333、18 g/L蔗糖、0.6 g/L琼脂、1/8 MS、2 g/L活性炭、20 g/L甘露醇和0.5 mg/L ABA)下,与对照组相比,江西铅山红芽芋超低温疗法脱毒苗离体保存后复苏苗的气孔长径、短径、周长、气孔数量和气孔密度均无显著差异,表明江西铅山红芽芋超低温疗法脱毒苗离体保存后,其复苏苗在气孔性状方面无显著变化。
2.5 江西铅山红芽芋超低温疗法脱毒苗离体保存后复苏苗的光合生理分析
从表5可以看出,在8个最佳处理因素(5 ℃低温、1 mg/L PP333、18 g/L蔗糖、0.6 g/L琼脂、1/8 MS、2 g/L活性炭、20 g/L甘露醇和0.5 mg/L ABA)下,与对照组相比,铅山红芽芋超低温疗法脱毒苗离体保存后复苏苗的净光合速率(Pn)、气孔导度(Gs)、细胞间CO2浓度(Ci)、蒸腾速率(Tr)、实际光化学效率(ΦPSⅡ)、捕獲激发能效率(Fv′/Fm′)、光化学猝灭系数(qP)、非光化学猝灭系数(NPQ)均无显著差异,表明江西铅山红芽芋超低温疗法脱毒苗离体保存后,其复苏苗在光合生理方面无显著变化。
3 讨论
与保存种质资源所用的传统田间保存技术相比,离体保存技术具有占用空间小、保存种质多、保存成本少、可免除病虫害和自然灾害侵袭风险等优点,且长期离体保存后可快速复苏,从而实现快速繁殖,已经成为近年来新发展的且较为经济、有效、理想的种质资源保存途径[13-14]。研究发现,培养基的物理状态与培养物生长发育和培养物离体保存密切相关[15],琼脂浓度越高,黄独[16]和香青兰[17]试管苗的保存时间越长。但也有研究发现,琼脂浓度对地枫皮丛生芽离体保存的影响不显著[18]。
活性炭也可用于植物材料的离体保存[19]。在培养基中加入0.5 g/L活性炭后,铁皮石斛试管苗低温保存1年后的成活率达到100%[20-21]。本试验结果也表明,添加一定量的活性炭均可显著延长江西铅山红芽芋超低温疗法脱毒苗单芽离体保存的时间,究其原因,可能由于活性炭吸附了培养基中的激素和营养成分,从而抑制了植株生长。MS培养基的大量元素是试管苗生长发育的物质基础,适当降低MS培养基中的大量元素含量可以抑制培养物的生长,从而起到离体保存的目的[22]。研究发现,短瓣石竹[8]、地枫皮[18]和弄岗唇柱苣苔[23]试管苗在1/2 MS培养基上离体保存160 d后的成活率均超过50%,而在1/4 MS培养基上离体保存160 d后的成活率不足40%。本试验结果也表明,适当减少MS培养基的大量元素更有利于江西铅山红芽芋超低温疗法脱毒苗单芽的离体保存。培养温度可以通过改变植物材料的培养条件而延长其离体保存时间[24]。在颖半夏胚性愈伤[25]、甜叶菊种质[26]和姜种质[27]离体保存的过程中,温度对保存时间的影响占主导作用。本试验结果也表明,在5 ℃黑暗保存180 d,江西铅山红芽芋超低温疗法脱毒苗的成活率还可达90%以上。通过添加蔗糖、甘露醇等渗透调节剂提高培养基渗透压,抑制培养材料对水分和营养物质的吸收,抑制离体材料生长,可以实现植物种质的离体保存[28-29]。在离体保存过程中,蔗糖是培养物生长的主要碳源和能源,当蔗糖达到一定浓度时,蔗糖的作用由碳源向渗透物质过渡,通过调节渗透压,造成植株吸水困难,细胞生长受阻,延缓植株生长,从而延长保存时间[30]。研究发现,低浓度的蔗糖有助于植物种质离体保存。添加较高浓度的蔗糖,可以显著提高铁皮石斛[20]、甜叶菊[26]、花叶金线莲[31]、南农橙乒乓和小洋菊[32]及薄荷试管苗[33]离体保存的成活率。本试验结果与之一致,江西铅山红芽芋超低温疗法脱毒苗用 18 g/L 蔗糖离体保存180 d后的成活率最高。甘露醇属惰性物质,不易被外植体吸收,可以降低细胞膨压,提高培养基渗透势负值, 造成水分逆境,细胞水分与养分吸收困难,新陈代谢减弱,延缓植株生长,从而达到离体保存效果[34]。甘露醇作为一种渗透性物质,对试管苗的保存效果及适用浓度依作物种类而异[35]。随着甘露醇浓度的增加,香青兰[17]、蒙娜丽莎黄和橙安娜[32]、花叶金线莲[31]试管苗的成活率逐渐提高,本试验结果与之一致。植物生长抑制剂可抑制细胞生长,延缓植株生长,使用合适浓度的植物生长延缓剂(如PP333、ABA等)可以保证离体保存的成功实现[36]。多效唑可调节植物体内的激素平衡,抑制茎枝伸长,促进分蘖和延缓生长。较低浓度的PP333(1.0~2.0 mg/L)可以显著延长短瓣石竹无菌苗[8]、颖半夏胚性愈伤[25]、香青兰试管苗[17]和甜叶菊组培苗[26]的离体保存时间。本试验结果与上述结果一致,如1 mg/L PP333可促进江西铅山红芽芋超低温疗法脱毒苗单芽的离体保存。也有研究发现,较高浓度的PP333有利于有髯鸢尾组培苗的离体保存,例如有髯鸢尾组培苗经 8.0 mg/L PP333处理120 d后,其株丛成活率为100%[7]。脱落酸具有抗赤霉素的作用,可以降低RNA聚合酶的活性,抑制DNA合成,从而抑制材料生长,起到离体保存的效果[37]。添加较低浓度的ABA对有髯鸢尾组培苗的离体保存效果明显[7]。研究发现,≥5 mg/L ABA均不适用于南天竹的离体保存[38],本试验结果与此相类似,>0.5 mg/L ABA将对江西铅山红芽芋超低温疗法脱毒苗单芽产生毒害,显著降低其离体保存180 d的成活率。
离体保存是植物种质资源中短期保存一种方便快捷的手段,但离体保存后必须时刻关注离体保存材料的遗传稳定性。不同保存代数的青钱柳愈伤组织经流式细胞术法和SSR分子标记技术检测,细胞倍性恒定,扩增图谱无特异性条带,遗传稳定好[9]。4个品种菊花离体保存后的复苏苗经 SSR分子标记分析,均未出现变异条带,说明离体保存后,4个品种菊花复苏苗在DNA水平上无变化,保持了良好的遗传稳定性[32]。由颖半夏胚性愈伤离体保存复苏苗[25]和甜叶菊复苏苗与常温继代苗的形态指标、生理生化指标(叶绿素、可溶性蛋白、过氧化物酶、超氧化物歧化酶)、POD同工酶酶谱及SRAP分子標记扩增条带看出,离体保存不会造成材料的遗传变异[26],本试验结果与此相似。与常温继代苗相比,江西铅山红芽芋超低温疗法脱毒苗单芽离体保存复苏苗在气孔参数、光合生理指标以及SSRR分子标记扩增条带方面均无显著变化,表明本试验建立的离体保存技术体系可以保证江西铅山红芽芋超低温疗法脱毒苗的遗传稳定性。离体保存是一种人为营造的生态因素逆境抑制培养物生长的方法,在离体保存过程中肯定造成一些基因的上调和下调。研究发现,多酚氧化酶基因(PPO)在橄榄试管苗不同离体保存阶段都有表达,PPO基因在离体保存1、2、3、4、5个月时的变化趋势不显著,当离体保存时间到6、7、8 个月时,PPO基因显著上调[39]。在本试验中,江西铅山红芽芋超低温疗法脱毒苗单芽离体保存180 d后,蔗糖合成酶、超氧化物歧化酶[Cu-Zn]、过氧化物酶、多胺氧化酶、衰老相关半胱氨酸蛋白酶、L-抗坏血酸氧化酶等基因在各种离体保存因素处理中均表现上调,表明在江西铅山红芽芋超低温疗法脱毒苗单芽离体保存的逆境中,蔗糖合成酶、超氧化物歧化酶[Cu-Zn]、过氧化物酶、多胺氧化酶、衰老相关半胱氨酸蛋白酶、L-抗坏血酸氧化酶等基因起到了重要的抗逆作用。
参考文献:
[1]Hong S R,Yin M H. A simple cryopreservation protocol for in vitro-grown shoot tips of Chinese genuine red bud taro (Colocasia esculenta L. Schott var. cormosus cv. Hongyayu) by encapsulation-dehydration[J]. Scientia Horticulturae,2013,162:226-233.
[2]李 云,牛丽亚,涂 瑾,等. 亲水胶体对红芽芋全粉理化特性和消化特性的影响[J]. 中国粮油学报,2020,35(2):12-17.
[3]周庆红,刘星月,王葡萄,等. 脱毒红芽芋不同世代生长特性及产量分析[J]. 种子,2020,39(2):96-98.
[4]邓接楼,曹昊玮,李 玲,等. 脱毒红芽芋试管芋盆栽种植的农艺性状分析[J]. 分子植物育种,2019,17(22):7500-7506.
[5]洪森荣,李远芳,郁雪婷,等. 红芽芋茎尖低温疗法脱毒的RT-PCR检测[J]. 分子植物育种,2018,16(14):4678-4684.
[6]尹明华,张艺欣,邓雨晴,等. 江西铅山红芽芋超低温疗法脱毒苗的转录组分析[J]. 福建农业学报,2020,35(10):1050-1062.
[7]张全锋,尹新彦,庞 曼,等. 有髯鸢尾种质离体保存研究[J]. 河南农业科学,2018,47(12):116-120,131.
[8]韦 莹,黄 浩,黄宝优,等. 植物生长抑制剂对短瓣石竹离体保存的影响[J]. 中药材,2020,43(1):24-27.
[9]冯 莹,林庆良,潘东明.青钱柳愈伤组织的离体保存[J]. 林业科学,2020,56(9):58-66.
[10]尹明华,刘 燕,叶思雨,等. 江西铅山红芽芋低温疗法脱毒苗遗传稳定性的SSR检测[J]. 分子植物育种,2018,16(11):3580-3587.
[11]陈佰鸿,李新生,曹孜义,等. 一种用透明胶带粘取叶片表皮观察气孔的方法[J]. 植物生理学通讯,2004,40(2):215-218.
[12]洪森荣,尹明华.红芽芋驯化苗对盐胁迫的光合及生理响应[J]. 西北植物学报,2013,33(12):2499-2506.
[13]Rodrigues P H V,Arruda F,Forti V A. Slow-grown in vitro conservation of Heliconia champneiana cv. Splash under different light spectra[J]. Scientia Agricola,2018,75(2):163-166.
[14]Silva S S D S,Souza E H,Souza F V,et al. Micropropagation and in vitro conservation of Alcantarea nahoumii (Bromeliaceae),an endemic and endangered species of the Brazilian Atlantic Forest[J]. Acta Scientiarum Biological Sciences,2020,42:e52940.
[15]Sedlak J,Zidova P,Paprstein F. Slow growth in vitro conservation of fruit crops[J]. Acta Horticulturae,2019,1234:119-124.
[16]洪森荣,陈子敏.糖类和琼脂对黄独生长发育和离体保存的影响[J]. 黑龙江农业科学,2011(8):23-24.
[17]兰 伟,徐培培,许树成.香青兰的离体保存研究[J]. 热带作物学报,2013,34(4):675-680.
[18]张 乐,李林轩,韦坤华,等. 珍稀濒危药用植物地枫皮离体保存研究[J]. 北方园艺,2015(18):168-171.
[19]Malaurie B,Trouslot M F,Berthaud J,et al. Medium-term and long-term in vitro conservation and safe international exchange of yam (Dioscorea spp.) germplasm[J]. Electronic Journal of Biotechnology,1998,1(3):1-15.
[20]史永忠,潘瑞熾,王小菁,等. 铁皮石斛种质资源的低温离体保存[J]. 应用与环境生物学报,2000,6(4):326-330.
[21]史永忠,潘瑞炽,王小菁,等. 铁皮石斛种质室温离体保存[J]. 华南师范大学学报 (自然科学版),1999(4):73-77.
[22]Cheruyathur M K,Najeeb N,Thomas T D. In vitro propagation and conservation of Indian sarsaparilla,Hemidesmus indicus L. R. Br. through somatic embryogenesis and synthetic seed production[J]. Acta Physiologiae Plantarum,2013,35(3):771-779.
[23]张占江,李 翠,韦 莹,等. 珍稀濒危药用植物弄岗唇柱苣苔离体保存研究[J]. 北方园艺,2014(4):136-138.
[24]Garcia R O,Pacheco G,Vianna M G,et al. In vitro conservation of Passiflora suberosa L.:slow growth and cryopreservation[J]. Cryo Letters,2011,32(5):377-388.
[25]刘修树,黄和平.道地中药颖半夏种质胚性愈伤的离体保存[J]. 分子植物育种,2018,16(17):5752-5756.
[26]何克勤,李刘东,吕 磊,等. 甜叶菊離体保存技术研究[J]. 分子植物育种,2018,16(6):1929-1935.
[27]韦坤华,李林轩,缪剑华,等. 姜种质资源离体保存技术研究[J]. 北方园艺,2013(8):112-116.
[28]Gomes F,Clemente M,Figueiredo P,et al. Castanea spp. hybrid clones in vitro conservation:synthetic seeds vs. slow growth storage[J]. Acta Horticulturae,2017,1155:37-44.
[29]Vettorazzi R G,Carvalho V S,Sudre C,et al. Developing an in vitro optimized protocol to sweet potato landraces conservation[J]. Acta Scientiarum Agronomy,2017,39(3):359-367.
[30]Chauhan R,Keshavkant S,Jadhav S K,et al. In vitro slow-growth storage of Chlorophytum borivilianum Sant. et Fernand:a critically endangered herb[J]. In Vitro Cellular & Developmental Biology-Plant,2016,52(3):315-321.
[31]陈艺荃,樊荣辉,叶秀仙. 花叶金线莲离体保存技术研究[J]. 福建农业科技,2019(6):21-24.
[32]王小乐,迟天华,刘颖鑫,等. 甘露醇和蔗糖对菊花低温离体保存的影响[J]. 核农学报,2019,33(1):60-68.
[33]慈惠婷,汪 阳,周玉丽.薄荷试管苗的离体保存[J]. 安徽科技学院学报,2017,31(4):39-44.
[34]Roussos P A. Growth and biochemical responses of jojoba[Simmondsia chinensis (Link) Schneid]explants cultured under mannitol-simulated drought stress in vitro[J]. Plant Biosystems,2013,147(2):272-284.
[35]Thakur S,Tiwari K L,Jadhav S K. In vitro approaches for conservation of Asparagus racemosus Willd[J]. In Vitro Cellular & Developmental Biology-Plant,2015,51(6):619-625.
[36]Wtthers L A,Wheelans S K,Williams J T. In vitro conservation of crop germplasm and the IBPGR databases[J]. Euphytica,1990,45(1):9-22.
[37]Gopal J,Chamail A,Sarkar D. Slow-growth in vitro conservation of potato germplasm at normal propagation temperature[J]. Potato Research,2002,45(2/3/4):203-213.
[38]蔡 鹏,吴婵榕,刘华英,等. ABA与CCC对南天竹离体保存的影响[J]. 中国现代中药,2016,18(9):1180-1184.
[39]荣 霞,赖钟雄,林玉玲,等. 橄榄多酚氧化酶基因(PPO)克隆及其试管苗离体保存过程中的表达分析[J]. 热带作物学报,2014,35(4):738-745.
