洋葱花青苷合成相关基因表达与不同层鳞片颜色的关系
2021-12-09陈微惠林冲李威亚潘美红郇国磊何林玉缪美华杨海峰
陈微 惠林冲 李威亚 潘美红 郇国磊 何林玉 缪美华 杨海峰

摘要:为了探讨洋葱不同层肉质鳞片花青苷含量的区别,以及花青苷合成相关基因与含量之间的关系,采用高效液相色谱(HPLC)和实时荧光定量PCR技术,分析了不同层鳞片花青苷含量,以及与花青苷合成相关基因的差异表达情况。结果显示,花青苷含量与洋葱鳞片颜色深浅呈正相关,洋葱鳞片颜色越深,花青苷含量就越高。第2层花青苷含量最高,第4层和第6层含量差异不明显。在第2层鳞片中,苯丙氨酸解氨酶基因(PAL)、查耳酮合成酶基因(CHS)和查耳酮异构酶基因(CHI)的相对表达量较高,与花青苷的含量表现一致。黄烷酮-3-羟化酶基因(F3H)、二氢黄酮醇还原酶基因(DFR)、花青素合成酶基因(ANS)和类黄酮-3-O-糖基转移酶基因(UFGT)的表达量在第6层鳞片中较高,这与后期洋葱内部鳞片颜色逐渐加深相一致。
关键词:洋葱;鳞片;花青苷;相关基因;基因表达
中图分类号:S633.201 文献标志码: A
文章编号:1002-1302(2021)21-0054-04
收稿日期:2021-05-17
基金项目:江苏省农业科技自主创新资金[编号:CX(20)3164];连云港市财政专项(编号:QNJJ1904)。
作者简介:陈 微(1990—),女,山东菏泽人,硕士,助理研究员,主要从事蔬菜育种和栽培研究。E-mail:1135050599@qq.com。
通信作者:楊海峰,副研究员,主要从事蔬菜育种和栽培研究。E-mail:13775492959@163.com。
花青素,广泛存在植物的叶、花、果实等器官中,赋予植物橙、红、紫、蓝等色彩 [1],保护植物免受各种生物和非生物的胁迫[2-3]。花青素作为重要的黄酮类化合物,不仅具有丰富的色彩,还对人体的健康起到有益的作用。摄入花青素还可以有效改善血糖平衡,预防心脏病、改善视力。富含花青素的食品由于其诱人的颜色和对人体健康的有益作用而变得越来越受欢迎。存在于植物中的花青素主要有飞燕草素、天竺葵素、矢车菊素、芍药素、矮牵牛素和锦葵色素6种。花青素在植物体内不稳定,主要以花青苷的形式存在。花青苷的生物合成受结构基因和调节基因的共同调控[4-5]。其合成途径的关键基因主要包括苯丙氨酸解氨酶基因(PAL)、查耳酮合成酶基因(CHS)、查耳酮异构酶基因(CHI)、黄烷酮-3-羟化酶基因(F3H)、二氢黄酮醇还原酶基因(DFR)、花青素合成酶基因(ANS)、类黄酮-3-O-糖基转移酶基因(UFGT)[6-7]。
洋葱是世界范围内种植的重要蔬菜作物之一,鳞茎颜色是洋葱重要的表型特征,常见的有紫、红、粉红、黄、淡黄、白等。类黄酮类化合物,如花青苷,主要参与鳞茎颜色的形成,花青苷成分及含量的差异直接影响植物各器官颜色的呈现,在洋葱鳞茎中发现至少50种不同的黄酮醇和花青苷[8]。洋葱是膳食类黄酮最丰富的来源之一,在植物和人类营养与健康中起着重要作用。近年来,消费者对富含花青苷的洋葱品种,特别是对花青苷含量较高的紫皮洋葱品种的需求日益增加。因此研究洋葱花青苷分布及成分含量具有重要意义。
紫皮洋葱由外到内颜色逐渐变淡,其中不同层鳞片花青苷的含量及相关基因的表达尚未有报道,鉴于此,本研究采用高效液相色谱( HPLC) 和实时荧光定量PCR(RT-qPCR)方法,检测洋葱不同层鳞片的花青苷含量,探讨花青苷生物合成相关基因的表达与含量的关系,以期为培育富含花青苷洋葱品种提供理论参考。
1 材料与方法
1.1 洋葱材料
本研究所采用的洋葱品种为连葱11号,2019年9月于连云港市农业科学院东辛试验基地播种,5月下旬收获,1个月后取样,由外到内依次选取肉质鳞片的第2层、第4层和第6层。每层取3个重复样品。样品尽量选取紫色的部分,迅速置于液氮中,于-80 ℃冰箱中保存备用。
1.2 花青苷的检测
准确称取约1 g植物样品,于液氮中研磨至粉末;加入10 mL提取液,4 ℃水浴超声提取0.5 h;以10 000 r/min于4 ℃离心5 min,取上清,沉淀再提取1次,合并上清液;加入5 mL浓HCl,90 ℃水浴40 min;过0.22 μm 滤膜,进行高效液相色谱-串联质谱(HPLC-MS/MS)检测。
1.3 总RNA的合成和cDNA的合成
采用天根生化科技(北京)有限公司的RNA提取试剂盒提取洋葱总RNA。以提取的植株总RNA为模板进行反转录,获得cDNA,所用的反转录试剂是vazyme Hiscript Ⅱ Q RT Super Mix for qPCR (+gDNA Wiper)(Vazyme,中国南京)。操作方法参照试剂盒说明书进行。
1.4 荧光定量
通过荧光定量PCR检测花青苷合成相关基因在不同层鳞片中的差异表达,使用Beacon Designer设计基因的特异性引物,以Actin-F 和Actin-R 作为内参。反应体系为10 μL,每个植株样品3次技术重复。两步法荧光定量PCR 扩增条件的设置:(1)扩增曲线:95 ℃ 5 min,循环1 次;95 ℃ 10 s,60 ℃ 30 s,循环40 次,72 ℃单点检测信号;(2)熔解曲线:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,连续检测信号。采用2-ΔΔCT法计算基因相对表达量。用于 RT-qPCR 分析的定量引物见表1。
2 结果与分析
2.1 洋葱不同层花青苷的含量
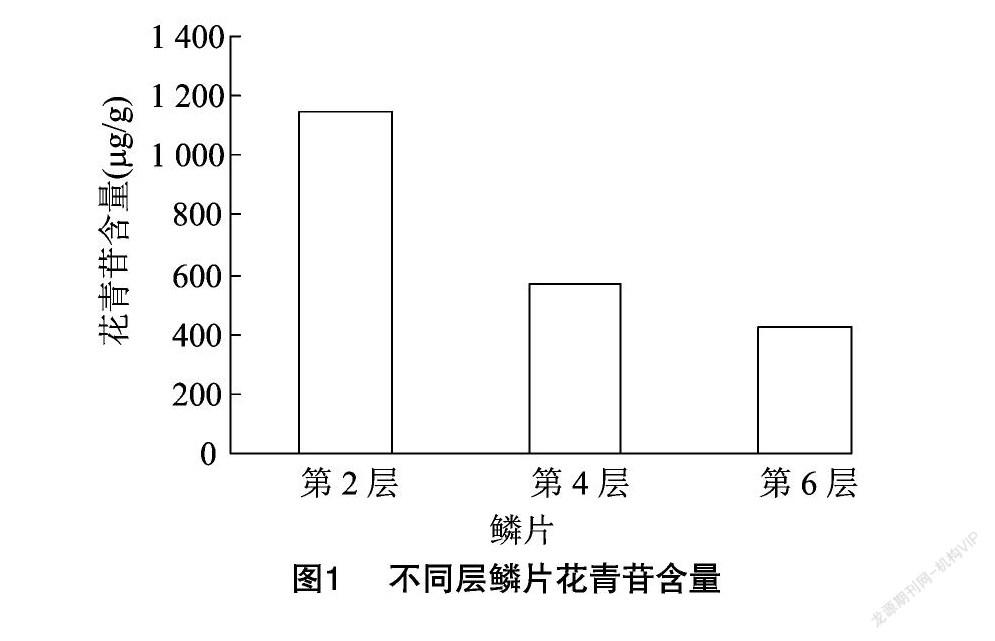
每层鳞片3次重复,去除差异较大的一个,每组留2个数据。洋葱鳞片由内而外,紫色逐渐变浅,花青苷的含量也逐渐减少。说明花青苷含量与洋葱鳞片颜色深浅呈正相关,洋葱鳞片颜色越深,花青苷含量就越高。第2层花青苷含量最高,平均含量达到1 150.186 μg/g,明显高于第4层和第6层,但第4层和第6层花青苷的含量差异不太明显(图1)。
2.2 花青苷合成相关基因的变化
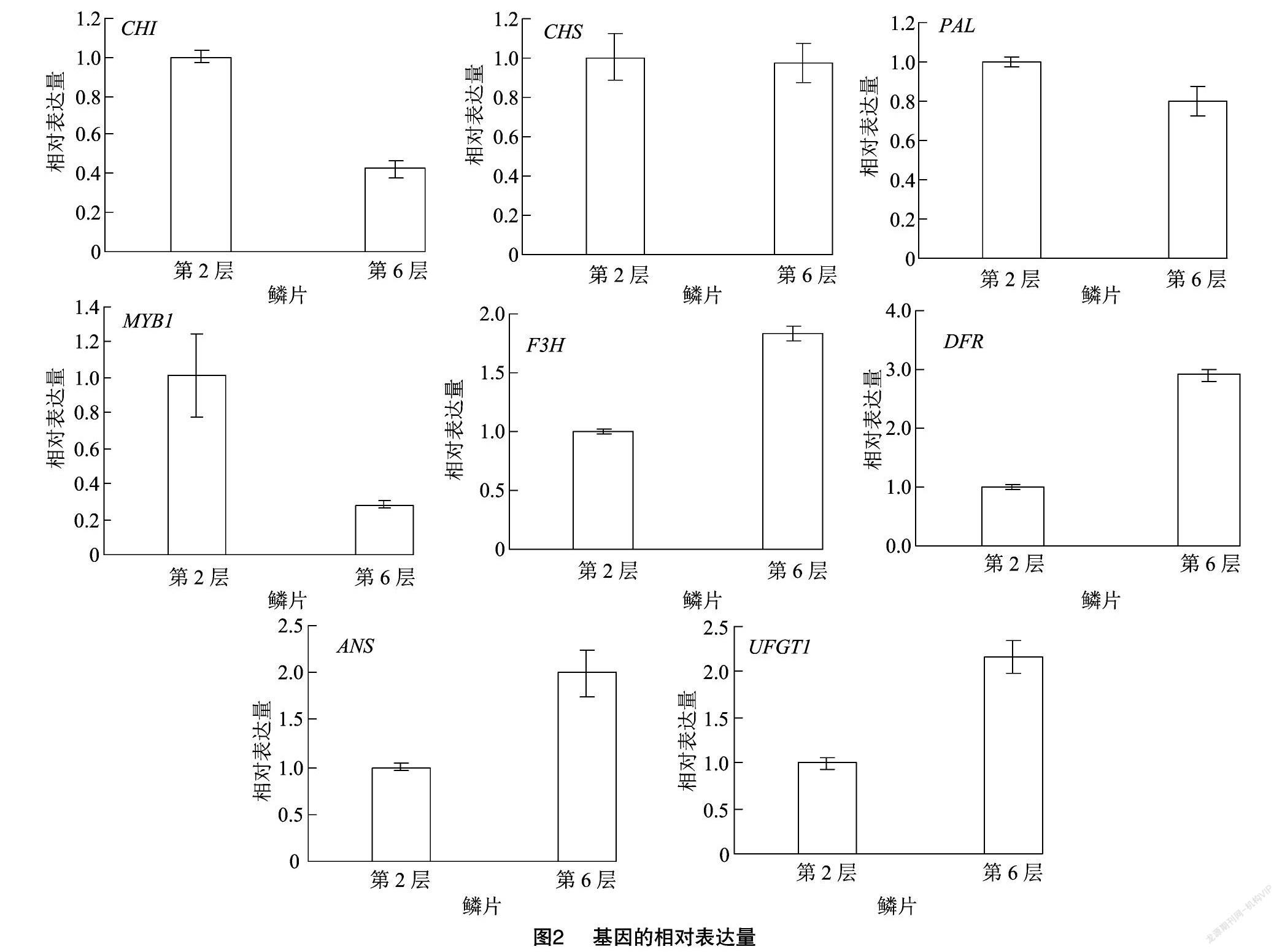
通过荧光定量PCR对不同层花青苷合成相关的基因PAL、CHS、CHI、F3H、DFR、ANS、UFGT1和MYB1转录因子的表达量进行了分析,材料选用第2层和第6层鳞片。以第2层相关基因的表达量作为对照,结果(图2)显示,基因的表达水平与花青苷的含量呈现一定的相关性。第2层鳞片中,基因CHI、CHS、PAL和MYB1的表达量比第6层鳞片中相关基因的表达量高,尤其是MYB1和CHI这2个基因的表达量明显高于第6层。但F3H、ANS、DFR和UFGT1的相对表达量低于第6层。
3 讨论与结论
洋葱以鳞茎为主要食用器官,富含钾、维生素C、锌等营养元素。鳞茎颜色是洋葱的重要特征,是在日长响应后用于区分洋葱品种的重要标准。目前,洋葱中存在多种鳞茎颜色,例如白色、黄色、红色、粉红色、淡黄色和金色。在对鳞茎颜色的研究中发现黄酮类化合物是洋葱鳞茎色素沉着的原因。花青素赋予植物丰富的色彩,是植物中发现最重要的黄酮类之一[9]。紫皮洋葱中因含有丰富的花青苷,越来越受到消费者的喜爱。
洋葱中花青苷的含量主要集中在每一层的表皮中,白色的肉质鳞片中几乎不含花青苷,但洋葱表皮和肉质鳞片紧密结合,每一层的肉质鳞片厚度不一,因此,测定每一层花青苷的含量时可能存在一定的差异,本研究所选取的样品为表皮和靠近洋葱表皮的部位,因此,结果相较于Zhang 等测定的花青苷的含量[10]总体较高。另外,还有一种可能是因为,此次种植的洋葱后期处于干旱状态,导致花青苷的含量上升,这与他人的研究结果[11-14]相似,花青素在干旱、高温、强光或强紫外线照射等不利的环境条件下,含量可能会上升。但此次测定的花青苷含量与肖瑞希等测定的花青苷含量[15]接近。
本试验中第4层和第6层花青苷的含量较高,但差异不显著,这与此次选用的品种有关,一般紫皮的品种,花青苷含量主要集中在第2层,而连葱11号从外到内紫色都较深,且贮藏的时间越长,内部颜色越深。
花青苷早期合成基因CHS、CHI和F3H等是常见的类黄酮途径基因,参与所有下游类黄酮的生物合成。通常,报道的早期花青苷合成基因的表达特征各不相同,茄类蔬菜中早期花青苷合成基因的表达水平与花青苷含量之间没有一致的相关性。花青苷晚期合成基因DFR、ANS和UFGT等是特定种类的类黄酮(包括花青素)的生物合成所必需的。在许多蔬菜中一直观察到晚期花青苷合成基因表达水平与花色苷含量之间呈正相关[16]。
查耳酮异构酶催化查耳酮生成二氢黄酮醇,其基因的表达水平间接影响花青苷的合成。CHI功能的丧失可能导致金色鳞茎的产生,这可能是由于查耳酮的积累所致[17]。在Schwinn等的研究中,MYB1被认为是花色苷生物合成的正调节剂,通过短暂过度表达MYB基因可诱导洋葱组织中花青素的产生,通过RNAi瞬时抑制该基因,色素沉着减少[18]。PAL是花青苷合成途径的一个关键酶,梁毅等通过Real-time PCR发现AcPAL1基因在红皮、黄皮、白皮洋葱中表达量依次减少,随着鳞茎膨大,其表达量却不断降低[19]。在本研究中,第2层鳞片中花青苷早期合成基因CHI、CHS、PAL的表达水平高于第6层,与花青苷的含量呈正相关。
DFR-A基因的序列分析结果表明,该基因的失活导致花色苷合成的阻滞,从而导致黄色色素积累[20]。Zhang等的研究同样表明,DFR基因在深红色鳞茎的生物合成中起关键作用[21]。张洪伟等在洋葱中克隆了UFGT1和UFGT2基因,发现这2 个基因均在红皮洋葱鳞茎中大量表达,在黄皮和白皮洋葱中几乎不表达[22]。在含花青素色素的辣椒果實发育过程中,CaF3′5′H、CaDFR、CaANS和CaUFGT在幼果期上调表达,在成熟前达到最大值,然后在成熟后下调表达,对应于花色苷瞬时积累模式[23-25],本研究结果与之相似,第6层鳞片中F3H、ANS、DFR和UFGT1的表达水平高于第2层,其原因可能是由于在洋葱的贮藏过程中,内部鳞片逐渐变红,花青苷含量增加,所以花青苷后期合成基因的表达水平上升,但具体的原因有待于探讨。目前,关于洋葱鳞茎的呈色机制以及外部环境对花青苷积累的影响还有待进一步研究,这将为从分子方面选育富含花青苷的洋葱品种打下基础。
参考文献:
[1]Tanaka Y,Ohmiya A. Seeing is believing:engineering anthocyanin and carotenoid biosynthetic pathways[J]. Current Opinion in Biotechnology,2018,19(2):190-197.
[2]Ahmed N U,Park J I,Jung H J,et al. Characterization of dihydroflavonol 4-reductase (DFR) genes and their association with cold and freezing stress in Brassica rapa[J]. Gene,2014,550(1):46-55.
[3]Lu Y,Chen Q,Bu Y,et al. Flavonoid accumulation plays an important role in the rust resistance of malus plant leaves[J]. Frontiers in Plant Science,2017,8:1286.
[4]Nakatsuk T,Nishihara M,Mishiba K,et al. Temporal expression of flavonoid biosynthesis-related genes regulates flower pigmentation in gentian plants[J]. Plant Science,2005,168(5):1309-1318.
[5]Grotewold E. The genetics and biochemistry of floral pigments[J]. Annual Review of Plant Biology,2006,57(1):761-780.
[6]Winkel-Shirley B. Flavonoid biosynthesis:a colorful model for genetics,biochemistry,cell biology,and biotechnology[J]. Plant Physiology,2001,126(2):485-493.
[7]刘晓芬,李 方,殷学仁,等. 花青苷生物合成转录调控研究进展[J]. 园艺学报,2013,40(11):2295-2306.
[8]Slimestad R,Fossen T,V gen I M. Onions:A source of unique dietary flavonoids[J]. Journal of agricultural and Food chemistry,2007,55(25):10067-10080.
[9]Griffiths G,Trueman L,Crowther T,et al. Onions:A global benefit to health[J]. Phytotherapy Research,2002,16(7):603-615.
[10]Zhang S L,Deng P,Xu Y C,et al. Quantification and analysis of anthocyanin and flavonoids compositions,and antioxidant activities in onions with three different colors[J]. Journal of Integrative Agriculture 2016,15(9):2175-2181.
[11]Field T S,Lee D W,Holbrook N M.Why leaves turn red in autumn,the role of anthocyanins in senescing leaves of red-osier dogwood[J]. Plant Physiology,2001,127(2):566-574.
[12]Oberbaueri S F,Starr G.The role of anthocyanins for photosynthesis of Alaskan arctic evergreens during snowmelt[J]. Advances in Botanical Research,2002,37(2):129-145.
[13]Henry-Kirk R A,Plunkett B,Hall M,et al. Solar UV light regulates flavonoid metabolism in apple (Malus×domestica)[J]. Plant,Cell & Environment,2018,41(3):675-688.
[14]陈雪菲,张映雪,黄贤燕,等. 蕨类植物花青素和原花青素成分及含量分析[J]. 植物科学学报,2020,38(6):820-830.
[15]肖瑞希,王馨悦,陈华国,等. 洋葱花青素提取物的HPLC特征图谱构建及谱-效关系[J]. 食品与机械,2019,35(1):15-19,135.
[16]Liu Y,Tikunov Y,Schouten R E,et al. Anthocyanin biosynthesis and degradation mechanisms in solanaceous vegetables:A review[J]. Frontiers in Chemistry,2018,6:52.
[17]Kim S,Jones R,Yoo K S,et al. Gold color in onions (Allium cepa):a natural mutation of the chalcone isomerase gene resulting in a premature stop codon[J]. Molecular Genetics and Genomics,2004,272(4):411-419.
[18]Schwinn K E,Ngo H,Kenel F,et al. The onion (Allium cepa L.) R2R3-MYB gene MYB1 regulates anthocyanin biosynthesis[J]. Frontiers in Plant Science,2016,7:1865.
[19]梁 毅,劉小义,张洪伟,等. 洋葱花青素合成相关基因(AcPAL1)的克隆和表达分析[J]. 农业生物技术学报,2014,22(1):47-54.
[20]Kim S,Binzel M,Park S,et al. Inactivation of DFR (dihydroflavonol 4-reductase) gene transcription results in blockage of anthocyanin production in yellow onions (Allium cepa)[J]. HortScience,2004,14(3):253-263.
[21]Zhang C S,Li X J,Zhan Z X,et al. Transcriptome sequencing and metabolism analysis reveals the role of cyanidin metabolism in dark-red onion (Allium cepa L.) bulbs[J].Scientific Reports,2018,8(1):14109.
[22]张洪伟,梁 毅,刘小义,等. 洋葱UFGT基因的克隆和表达分析[J]. 核农学报,2015,29(9):1677-1686.
[23]Borovsky Y,Oren-Shamir M,Ovadia R,et al. The A locus that controls anthocyanin accumulation in pepper encodes a MYB transcription factor homologous to Anthocyanin2 of Petunia[J]. Theoretical and Applied Genetics,2004,109:23-29.
[24]Stommel J R,Lightbourn G J,Winkel B S,et al. Transcription factor families regulate the anthocyanin biosynthetic pathway in Capsicum annuum[J]. Journal of the American Society for Horticultural Science,2009,134(2):244-251.
[25]Aza-Gonzalez C,Herrera-Isidron L,Nunez-Palenius H G,et al. Anthocyanin accumulation and expression analysis of biosynthesis-related genes during chili pepper fruit development[J]. Biologia Plantarum,2013,57(1):49-55.
