不同质量浓度六氯苯胁迫下狭叶香蒲根系生物膜细菌群落结构研究*
2021-12-09陈海娇付如鹏何秀梅张晋瑞余娇娇
陈海娇,付如鹏,何秀梅,张晋瑞,钟 媛,余娇娇
(玉溪师范学院 化学生物与环境学院,云南 玉溪 653100)
水生大型植物是水生生态系统的重要组成部分,可吸收水体和沉积物中的养分和重金属等无机或有机污染物[1],对湿地生态系统水质的改善起着至关重要的作用[2]。六氯苯(hexaehlorobenzen,HCB)是淡水中的主要有机环境污染物之一,已被中国、日本和美国等多个国家优先划分为持久性有机污染物[3]。由于HCB具有亲脂性,其随空气和废渣等排放进入环境后易聚集在土壤和地下水中,并通过食物链进入生物体内,严重威胁人类健康和生态系统安全[4]。此外,HCB具有持久性,光解和化学方法很难对其降解。近年来,生物修复技术被广泛应用于环境有害污染物的分解。研究结果显示:湿地植被中HCB含量较低,50%的HCB降解时间约为28~58 d[5-6]。水生植物根际微生物在HCB污染修复中发挥了关键作用[7]。水培试验表明:HCB胁迫下,水体中的优势菌是变形菌门和厚壁菌门,且与HCB 的根际降解密切相关[8];研究人工湿地HCB根际降解过程中细菌群落的结构与功能发现:厚壁菌门在细菌群落中占主导地位,HCB 的降解菌主要有假单胞菌属、产碱杆菌属、伯克霍尔德杆菌属、梭状芽孢杆菌属和蜡状芽孢杆菌属,它们参与HCB的降解或具有降解HCB中间产物以及矿化低级氯化联苯的功能[9-11]。张文静等[12]从底泥筛选出对HCB具有高效降解能力的厌氧菌群,对1 mg/L HCB的降解率高达95.6%,且该混合菌群对HCB的耐受能力高达60 mg/L。这在一定程度上说明生物降解HCB可能需要多种微生物参与,细菌多样性和丰富度越高,越有利于HCB降解[9]。
在水生生态系统中,细菌经常出现在如生物膜(又称附生微生物)、湖泊或海雪表面[13]。与生物膜形成相关的细菌大量富集在可获取养分的中间体,而低或高的营养条件都有利于浮游菌的生长[14]。生物膜不仅在非生物表面形成,也在水生植物和藻类等生物表面形成[15]。水生植物是空间异质性的重要组成部分,而空间异质性对水生生态系统生物膜的建立和发展至关重要[16]。生物膜的功能通常由其生物多样性和细菌种类决定[16]。研究结果显示:附生微生物具有多样性和寄主特异性[17-18],而大型水生植物的生长状态和分泌物可以影响生物膜和沉积物中细菌的组成[15,19]。高通量测序结果显示:附生生物膜中的细菌群落结构不同于周围水体[20]。然而,在高通量测序水平上,鲜有关于湿地生态系统中水生植物根际生物膜菌群结构和功能的报道。
近年来,湿地通过种植大量水生植物对湿地生态系统进行修复,从而改善湿地水质和生物多样性。为研究湿地水生植物根系生物膜的形态结构和细菌群落组成,本研究以常见水生净化植物狭叶香蒲为湿地典型植物,构建人工湿地微系统,采集富营养化水体中经不同质量浓度HCB处理后的狭叶香蒲根系和沉积物,利用扫描电镜和16S rDNA测序方法分析其生物膜的形成及根系菌群结构。本研究结果有助于进一步认识水生植物在湿地功能中的作用,可为富营养化水体有机污染物的去除机制提供理论基础。
1 材料与方法
1.1 HCB污水制备
将HCB标准品1 g (分析纯,纯度99.50%)溶于正己烷1 000 mL中配制出1 000 mg/L的母液,再用富营养化水体(来自玉溪师范学院地海)稀释得到质量浓度为38和760 µg/L的水体(即R38和R760),充分混匀后室温放置,使用时检测水体中HCB的初始质量浓度分别为26和588 µg/L。
1.2 水生植物湿地系统构建及样品采集
狭叶香蒲(Typha angustifolia)为选自玉溪师范学院温室内长期繁育的种苗。选取5株高约20 cm的狭叶香蒲均一苗种植在40 cm×30 cm×50 cm (长×宽×高)的根箱中,根箱内自上而下依次为水层15 cm (用富营养化水补充其蒸发量)、直径约0.3 cm的砂砾10 cm和直径约3 cm的碎石20 cm。R38和R760处理各设置9个生物学重复,未添加HCB的富营养化水体设为对照组(CK)。在狭叶香蒲生长茂盛的7月采集样品,用灭菌剪刀分别剪取R38、R760和CK处理的香蒲根系用于扫描电镜观察和高通量测序。
1.3 电镜扫描观察
取新鲜狭叶香蒲根系用灭菌刀片切成长约0.5 cm的小块,用乙醇进行梯度脱水(乙醇含量依次为30%、50%、70%、80%、90%和100%),每个梯度脱水15 min,最后用100%乙醇浸泡15 min后转移到冷冻干燥仪中干燥约1 h[16]。将干燥的样品用镊子粘贴到观察台并真空喷金,用扫描电镜(日立S-4800) 在放大倍数1 500×、3 000×和3 500×下对狭叶香蒲根系以及基质的生物膜形态进行观察并拍照。
1.4 Illumina高通量测序
1.4.1 细菌16S rDNA-V3V4区的PCR扩增及测序
取新鲜狭叶香蒲根系,其生物膜的总DNA提取根据Power Biofilm DNA试剂盒(MoBio Laboratories,USA)的操作说明书进行,利用细菌V3V4区通用引物338F:ACTCCTACGGGAGGCAGC和806R:GGACTACHVGGGTWTCTAAT扩增目的片段,PCR扩增体系50 µL:10×Buffer 5 µL,引物各1 µL,模板1 µL,2.5 mmol/L dNTP 4 µL,5 U/µL NEBTaq0.25 µL,无菌水37.75 µL。PCR扩增程序为:94 °C预变性3 min,30个扩增循环(94 °C变性30 s,55 °C退火45 s,72 °C延伸1 min),72 °C再延伸10 min[16]。PCR扩增产物用2%琼脂糖凝胶电泳检测后送至上海派森诺生物科技股份有限公司测序,测序平台为Illumina Miseq。
1.4.2 数据处理和分析
测序原始数据利用滑动窗口法筛查质量,舍弃小于150 bp的低质量序列,使序列长度集中在401~450 bp。利用FLASH v1.2.7 (http://ccb.jhu.edu/software/FLASH/)对通过质量筛查的序列进行配对连接,获取每个样品的有效序列。有效序列按97%的序列相似度进行可操作分类单元(OTU)划分,对每个样本的序列总数随机抽样,并将抽取到的序列数及其对应的OTU数绘制稀疏曲线。利用QIIME软件计算样品的Alpha多样性指数(包括Chao 1指数、ACE指数、Shannon指数和Simpson指数),其中Chaol 指数和Shannon 指数值越高,分别代表群落物种的丰富度和多样性越高。使用R软件对丰度前50位的属进行聚类分析并绘制热图。利用PICRUSt工具对16S rDNA基因测序数据与代谢功能已知的微生物参考基因组数据库进行比对,预测根系生物膜中菌群的主要代谢功能。
2 结果与分析
2.1 狭叶香蒲根系生物膜中细菌的特征
如图1所示:在富营养化水体中,对照根系表面栖息着少量细菌,形态主要呈椭圆形,少量呈杆状;富营养化水体经38 µg/L HCB处理后,狭叶香蒲根系细菌数量急剧增加,大量细菌聚集分布,主要呈杆状或椭圆形,少量呈中央凹陷的圆饼状;富营养化水体经760 µg/L HCB处理后,狭叶香蒲根系同样附着大量的微生物,分布散乱,主要呈杆状,但数量明显低于R38。此外,富营养化水体经不同质量浓度HCB处理后,水体中的基质表面未观察到微生物附着。

图1 狭叶香蒲根系和基质中细菌的扫描电镜图Fig.1 Scanning electron micrographs of the epiphytic biofilm on the roots of Typha angustifolia and the sediment
2.2 狭叶香蒲根系生物膜多样性分析
通过Illumina Miseq高通量测序并优化后,R38和R760共获得95 792条序列,序列长度主要集中在401~450 bp,占总序列数的99.70%。如图2所示:2个处理的稀释性曲线均趋于平缓,表明测序数据接近饱和,测序深度能全面覆盖狭叶香蒲根系绝大多数细菌信息,测序数据能够较好地反映根系样品中细菌群落组成。
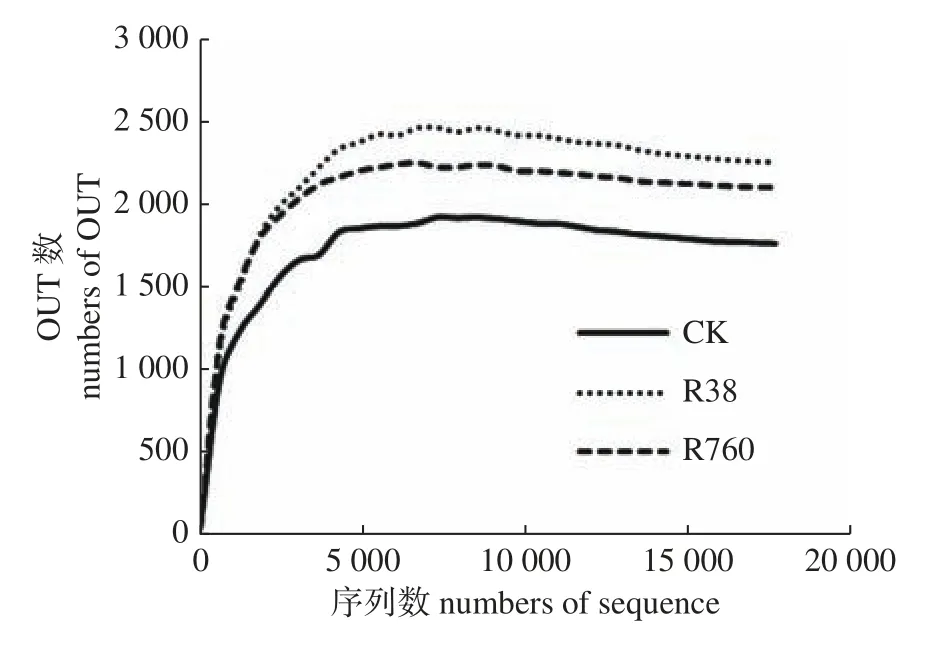
图2 不同处理根系细菌OTU稀释曲线Fig.2 Rarefaction curves of root bacteria in different treatments
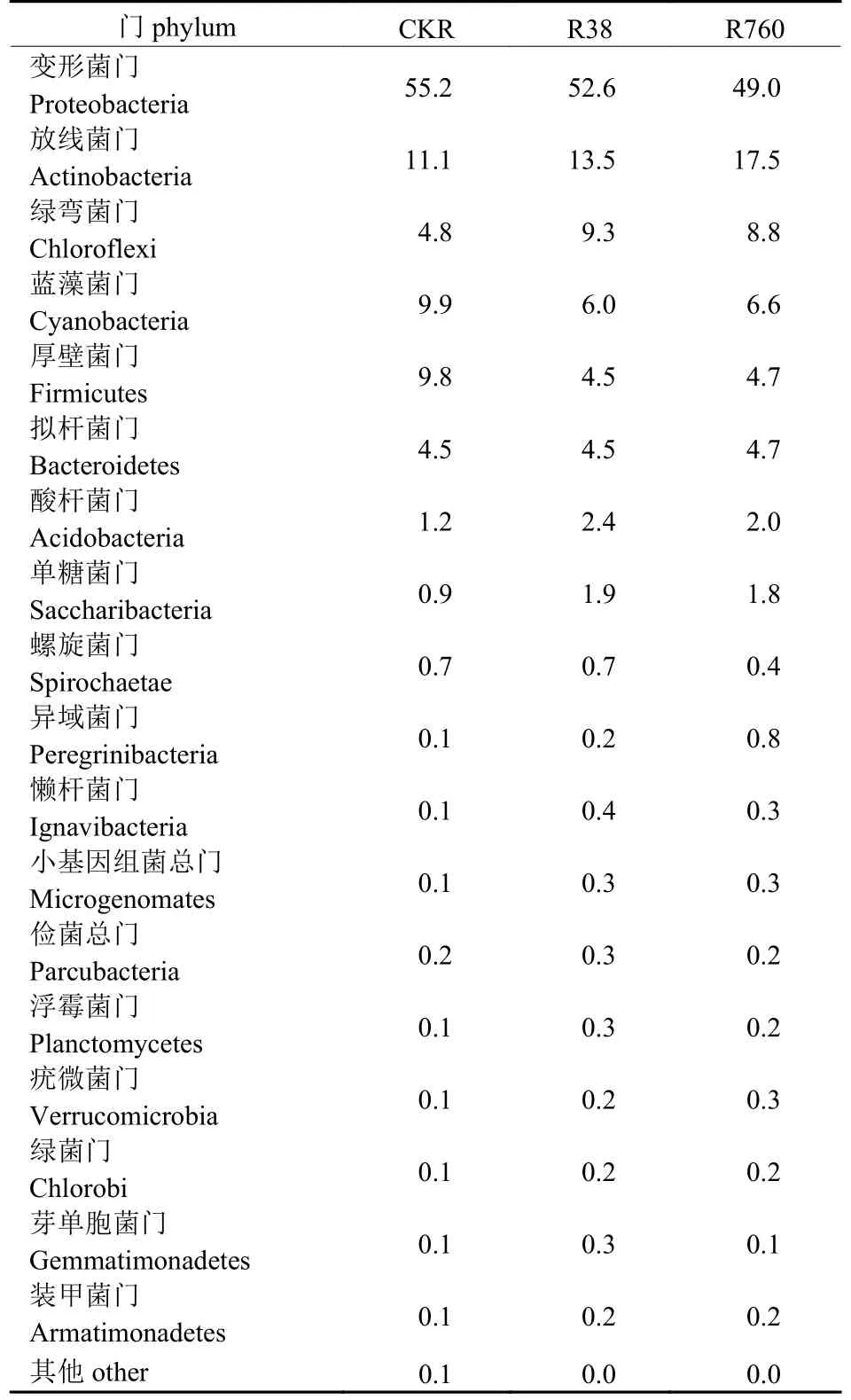
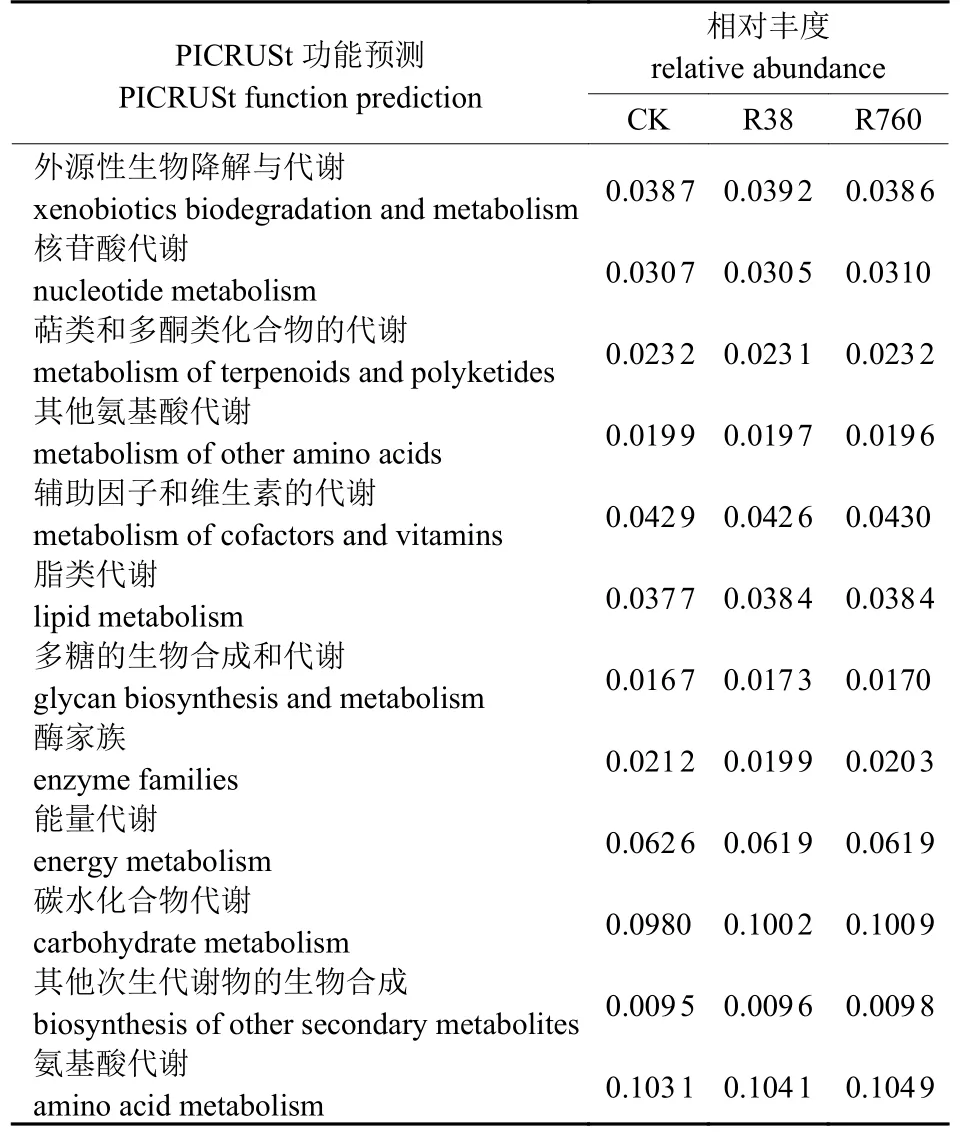
由表1可知:在富营养化水体中,R38样品的 Chao 1指数高于对照和R760,说明同一水体中,不同质量浓度HCB处理导致生物膜细菌群落丰富度存在差异性变化;各样品的Shannon 指数大小为 CK 表1 每个样品的细菌丰富度和多样性指数Tab.1 Bacterial abundance and diversity indexes of each sample 2.3.1 门水平上的细菌群落结构 在门水平上,CK、R38和R760处理分别获得30、35和33个类群。将相对丰度<0.1%的类群归类为其他,可获得19个类群。由表2可知:变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、蓝藻菌门(Cyanobacteria)和厚壁菌门(Firmicutes)为5个主要的优势细菌群落。进一步的比较分析显示:R38处理中变形菌门、蓝藻菌门和厚壁菌门的相对丰度分别比对照降低2.6%、3.9%和5.3%,其余多数类群的相对丰度均升高;R760处理中变形菌门、蓝藻菌门、厚壁菌门和螺旋菌门(Spirochaetae)的相对丰度分别比对照降低6.2%、3.3%、5.1%和0.3%,其余多数类群的相对丰度也均升高;与R38处理相比,R760处理的变形菌门、绿弯菌门、酸杆菌门(Acidobacteria)、单糖菌门(Saccharibacteria)、螺旋菌门、懒杆菌门(Ignavibacteriae)、芽单胞菌门(Gemmatimonadetes)、俭菌总门(Parcubacteria)和浮霉菌门(Planctomycetes)的相对丰度均降低。 表2 不同质量浓度HCB处理细菌门水平组成Tab.2 Bacterial community composition at phylum level under different mass concentration of HCB % 2.3.2 属水平上的细菌群落结构 由图3可知:不同质量浓度HCB处理下狭叶香蒲根系生物膜菌群可聚为4类,菌属的丰度均不同程度的受到HCB处理的影响。 图3 样品属水平群落组成热图Fig.3 Heat map of top 50 genera in each sample 聚类1主要包括突柄微菌属(Prosthecomicrobium)、CL 500-29_marine_group、微 丝 菌属(Candidatus_Microthrix)、噬氢菌属(Hydrogenophaga)、嗜酸菌属(Acidovorax)、厌氧粘细菌(Anaeromyxobacter)、Quadrisphaera、醋酸杆菌属(Acetobacterium)以及水库杆菌属(Piscinibacter)。HCB处理后细菌结构的分布发生了明显变化,这9个菌属在对照和R38中的丰度均低于R760。 聚类2中的丙酸杆菌属(Propionicicella)、脱硫杆菌属(Desulfobacterium)、红细菌属(Rhodobacter)、玫瑰单胞菌属(Roseomonas)、德克斯氏菌属(Derxia)、Actinotalea、Denitratisoma以及Variibacter的丰度在对照中较低。与R38处理相比,R760处理的丙酸杆菌属、脱硫杆菌属、红细菌属、玫瑰单胞菌属和德克斯氏菌属的丰度均升高;但放线菌(Actinotalea)、反硝化菌属以及Variibacter的丰度则低于R38。 聚类3主要包括Pleomorphomonas、噬纤维菌属(Cytophaga)、贪噬菌属(Variovorax)、红假单胞菌属(Rhodopseudomonas)、贪铜菌属(Cupriavidus)、红微菌属(Rhodomicrobium)、丛毛单胞菌属(Comamonas)、脱硫弧菌属(Desulfovibrio)和臂微菌属(Ancalomicrobium)等。这9个菌属在 R38和R760中的丰度均小于对照。 聚类4主要包括慢生根瘤菌属(Bradyrhizobium)、军团菌属(Legionella)、Christensenellaceae_R-7_group、不动杆菌属(Acinetobacter)、柄杆菌属(Caulobacter)、厌氧绳菌属(Anaerolinea)、红芽生菌属(Rhodoblastus)、中慢生根瘤菌属(Mesorhizobium)、红长命菌属(Rubrivivax)、根瘤菌属(Rhizobium)、地杆菌属(Geobacter)、纤维菌属(Cellulomonas)和脱硫叶菌属(Desulfobulbus)。这些菌群在R38中的丰度均大于对照和R760。综上所述,R38和R760的细菌结构和丰度存在差异,说明不同质量浓度的HCB对根系生物膜菌群结构的影响不同。 2.3.3 狭叶香蒲根系生物膜菌群代谢功能预测 由表3可知:根系生物膜菌群的主要功能集中在碳水化合物、氨基酸以及能量代谢方面,而在多糖的生物合成和代谢以及次生代谢的生物合成等方面的功能较弱。 表3 PICRUSt预测根系生物膜菌群代谢功能Tab.3 Metabolic function of bacteria predicted by PICRUSt 以大型水生植物为主的水生生态系统中,生物膜是初级生产中不可替代的组成部分[16]。研究表明:水生植物表面附着的细菌和浮游细菌群落结构存在显著差异[16,20]。水生植物的表面可以作为细菌群落的“集中器”,为细菌的附着提供营养和微生态位[16]。在狭叶香蒲根系生物膜中检测到细菌,证明细菌是水生植物附生微生物的主要组成部分[15,20]。经不同质量浓度HCB处理后,根系附着微生物的数量明显增加,尤其是在R38处理中最为显著。研究发现:HCB含量与香蒲根际微生物数量呈负相关,香蒲根际微生物数量增加有利于湿地系统降解HCB[21]。R760处理的根系生物膜细菌数量减少可能与高质量浓度HCB的抑制作用有关[21]。然而,R38和R760处理的水体基质表面未观察到微生物附着。研究显示:水生植物根系为微生物生长提供了表面积,根系分泌物是微生物碳水化合物的来源,根系氧气的释放为微生物的生存创造了微氧环境[22-23],而基质可能未提供微生物附着和生存的必需条件。 根际是影响根系活动的特殊区域,除能为微生物的生存提供营养物质和有氧环境外,还能促进高分子有机物(如农药)的降解[24]。狭叶香蒲常用于降解无机和有机污染物(如HCB)[25]。本研究表明:狭叶香蒲根系生物膜细菌群落的Chao1指数、ACE指数、Shannon指数和Simpson指数均表现为R38>R760>CK,说明低质量浓度HCB处理的根系细菌群落结构、丰富度和多样性均高于高质量浓度HCB处理。16S rDNA测序结果显示:生物膜中的优势细菌有变形菌门、放线菌门、绿弯菌门、蓝藻菌门和厚壁菌门,它们在其他大型水生植物中同样有分布[16,20]。多数变形菌门对有机基质具有较强的代谢能力,使其在富营养化水体中占主导地位[26]。富营养化水体中,水生净化植物粉绿狐尾藻和喜旱莲子草根际微生物的数量均表现为细菌>放线菌>真菌[27]。本研究测序结果中放线菌门为第二大种群,可能与HCB富营养化水体的改善以及HCB的降解有关[21,27]。HE等[18]利用T-RFLP对各微生物群落进行比较,发现变形菌门在慈姑和黑藻上最丰富,而蓝藻在慈姑和黑藻上是第二大种群。蓝藻对氮、磷等营养元素具有极强的竞争力,气候条件和营养元素均是有害蓝藻扩增的有利因素[28]。然而,经不同质量浓度HCB处理后,水体中蓝藻菌门丰度均降低。HCB胁迫下,厚壁菌门在细菌群落中占主导地位,参与人工湿地HCB的降解[9]。在R38和R760中厚壁菌门丰度相似,但明显低于对照。 HCB胁迫下,菌属的丰度均受到不同程度的影响。R760中,放线菌门的CL 500-29_marine_group丰度高于对照和R38,能够有效利用多种形式的碳化合物,属于养殖环境中的有益微生物[29]。推测高丰度的CL 500-29_marine_group可能通过促进碳循环改善R760的水体环境。狭叶香蒲根系生物膜中还检测到红微菌属、红假单胞菌属、红长命菌属、红芽生菌属和红细菌属等多种光合细菌属,均属于光合细菌下的紫色非硫细菌。光合细菌能有效改善富营养化水体的水质,且对水体中总磷、总氮、铵态氮、硝态氮和COD的去除效果明显[30]。紫色非硫细菌能高效去除有机物,参与卤代化合物和芳香化合物的降解[31],如光合细菌降解57.26%的2-氯苯酚只需7 d[32]。以上研究表明:生物膜中大量光合细菌的附着可能与富营养化水体的改善以及HCB的降解有关。丛毛单胞菌属可降解酚类物质,对苯酚的最高耐受力可达2 000 mg/L,完全降解初始质量浓度为1 000 mg/L的苯酚只需48 h[33]。此外,丛毛单胞菌属还可分解多环芳烃和杂环类物质[34]。这类细菌在根系生物膜上的丰度大小依次为CK>R760>R38。贪噬菌属是另一类能降解多种有机化合物的微生物,如原油相关的硫代物[35]、烟碱类杀虫剂[36]以及腈类除草剂等[37],它在生物膜上的丰度为CK>R38>R760。在R38中,不动杆菌属是植物根际优势菌群,这类细菌同样能参与苯酚等有机物的降解[38]。嗜酸菌属是R760根系生物膜上的优势菌属,能降解喹啉等有机物[39]。狭叶香蒲根际优势菌属以丛毛单胞菌属、贪噬菌属、不动杆菌属、嗜酸菌属以及多种光合细菌属为主,说明它们可能是水体中HCB 降解的“主力菌”[9,21]。此外,根系生物膜中的微生物栖息于特定的生态位,植物根系、水体、沉积物成分甚至水生动物都可能影响根际微生物的群落结构和多样性[16],并影响根际对水体中污染物的去除效果。 反硝化细菌将硝酸盐还原为分子氮或气体氮。反硝化细菌被认为是自然反硝化过程的主要执行者[40],近年来在污水脱氮处理中备受关注。本研究共检测到7属此类细菌。R38生物膜中,红长命菌属、中慢生根瘤菌属和不动杆菌属的丰度最高,而红细菌属则是R760生物膜中的优势菌。红长命菌属是兼性异养细菌,能在厌氧和低氧条件下将亚硝酸盐还原成氮气[41]。中慢生根瘤菌属则是一类好氧反硝化菌,在好氧条件下将铵态氮直接转化成气态产物[42]。不动杆菌属是近年来发现的异养硝化—好氧反硝化菌群,能将NH4+-N氧化为NO2--N (或NO3--N),再将NO2--N (或NO3--N)还原生成含氮气体释放[43],实现硝化和反硝化作用在同一时间和空间内完成[44]。红细菌属是一类高效净化水质且能参与反硝化作用的光合细菌[45]。反硝化作用是去除湖泊、河流氮污染和调节氮循环的关键过程[46]。以上4类菌群分别属于R38和R760根系生物膜中的优势菌,它们可能参与富营养化水体的脱氮和氮循环。植物在白天可以通过光合作用释放氧气,而根系生物膜中大多数微生物通过呼吸消耗氧气,白天和晚上能分别形成好氧和低氧的微环境[16]。好氧环境下,生物膜上的硝化细菌进行硝化作用;低氧环境下,厌氧或兼性厌氧的反硝化细菌进行反硝化作用[46],从而实现水体氮循环。此外,7月适宜的环境和水体条件可能也会刺激这类细菌的生长。上述结果表明:狭叶香蒲根系生物膜体系在富营养化水体脱氮和氮循环过程中至关重要。 经38 µg/L HCB处理后,富营养化水体中狭叶香蒲根系生物膜细菌的数量、群落丰富度和多样性均高于760 µg/L HCB的富营养化水体根系。此外,属水平优势菌群可能与富营养化水体的水质净化、有机物降解以及脱氮和氮循环有关。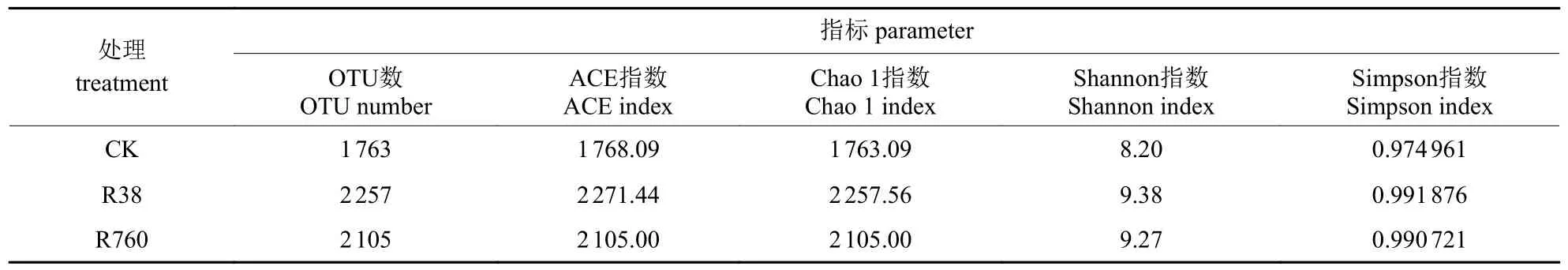
2.3 不同质量浓度HCB处理下狭叶香蒲根系细菌群落组成及功能预测

3 讨论
3.1 狭叶香蒲根系表面为微生物提供特殊的生态位
3.2 不同质量浓度HCB对狭叶香蒲根系生物膜菌群多样性和结构的影响
3.3 狭叶香蒲根系生物膜菌群与氮循环
4 结论
