枯萎病拮抗菌JM-3对草莓连作土壤酶活性及微生物多样性的影响
2021-12-08姜莉莉武冲武海斌宫庆涛孙瑞红
姜莉莉 武冲 武海斌 宫庆涛 孙瑞红
摘要:前期分离得到1株草莓枯萎病高效拮抗菌JM-3,以其制备的固体菌剂处理草莓连作土壤,采用生理生化手段评价其对土壤酶活性的影响,同时采用高通量测序技术分析其对土壤微生物群落结构的调控规律。结果表明,在盛果期,拮抗菌JM-3处理可提高草莓连作土壤的纤维素酶、酸性磷酸酶和蔗糖酶活性。土壤微生物多样性分析发现,拮抗菌JM-3处理的盛果期毛壳属(Chaetomium)和腐质酶属(Humicola)相对丰度较高,表明其可在一定程度上提高土壤有益菌的含量。PCA结果表明,在盛果期和末果期,拮抗菌JM-3处理与多菌灵处理之间的距离较近,表明其群落结构相似度较高。
关键词:草莓;连作;拮抗菌;土壤酶;微生物多样性
中图分类号: S182;S188+.3;S668.406 文献标志码: A
文章编号:1002-1302(2021)22-0236-05
收稿日期:2021-03-19
基金项目:山东省自然科学基金(编号:ZR2019PC013)。
作者简介:姜莉莉(1986—),女,山东烟台人,博士,助理研究员,主要从事果树植保研究。E-mail:j--lili@163.com。
通信作者:孙瑞红,博士,研究员,主要从事果树植保研究。E-mail:srhruihong@126.com。
草莓(Fragaria×ananassa Duch.)为蔷薇科草莓属多年生草本植物,其果实饱满多汁、香气宜人,深受消费者喜爱,素有“水果皇后”的美誉[1]。近年来,随着人民生活水平的提高,市场对鲜食草莓的需求量逐渐增大。在规模化生产地区,由于轮作、倒茬困难,重茬普遍,草莓枯萎病等土传性病害发生日益严重[2]。
草莓枯萎病是由半知菌亚门瘤座菌科镰孢属尖孢镰刀菌草莓专化型(Fusarium oxysporum f. sp. fragariae)侵染引起,它从根部侵染草莓维管束组织,阻碍养分物质输导,导致植株萎蔫死亡[3]。目前,对于该病害的防治仍以化学药剂为主,而长期频繁施用化学杀菌剂具有较高的环境生态代价和抗药性风险[4]。生防菌防治植物土传病害,无药剂残留风险,对环境友好,且能活化土壤,有助于作物健壮栽培[5],已成为国内外科研人员的研究热点。笔者前期從山东省泰安市草莓枯萎病发生严重的设施草莓根际土壤中分离得到1株高效拮抗菌 JM-3,授权专利号为ZL201810272145.5,它对草莓枯萎病菌的平板对峙抑制率为57.42%,以其制备的固体菌剂对草莓枯萎病的90 d田间防效为80.00%,且可提高草莓果实的糖酸比,有助于提升草莓果实品质,但其修复草莓连作土壤的生态机理尚未进行系统研究。
微生物在土壤生态系统中作用巨大,生防菌的大量投入必将对土壤酶活性、微生物多样性及相对丰度等指标产生影响[6]。生防菌与土著微生物的相互作用,对其防控效果的发挥也至关重要[7]。本研究通过生理生化手段评价枯萎病拮抗菌JM-3制剂对土壤酶活性的影响;采用高通量测序技术,系统分析该生防菌制剂处理草莓根际不同时间对草莓连作根际土壤微生物群落结构的影响,探索该生防菌缓解草莓连作障碍的作用机制,对推动草莓产业可持续发展具有重要意义。
1 材料与方法
1.1 试验区概况
试验取样地位于山东省泰安市岱岳区房村镇三棵树草莓采摘园(35°58′123″N,117°12′13″E),属温带气候,全年平均气温12.8 ℃,降水量697 mm,日照时数2 527.1 h。土壤为棕壤土,连续种植草莓4年,土传病害发生较重,土壤养分及理化性质如表1所示。
表1 试验区土壤理化性质
全氮含量(%)全磷含量(%)全钾含量(%)碱解氮含量(mg/kg)硝态氮含量(mg/kg)速效磷含量(mg/kg)速效钾含量(mg/kg)有机质含量(g/kg)pH值
0.1370.0820.64011.1298.4101.1238.916.346.81
1.2 试验设计
2019年8月27日进行土壤处理,共设3个处理:(1)以黄腐酸钾、硅藻土等载体制备菌株JM-3菌体浓度为2×108 CFU/g固体制剂,按20 g/株拌土处理;(2)50%多菌灵可湿性粉剂1000倍稀释液,按20 mL/株灌根处理;(3)空白对照,不做任何处理。每个处理重复3次,每个小区面积50 m2。随机区组排列,处理间设空白保护行。
移栽3叶1心期章姬草莓幼苗,起垄、覆黑膜栽培,每垄2行,垄高40 cm,垄顶宽60 cm,垄底宽90 cm,垄沟宽20 cm,株距15 cm,定植密度12万株/hm2,实施常规栽培管理。
1.3 样品采集
分别于11月27日(初果期)、3月7日(盛果期)和5月7日(末果期)采集土壤。每个处理选取20个点,除去表层土壤后,以钻土器打取5~15 cm土层土壤样品,充分混匀。土样过1 mm孔径筛子后,分成2份。其中1份以干冰保存,用于高通量测定土壤微生物多样性;另1份于4 ℃保存,用于测定土壤酶活性。
1.4 样品测定与分析
1.4.1 土壤酶活性测定 土壤脲酶活性测定采用苯酚钠-次氯酸钠比色法,蔗糖酶活性测定采用3,5-二硝基水杨酸法[8],酸性磷酸酶活性测定采用磷酸苯二钠比色法[9],纤维素酶活性测定采用苏州格锐思土壤纤维素酶试剂盒(G0308F)。
1.4.2 土壤微生物多样性测定 高通量测序分析由北京诺禾致源生物信息科技有限公司代理完成。采用CTAB法提取土壤基因组DNA,以琼脂糖凝胶电泳检测纯度和浓度,并稀释至1 ng/μL。分别采用带Barcode 的16S V4区515F、806R和18S V4区528F、706R特异性引物进行PCR,扩增产物经电泳检测,根据浓度等量混样,以1×TAE 浓度2%的琼脂糖胶电泳纯化,回收目的条带。构建文库,经过Qubit 定量和文库检测合格后,使用Thermofisher的Ion S5TMXL进行上机测序。
剪切掉低质量部分reads,拆分出各样品数据,截去Barcode和引物序列,去除嵌合体序列,得到最终有效数据。利用Uparse软件(v7.0.1001)进行聚类分析,依据算法原则筛选OTUs代表序列。对OTUs序列进行物种注释,并分别在各个分类水平统计各样本的群落组成。以各样品中数据量最少的为标准进行均一化处理,基于此进行后续的α-多样性分析和β-多样性分析。使用Qiime软件(v1.9.1)计算Observed-otus、Chao1、Shannon、Simpson、ACE、Goods-coverage、PD_whole_tree 指数,使用R软件(v2.15.3)绘制稀释曲线,并进行 α-多样性指数组间差异分析。使用R软件(2.15.3)绘制PCA图。
1.5 数据处理
采用EXCEL 2010和SPSS 18.0进行数据统计分析。
2 结果与分析
2.1 拮抗菌JM-3对草莓连作土壤酶活性的影响
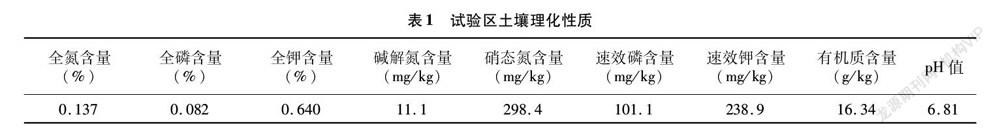
由图1可知,对于土壤脲酶,在初果期、盛果期和末果期,拮抗菌JM-3处理的酶活性均略高于多菌灵药剂处理和空白对照。对于纤维素酶,在盛果期,拮抗菌JM-3处理的酶活性远高于多菌灵处理和空白对照,末果期活性略低。对于酸性磷酸酶,在盛果期和末果期,拮抗菌JM-3处理的酶活性均高于药剂处理和空白对照。对于蔗糖酶,在初果期和盛果期,拮抗菌JM-3处理的酶活性高于药剂对照和空白对照。
2.2 拮抗菌JM-3对草莓连作土壤真菌多样性的影响
由图2可知,多菌灵处理的初果期曲霉属(Aspergillus)相对丰度较高,盛果期根霉属(Rhizopus)相对丰度较高,盛果期和末果期毛壳属(Chaetomium)相对丰度较高。拮抗菌JM-3处理的初果期新赤壳属(Neocosmospora)相对丰度较高,盛果期毛壳属和腐质酶属(Humicola)相对丰度较高,末果期新赤壳属和漆斑菌属(Myrothecium)相对丰度较高。对照区盛果期新赤壳属和漆斑菌属相对丰度较高,末果期曲霉属相对丰度较高。
2.3 拮抗菌JM-3对草莓连作土壤细菌多样性的影响
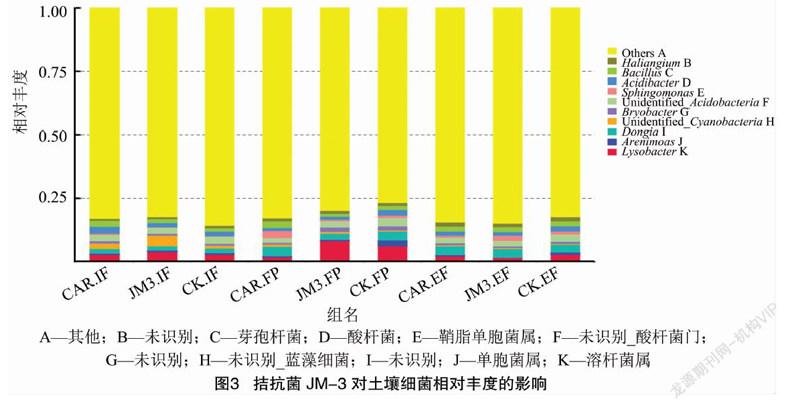
由图3可知,多菌灵处理的初果期酸杆菌(Acidibacter)相对丰度较高,盛果期鞘脂单胞菌属(Sphingomonas)相对丰度较高。拮抗菌JM-3处理的初果期蓝藻细菌(Unidentified_Cyanobacteria)相对丰度比较高,盛果期溶杆菌属(Lysobacter)相对丰度较高,末果期鞘脂单胞菌属相对丰度較高。对照区盛果期单胞菌属(Arenimonas)和溶杆菌属相对丰度较高,末果期酸杆菌相对丰度较高。
2.4 不同处理草莓连作土壤真菌群落结构的PCA分析
由图4可见,在初果期,各处理间的真菌群落PCA 距离较远,其中CK与拮抗菌JM-3和多菌灵处理的距离更远,表明处理间的真菌群落结构差异较大。在盛果期和末果期, 各处理的真菌群落PCA
距离较近,其中拮抗菌JM-3处理与多菌灵处理之间的真菌群落距离较近,可以推测该拮抗菌对土壤真菌具有一定的抑制作用。
2.5 不同处理草莓连作土壤细菌菌群落结构的PCA分析
由图5可见,初果期各处理的细菌群落与盛果期和末果期的PCA距离较远,表明初果期的细菌群落结构与盛果期和末果期差距较大。盛果期和末果期的CK处理细菌PCA距离较近,表明草莓连作土壤在中后期的细菌群落结构变化不大。
3 讨论与结论
土壤酶由植物根系分泌和微生物代谢产生,参与土壤生物化学反应过程和养分循环,是土壤中具有催化能力的一类生物活性物质,也是影响土壤微生态环境的重要因素[10]。土壤酶是衡量土壤生态系统变化的敏感指标。生防制剂或化学药剂的大量投入,必将对土壤酶活性产生影响。土壤脲酶催化酰胺化合物水解, 产生的氨是植物生长所需的重
要氮素来源。酸性磷酸酶催化土壤中的有机磷转化为植物可直接吸收的无机磷[11]。蔗糖酶又称转化酶,参与有机质代谢过程,为植株生长提供能源[12]。纤维素酶可催化降解土壤纤维素,促进土壤能量转化[13]。刘丽等报道,接种根瘤菌和促生菌,可显著提高大豆成熟期土壤的脲酶和蔗糖酶活性[14]。范琳娟等报道,以棉隆熏蒸处理草莓重茬土壤,土壤脲酶和磷酸酶活性分别降低201.00%和27.48%,并引起土壤肥力降低[15]。田给林等报道,草莓连作土壤灭菌后施用蚯蚓粪,可提高土壤脲酶活性,是缓解草莓连作土壤灭菌对草莓植株生长发育影响的有效措施[16]。曹丹等报道,生物有机肥可显著提高草莓连作土壤脲酶、酸性磷酸酶和过氧化氢酶的活性[17]。本研究发现,在盛果期,拮抗菌 JM-3 处理可提高草莓连作土壤的纤维素酶、酸性磷酸酶和蔗糖酶活性,在初果期和末果期影响不明显,推测拮抗菌JM-3可促进草莓连作土壤的能量和有机磷转化。
土壤微生物是土壤生态系统的重要组成,促进土壤有机质的分解和养分的吸收、转化[18]。土壤微生物群落结构失衡是造成草莓连作障碍的主要原因[15]。深入研究拮抗菌JM-3土壤处理后与土著微生物的互作关系,对于揭示该生防菌缓解草莓连作障碍的作用机制、开发新型生防制剂以及保障草莓可持续绿色生产等具有重要科学意义。曹坳程等报道,草莓田多年施用氯化苦熏蒸会导致细菌多样性显著下降,而真菌多样性不受影响[19]。王廷峰等报道,玉米套作及秸秆还田处理后,草莓连作土壤微生物结构由“真菌型”转变为“细菌型”,增强了抵御病虫害侵染的能力[20]。马丽等报道,施用生物炭能够增加连作草莓根际土壤微生物含量,促进草莓根系生长[21]。陈哲等报道,以敌磺钠和微生物肥料共同处理草莓连作土壤,可降低真菌多样性,提高细菌多样性及有益菌属的丰度[22]。本研究以拮抗菌JM-3固体制剂处理草莓连作土壤,采用高通量测序分析发现,对于真菌而言,拮抗菌JM-3处理的初果期新赤壳属(Neocosmospora)相对丰度较高,盛果期毛壳属(Chaetomium)和腐质酶属(Humicola)相对丰度较高,末果期新赤壳属和漆斑菌属(Myrothecium)相对丰度较高,可见其可在一定程度上提高盛果期草莓连作土壤的有益菌含量。对于细菌而言,拮抗菌JM-3处理的盛果期溶杆菌属(Lysobacter)相对丰度较高,末果期鞘脂单胞菌属(Sphingomonas)相对丰度较高。主成分分析(PCA)结果表明,对于真菌,在盛果期和末果期,拮抗菌JM-3处理与多菌灵处理之间的真菌群落距离较近,推测该拮抗菌对土壤真菌具有一定的抑制作用;对于细菌,初果期的细菌群落结构与盛果期和末果期差距较大。盛果期和末果期的空白对照处理细菌群落PCA距离较近,表明草莓连作土壤在中后期的细菌群落结构变化不大。
参考文献:
[1]邬 劼,王晓琳,黄洁雪,等. 7种杀菌剂对草莓胶孢炭疽菌和灰霉病病菌的室内毒力测定[J]. 江苏农业科学,2019,47(20):129-133.
[2]Suga H,Hirayama Y,Morishima M,et al. Development of PCR primers to identify Fusarium oxysporum f. sp. fragariae[J]. Plant Disease,2013,97(5):619-625.
[3]顾春波,姜莉莉,王开运,等. 抗戊唑醇草莓枯萎病菌ZY-W的诱导及其生物学特性[J]. 中国农业科学,2010,43(14):2897-2904.
[4]顾春波,史晓斌,姜莉莉,等. 草莓枯萎病菌对多菌灵的抗性及其抗性菌株生物学特性[J]. 植物保护学报,2010,37(3):266-272.
[5]冯江鹏,邱莉萍,梁秀燕,等. 草莓胶孢炭疽菌拮抗细菌贝莱斯芽孢杆菌JK3的鉴定及其抗菌活性[J]. 浙江农业学报,2020,32(5):831-839.
[6]Larkin R P. Impacts of biocontrol products on Rhizoctonia disease of potato and soil microbial communities,and their persistence in soil[J]. Crop Protection,2016,90:96-105.
[7]Paulitz T C. Population dynamics of biocontrol agents and pathogens in soils and rhizospheres[J]. European Journal of Plant Pathology,2000,106:401-413.
[8]张 超,周 旭,张 海,等. 苹果专用肥对旱地果园土壤酶活性以及微生物多样性的影响[J]. 生态学杂志,2017,36(12):3485-3492.
[9]钟晓兰,李江涛,李小嘉,等. 模拟氮沉降增加条件下土壤团聚体对酶活性的影响[J]. 生态学报,2015,35(5):1422-1433.
[10]范琳娟,刘奇志,宋兆欣,等. 氯化苦对重茬草莓土壤生物和非生物因子的影响[J]. 农药,2017,56(2):131-134.
[11]范琳娟,刘子荣,徐雪亮,等. 6种杀线剂对重茬山药土壤微生物数量、酶活性和养分含量的影响[J]. 浙江农业学报,2021,33(3):506-515.
[12]钟晓兰,李江涛,李小嘉,等. 模拟氮沉降增加条件下土壤团聚体对酶活性的影响[J]. 生态学报,2015,35(5):1422-1433.
[13]汪子微,万松泽,蒋洪毛,等. 青藏高原不同高寒草地类型土壤酶活性及其影响因子[J]. 植物生态学报,2021,45(5):528-538.
[14]刘 丽,马鸣超,姜 昕,等. 根瘤菌与促生菌双接种对大豆生长和土壤酶活的影响[J]. 植物营养与肥料学报,2015,21(3):644-654.
[15]范琳娟,刘奇志,宋兆欣,等. 温室重茬草莓土壤施用棉隆和氯化苦效果评价[J]. 农药,2017,56(4):293-296.
[16]田给林,严婷婷,毕艳孟,等. 草莓连作土壤灭菌与施用有机肥对根際土壤酚酸及土壤酶活性的影响[J]. 园艺学报,2015,42(10):2039-2048.
[17]曹 丹,凤舞剑,白耀博. 不同施肥处理对连作草莓生长及土壤生物学特性的影响[J]. 北方园艺,2020(17):39-44.
[18]韦小了,何 季,何腾兵,等. 种植年限对刺梨园土壤微生物数量和酶活性的影响[J]. 江苏农业科学,2019,47(13):280-284.
[19]曹坳程,方文生,王秋霞,等. 氯化苦的生态毒理效应[J]. 世界农药,2020,42(10):32-35,45.
[20]王廷峰,赵密珍,关 玲,等. 玉米套作及秸秆还田对草莓连作土壤养分及微生物区系的影响[J]. 江苏农业学报,2019,35(6):1421-1427.
[21]马 丽,齐红志,闫 明,等. 生物炭对连作障碍条件下土壤微生物和草莓生长的影响[J]. 江苏农业科学,2019,47(17):142-146.
[22]陈 哲,黄 静,赵 佳,等. 杀菌剂和肥料对连作草莓根际土壤微生物多样性的影响[J]. 山西农业科学,2019,47(8):1380-1385,1433.
