吉林省大丽轮枝菌培养性状与遗传特性及致病性分析
2021-12-08范惠冬林岩耿伟刘燕妮毛芙蓉郑建超郑士金惠云芝
范惠冬 林岩 耿伟 刘燕妮 毛芙蓉 郑建超 郑士金 惠云芝


摘要:茄子黄萎病发生在门茄坐果后,是危害茄子生产的重要病害。茄子黄萎病由大丽轮枝菌引起,为深入研究吉林省大丽轮枝菌的群体遗传变异,对分离自吉林省的36株大丽轮枝菌进行培养性状观察、遗传特性分析和致病性鉴定。大丽轮枝菌菌株在PDA培养基上培养14 d后形成菌核型、中间型2种菌落形态,其中83.3%的为菌核型,16.7%为中间型,未分离得到菌丝型菌株。利用PCR技术检测大丽轮枝菌的Ave1无毒基因、致病类型、交配型。结果表明,36株大丽轮枝菌均不含Ave1无毒基因,致病类型均为非落叶型,交配型均为MAT1-2。选取6株大丽轮枝菌进行致病性鉴定,结果表明,6株大丽轮枝菌均可不同程度引起茄子黄萎病,其中2号大丽轮枝菌菌株致病力最强,4号菌株致病力最弱。研究结果可为茄子抗黄萎病育种和针对性制定茄子黄萎病防控方法提供技术支持。
关键词:大丽轮枝菌;培养性状;致病类型;致病性鉴定;遗传特性
中图分类号:S436.411 文献标志码: A
文章编号:1002-1302(2021)22-0125-07
收稿日期:2021-03-11
基金项目:吉林省科技发展计划技术攻关项目(编号:20190301053NY)。
作者简介:范惠冬(1990—),女,吉林长春人,硕士,研究实习员,研究方向为蔬菜病虫害及蔬菜育种。E-mail:fanhuidong1812@163.com。
通信作者:惠云芝,硕士,研究员,主要从事茄子育种研究。E-mail:110555166@qq.com。
大丽轮枝菌属轮枝菌属 (Verticillium) 真菌,由大丽轮枝菌引起的茄子黄萎病是危害茄子生产最重要的土传病害,黄萎病发病轻时造成茄子减产20%,发病严重时造成茄子减产60%甚至绝产。由于大丽轮枝菌致病机制复杂,茄子抗病育种工作滞后同时生产中缺少对茄子黄萎病科学有效的防治方法,导致茄子黄萎病每年在茄子产区大面积发生,造成巨大经济损失。研究引起茄子黄萎病的病原菌群体遗传变异及致病类型对茄子黄萎病防治及抗黄萎病育种有重要意义。
目前研究普遍认为,茄子对大丽轮枝菌无小种特异性抗性,无法将大丽轮枝菌划分race1和race2,但可通过Ave1无毒基因检测研究潜在的生理小种类型[1]。通过现代分子生物学技术、培养性状观察等方法可对大丽轮枝菌进行生理型划分。通过培养性状观察将大丽轮枝菌分为菌核型、中间型、菌丝型[2];利用特异性引物检测可将大丽轮枝菌的致病类型划分为非落叶型、落叶型[3],落叶型菌株可以引起发病植株落叶,非落叶型植株不易引起发病植株落叶。交配型基因座是控制子囊真菌有性繁殖和交配亲和性的遗传基础,交配型基因座含有交配型基因( mating-type,简称MAT)。按大丽轮枝菌所含的交配型基因将菌株分为交配型1和交配型2,同宗配合的子囊真菌可由单个含有MAT1-1和MAT1-2交配型的菌株完成有性生殖过程为交配型1,异宗配合的子囊真菌因2种交配型基因分别存在2种不同类型的菌株中,有性生殖需由分别含有MAT1-1 和 MAT1-2的2种交配型基因座的交配型菌株共同完成为交配型2。尽管大丽轮枝菌目前仍以无性生殖方式繁殖,但关于大丽轮枝菌有性生殖的研究正逐步深入。
由于種植模式及管理方式不合理等原因,茄子黄萎病呈爆发式增长,但相关研究仍然很少,且研究深入性不够。此外,生产中缺少对黄萎病高抗的茄子品种也是导致茄子大面积发生黄萎病的原因。对茄子品种进行抗病性鉴定淘汰感病品种,种植高抗、中抗品种是解决茄子黄萎病最理想的方法。本研究以分离自吉林省的大丽轮枝菌为研究材料,对菌株是否有Ave1无毒基因[4]、培养特性、致病力分化、交配型及菌株致病性等方面进行研究,以期为茄子黄萎病育种及防治提供技术支持。
1 材料与方法
1.1 菌株
2017年至2020年分别在吉林省长春市双阳区、公主岭市、德惠市等地采集茄子黄萎病发病植株样品,在实验室分离纯化后共得到60株引起茄子黄萎病的大丽轮枝菌菌株,经显微镜观察鉴定后,低温保存[5-7]。
1.2 PDA培养性状观察
选取36株初期菌落培养表型不同的大丽轮枝菌菌株于马铃薯葡萄糖琼脂培养基(PDA)平板上活化,在温度为25 ℃条件下培养5 d后,取菌落边缘菌丝再次活化,14 d后观察菌落形态,每个菌株重复培养3次。
1.3 PCR检测
1.3.1 提取菌株基因组DNA 取活化好的菌丝接种到铺有灭菌玻璃纸的PDA培养基上,在温度为 25 ℃ 条件下培养7 d后,在菌株未形成过多菌核之前,用镊子刮取玻璃纸上的菌丝和微菌核于2 mL离心管中,液氮预冷后用研钵研磨呈细粉状,采用真菌基因组提取试剂盒[购自生工生物工程(上海)股份有限公司],提取36株菌株的基因组DNA,低温保存[8-9]。
1.3.2 引物设计 大丽轮枝菌检测采用引物:ITS1(5′-CCGTAGGTGAACCTGCGG-3′)、ITS4(5′-CCTCCGCTTATTAATATGC-3′)确定菌株是否为大丽轮枝菌,扩增目的条带大小为503 bp;生理小种检测采用引物:Ave1-F(5′-AAGGGGTCTTGCTAGGATGG-3′)、Ave1-R(5′-TGAAACACTTGTCCTCTTGCT-3′)扩增目的片段大小为900 bp,检测分离菌株是否含有无毒基因;致病类型中落叶型检测引物采用:D-F(5′-CATGTTGCTCTGTTGACTGG-3′)、D-R(5′-GACACGGTATCTTTGCTGAA-3′)扩增目的条带大小为550 bp,致病类型中非落叶型检测引物采用:ND-F(5′-CAGGGGATACTGGTACGAGACG-3′)、ND-R(5′-ATGAGTATTGCCGATAAGAACA-3′)扩增目的条带大小为1 500 bp;交配型1检测引物采用:MAT1-F(5′-CCACTCGAAACCCCACCGTC-3′)、MAT1-R(5′-GGCCTCCATGTTGTAAGCGT-3′)扩增目的条带大小为997 bp;交配型2检测引物采用:MAT2-F(5′-CAGGCCCATGGTCGTGAT-3′)、MAT2-R(5′-CTAGCTGTGCTGCCACTTGTTC-3′)扩增目的条带大小为669 bp,所有引物均由生工生物工程(上海)股份有限公司合成。
1.3.3 PCR反应和扩增 检测所提取的菌株基因组DNA质量并10倍稀释后作为PCR程序模板,PCR扩增所用酶采用购自生工生物工程(上海)股份有限公司的Taq PCR Master Mix (2X,with Blue Dye),所有PCR扩增均采用总量为25.0 μL的体系进行,DNA模板2.0 μL,上下游引物各1.0 μL,Taq PCR Master Mix (2X,with Blue Dye) 12.50 μL,补超纯水至 25.0 μL。PCR程序为94 ℃ 2 min;94 ℃ 45 s,58 ℃ 45 s,循环30次;2 ℃ 延伸10 min,4 ℃保存。用1%琼脂糖凝胶电泳检测扩增产物,紫外凝胶成像仪观察结果。
1.4 致病性鉴定
随机选取36株大丽轮枝菌中的6株重新编号进行致病性鉴定,将带有活化好大丽轮枝菌的PDA菌饼接种到液体马铃薯葡萄糖培养基中,每300 mL液体培养基放4~5个菌饼,25 ℃摇培14 d后,用血球计数板计数,当大丽轮枝菌孢子浓度达到 1×107个/mL 后,用4层纱布过滤孢子悬浮液备用。大丽轮枝菌接种采用伤根接种法,供试茄子品种为同一品种,由吉林省蔬菜花卉科学研究院提供。待生长在无菌土上的茄子幼苗长到3叶1心时,将幼苗从穴盘中拔出,减掉1 cm须根,浸泡在浓度为 1×107个/mL孢子悬浮液中15 min,对照组用清水浸泡15 min,再将所有幼苗重新移至穴盘中,黑暗保温保湿培养48 h后进行正常培养,适时浇水。每个试验组样本量至少为20株茄子幼苗,茄子幼苗接种30 d后调查幼苗发病情况。
病害分级按照肖蕴华等分级方法[10]进行,1 级:只有第1真叶变黄或卷曲;2 级:第3真叶以下部分表现黄萎,叶片有脱落;3 级:只有1片新生的展开真叶表现健康,植株落叶明显;4级:所有展开的真叶全部脱落,植株只剩1片旗叶;5 级:植株死亡;分别调查茄子幼苗发病率,统计病情指数,试验数据用 SPSS 统计软件进行方差分析。
发病率=(發病株数/总株数)×100%;
病情指数=[∑(各级病株数×相对应的病级值)/(总株数×5)]×100。
2 结果与分析
2.1 分离鉴定及培养性状观察
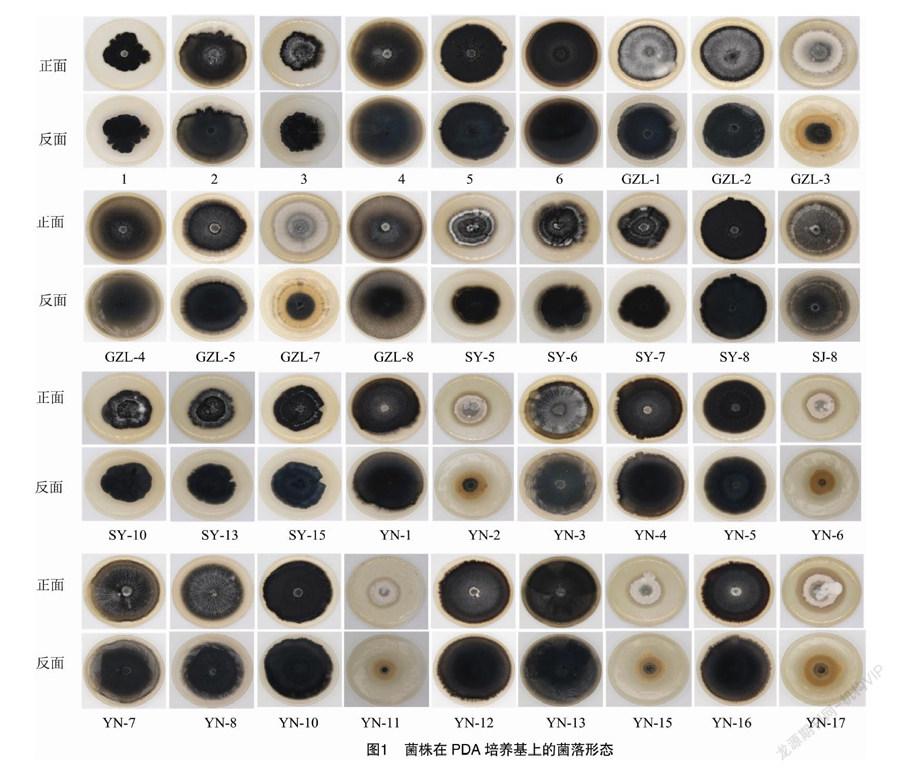
大丽轮枝菌在PDA培养基上培养14 d后观察,菌落培养性状差异明显,依据3种菌落类型进行统计。菌核型菌落(H):菌丝生长一段时间后形成大量布满基质的微菌核,菌落呈黑色;菌丝型菌落(S):菌株培养14 d后菌落仍以菌丝存在,无微菌核形成,菌落呈白色;中间型菌落(M):菌株培养14 d后一部分菌丝形成黑色微菌核,一部分仍以菌丝形态存在,菌落既有白色菌丝也有黑色菌核;中间型菌落介于菌核型和菌丝型菌落之间,3种培养性状的大丽轮枝菌菌落均具有明显辐射状纹路。供试36株菌株中,6株为中间型菌落,占16.7%,30株为菌核型菌落,占83.3%,菌核型大丽轮枝菌占绝对优势,本研究未分离到菌丝型大丽轮枝菌,菌落培养形态结果见图1,每个菌株均展示了菌落正面和反面的形态,菌株类型统计结果见表1。
采用引物ITS1/ITS4分别检测36株菌株,菌株经PCR扩增及凝胶电泳均能检测到大小为503 bp的目的条带,表明供试36株菌株均为大丽轮枝菌,电泳结果见图2。
2.2 遗传变异
采用引物Ave1-F/Ave1-R检测36株大丽轮枝菌是否含有Ave1无毒基因,PCR扩增产物电泳供试36株大丽轮枝菌均未扩增到大小为900 bp的目的条带,表明供试菌株均不具有Ave1无毒基因,电泳结果见图3。
采用引物D-F/D-R、ND-F/ND-R进行PCR扩增,检测大丽轮枝菌致病类型,以D-F/D-R为引物的PCR扩增产物凝胶电泳结果(图4-A),所有菌株均未得到大小为550 bp的目的条带,以 ND-F/ND-R 为引物进行PCR扩增产物凝胶电泳(图4-B),所有菌株都得到大小为1 500 bp的目的条带,说明36株大丽轮枝菌致病类型均为非落叶型,电泳结果见图4。
采用引物MAT1-F/MAT1-R、MAT2-F/MAT2-R检测菌株交配类型,PCR产物电泳结果表明,以MAT1-F/MAT1-R为引物进行PCR扩增电泳(图5-A),所有菌株均未得到大小为 997 bp 的目的条带;以MAT2-F/MAT2-R为引物进行PCR扩增产物电泳(图5-B),所有菌株均得到大小为669 bp的目的条带,说明分离自吉林省的36株大丽轮枝菌均为交配型2,无交配型1,电泳结果见图5。
2.3 致病性鉴定
大丽轮枝菌接种茄子幼苗30 d后,6株大丽轮枝菌均可不同程度地引起茄子幼苗发生黄萎病,而接种清水的对照组植株均未发生黄萎病。按照肖蕴华病害分级调查病情指数并统计发病率,结果见表2。其中接种2号菌株的茄子幼苗发病率为50%,病情指数为41.6,接种2号菌株的茄子幼苗发病率和病情指数在6株菌株中均最高,说明在6株大丽轮枝菌中2号菌株致病性最强;接种4号菌株的茄子幼苗发病率为20.8%,病情指数为17.5,接种4号菌株的茄子幼苗发病率最低,病情指数最低,说明4号大丽轮枝菌在6株菌株中致病性最弱,其他菌株致病性均在2号菌株和4号菌株之间,致病性鉴定结果见图6。
3 讨论与结论
我国对大丽轮枝菌的研究多针对引起棉花黄萎病的菌株,针对引起茄子黄萎病的大丽轮枝菌研究较少。近几年北方茄子黄萎病发生面积急剧扩大,由于对病害的了解较少,导致病害未得到及时防控,发生越来越重[11]。由于不断引进新品种,大丽轮枝菌的致病分化逐渐复杂,充分了解大丽轮枝菌致病力分化,是科学防治茄子黄萎病和抗病育种的基础[12]。本研究以分离自吉林省的大丽轮枝菌为材料,对菌株进行培养性状、群体遗传变异和致病性分化研究。
病原菌形态变异分析多采用简单直观的培养性状观察法完成,雷玉明等于1997年提出大丽轮枝菌培养性状存在菌丝型,随后将大丽轮枝菌培养类型划分为3种,即菌核型、菌丝型、中间型[13]。本研究共分离得到60株大丽轮枝菌,选取培养性状不同的36株大丽轮枝菌进行研究,发现吉林省大丽轮枝菌在PDA培养基上的菌落形态分为2种类型,即菌核型和中间型,且菌核型大丽轮枝菌占绝对优势。采用分子生物学方法利用大丽轮枝菌特异性引物鉴定病原菌种类[14],凝胶电泳结果表明,36株菌株均能得到特异性扩增目的条带,说明分离到的病原菌均为大丽轮枝菌,可进行后续研究。
采用分子生物学技术对大丽轮枝菌的致病类型进行研究[15],根据引起棉花黄萎病的大丽轮枝菌对棉花致病严重程度的不同,赵晓军将大丽轮枝菌菌株分为落叶型(植株叶片脱落)和非落叶型(植株叶片不脱落)[16]。利用刘晶晶等设计的落叶型和非落叶型特异性引物D-F/D-R、ND-F/ND-R,鉴定分离到的大丽轮枝菌致病类型[17],PCR扩增及琼脂糖凝胶电泳结果表明,36株大丽轮枝菌均为非落叶型菌株,无落叶型菌株,该结果与喻秀秀等研究引起茄子黄萎病的大丽轮枝菌致病类型均为非落叶型的结果[18]一致。 大丽轮枝菌是否存在有性生
殖及有性生殖的方式是病原菌病理学方向研究的热点,同时也是病虫害科学合理防治的基础。基因组学中发现大丽轮枝菌存在MAT1-1、MAT1-2这2种交配型,但二者中以MAT1-2交配型占绝对优势,而本研究的PCR扩增产物检测结果也表明36株大丽轮枝菌交配型均为MAT1-2,无MAT1-1型,与前人相关研究结果一致。
选取6株分离到的大丽轮枝菌进行致病性鉴定,结果表明6株大丽轮枝菌均具有致病力,能够引
起苗期茄子黄萎病,但每个菌株致病力存在差异,其中2号大丽轮枝菌致病力最强,4号菌株致病力最弱,试验筛选出的吉林省茄子黄萎病的高致病力菌株,可用于茄子抗病性检测,辅助抗病育种。
本试验充实了关于引起茄子黄萎病大丽轮枝菌的相关研究。明确了大丽轮枝菌的致病类型、群体遗传变异,筛选出高致病性菌株可以为抗黄萎病育种提供理论及技术依据。
参考文献:
[1]刘琳琳,张文文,周 易,等. 棉花与番茄抗棉花黄萎病不依赖于Ve1[J]. 中国科学(生命科学),2014,44(8):803-814.
[2]邓 晟,章如意,林 玲,等. 江苏省大丰市棉花黄萎病菌培养特性及致病力分化[J]. 江苏农业科学,2012,40(12):133-135.
[3]Pérez-Artés E,García-Pedrajas M D,Bejarano-Alcázar J,et al. Differentiation of cotton-defoliating and nondefoliating pathotypes of Verticillium dahliae by RAPD and specific PCR analyses [J]. European Journal of Plant Pathology,2000,106(6):507-517.
[4]Fradin E F,Zhang Z,Juarez Ayala J C,et al.Genetic dissection of Verticillium wilt resistance mediated by tomato Ve1[J]. Plant Physiology,2009,150(1):320-332.
[5]于 淼.河北省茄子黄萎病菌的分离鉴定及抗性资源筛选[D]. 保定:河北农业大学,2013:8-9.
[6]周晓慧,刘 军,江 蛟,等. 引起茄子黄化萎蔫病原菌的分离与鉴定[J]. 江苏农业科学,2012,40(12):127-129.
[7]李 侠.内蒙古西部区茄子黄萎病病原菌的分离鉴定[J]. 内蒙古农业科技,1986,14(4):36-37.
[8]朱有勇,王云月,BruceRLyon.棉花黄萎病PCR检测[J]. 云南农业大学学报,1998,13(1):161-163.
[9]岳永亮.七種农林植物黄萎病病原鉴定及其交互感染试验[D]. 石河子:石河子大学,2015:11-13.
[10]肖蕴华,林伯青. 茄子种质资源黄萎病抗性鉴定[J]. 中国蔬菜,1995(1):32-33.
[11]范惠冬,惠云芝,林 岩,等. 吉林省茄子黄萎病发生与防治[J]. 吉林蔬菜,2019(4):44.
[12]王立新,陆家云,方中达.大丽轮枝菌在茄子及番茄上的致病力分化[J]. 南京农业大学学报,1987,10(4):48-52.
[13]雷玉明,张建朝,邢会琴,等. 设施土壤茄子黄萎病菌的分离及其分布规律研究[J]. 长江大学学报(自然科学版),2014,11(17):8-11,2.
[14]张国丽,谢宗铭,冯自力,等. 新疆棉花枯、黄萎病的发生现状及其快速分离技术[J]. 植物保护,2020,46(3):260-265.
[15]朱 鹤,徐 敏,王子胜.辽宁棉区黄萎病病菌分离鉴定及致病力分析[J]. 江苏农业科学,2018,46(20):82-85.
[16]赵晓军.向日葵和马铃薯大丽轮枝菌的遗传多样性、致病力分化以及交互侵染的研究[D]. 呼和浩特:内蒙古农业大学,2018.
[17]刘晶晶,庞叶洲,张敬泽.茄子黄萎病病原菌致病型分化及其生物防治[J]. 浙江大学学报(农业与生命科学版),2019,45(4):407-417.
[18]喻秀秀,王 卿,张 昕,等. 江苏省大丽轮枝菌的培养、遗传及致病特性分析[J]. 植物病理学报,2018,48(3):378-388.
