田菁相关研究进展与应用现状
2021-12-08贺亭亭邢锦城刘冲董静朱小梅赵宝泉温祝桂赵小慧洪立洲
贺亭亭 邢锦城 刘冲 董静 朱小梅 赵宝泉 温祝桂 赵小慧 洪立洲
摘要:土壤盐渍化是全球严峻的生态环境问题之一,我国盐渍化土壤占全国可利用土地面积的4.9%。豆科草本植物田菁在逆境条件下具有很强的生存能力,目前已成为盐土改良的先锋植物之一,并且在工业和医学领域也发现了其利用价值。对田菁2种不同的结瘤方式进行详细论述,阐明田菁自身对胁迫环境的响应机制以及内生菌和根际微生物的协同抗逆作用,揭示了田菁茎瘤固氮根瘤菌对禾本科作物的促生作用,并总结了田菁作为夏季绿肥在农业上的应用现状。田菁相关研究虽然已取得一定的进展,但碎片化的理论并不能构成体系。对现有的研究成果进行总结,以期为后续开展田菁相关的分子机制研究和生产应用奠定基础。
关键词:田菁;结瘤特点;耐逆机制;生产应用;土壤改良
中图分类号:S551+.501 文献标志码: A
文章编号:1002-1302(2021)22-0043-07
收稿日期:2021-03-04
基金项目:沿海盐碱地农业科学观测实验站开放课题(编号:YHS201804);江苏农业科技援疆-克州盐碱地改良利用示范基地项目[编号:JATS(2019)228]。
作者简介:贺亭亭(1986—),女,山东烟台人,博士,助理研究员,主要从事田菁新材料选育及其促生微生物相关研究。E-mail:ht142857@163.com。
通信作者:邢锦城,硕士,副研究员,主要从事耐盐植物新品种选育和植物逆境生理方面的研究。E-mail:sdauxxx@163.com。
2018年农业农村部根据中共中央办公厅、国务院办公厅《关于创新体制机制推进农业绿色发展的意见》的有关部署,制定了《农业绿色发展技术导则(2018—2030年)》。该导则中提到了绿肥与作物生产相结合的种植模式与利用技术。研究发现,绿肥不但能够改善土壤理化性质,增强土壤肥力,还能够减少化肥施用量、降低土壤重金属含量,改善土壤连作障碍。近年来,绿肥在土壤改良和污染治理过程中发挥了重要作用。
田菁[Sesbania cannabina (Retz.)Poir.]为一年生豆科草本植物,羽状复叶,高度可达2.0~3.5 m,根系发达,具有2种不同的结瘤方式且固氮能力强、生物量大,是优质的夏季绿肥,在东北、华北、华东、华南、华中和西北地区广泛种植。田菁具有耐盐、耐涝、耐旱、耐贫瘠等特点,并且具有较强的抵御病、虫、草害的能力,但目前的研究主要集中于田菁的耐涝和耐盐方面。自20世纪60—90年代间,田菁作为绿肥开始对其进行研究,至今已在农业、工业、医学等方面取得了部分研究成果。本研究从田菁自身入手,阐述其为适应环境所采用的不同结瘤方式,及其响应环境胁迫的应答机制,揭露田菁根系内外微生物的协同抗逆作用,解析田菁及其招募的茎瘤固氮根瘤菌在农业生产中的作用,并总结了田菁在农业、工业、医学领域的应用现状及前景,以期为田菁及其相关的深入研究提供借鉴。
1 田菁不同結瘤方式的研究
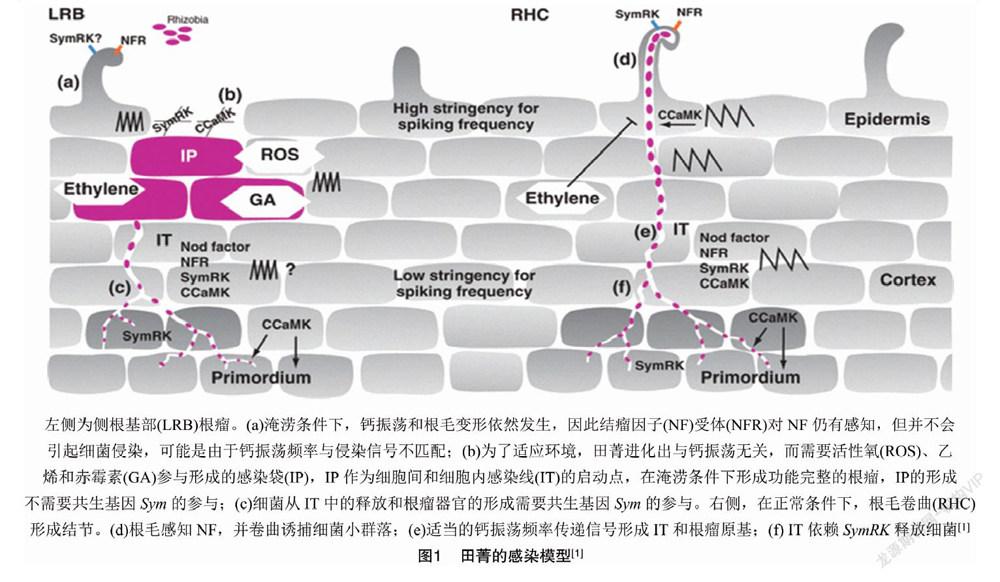
田菁携带有休眠的不定根原基,当被水淹没时能够发展成根,进而产生茎瘤,此外还能在侧根基部形成根瘤。因此,田菁具有多种结瘤特征和双根瘤菌侵染途径,具体如图1所示[1]。在非淹涝条件下,根瘤菌通过根毛卷曲和形成管状感染线(infection thread,IT)侵入田菁(图1 右侧)。在淹涝环境下,乙烯大量积累[2],会通过妨碍结瘤因子(nod factor,NF)诱导的钙振荡来抑制根毛感染。因此,一种替代严格侵染机制的策略发展开来。根瘤菌通过侧根基部的表皮裂隙进入外皮层,在细胞间形成感染袋(infection pocket,IP),该过程需要活性氧(reactive oxygen species,ROS)、乙烯和赤霉素(gibberellin,GA)的参与,之后以IP为基础形成IT,进而产生根瘤(图1左侧)。
在蒺藜状苜蓿(Medicago truncatula)发生根毛感染的细胞中,NF诱导的钙振荡有个快速上升的斜率和一个缓慢下降的斜率[3]。而淹涝条件下生长的田菁根毛中NF诱导的钙振荡速率相比之下更快
且匀称,根毛只是生长和变形而不会被感染。在加入乙烯抑制剂后,钙振荡频率与蒺藜状苜蓿相似,发现根毛中出现细胞感染的现象[1]。将细胞中钙-钙调素依赖性蛋白激酶(CCaMK)基因敲除后,IT和根瘤无法产生,但IP可以正常形成,说明IP的形成并不依赖于钙振荡。田菁细胞间感染过程中,虽然SymRK基因不参与皮层感染和根瘤起始信号传导,但对于IT是必需的,在细菌释放到植物细胞中及建立功能性共生体的过程中发挥重要作用[4]。田菁根毛的细胞内感染和苜蓿以相同的方式进行,并且需要共同Sym途径[4]。以上结果表明,细胞间感染在形态学和分子水平上均不同于默认的根毛感染途径。
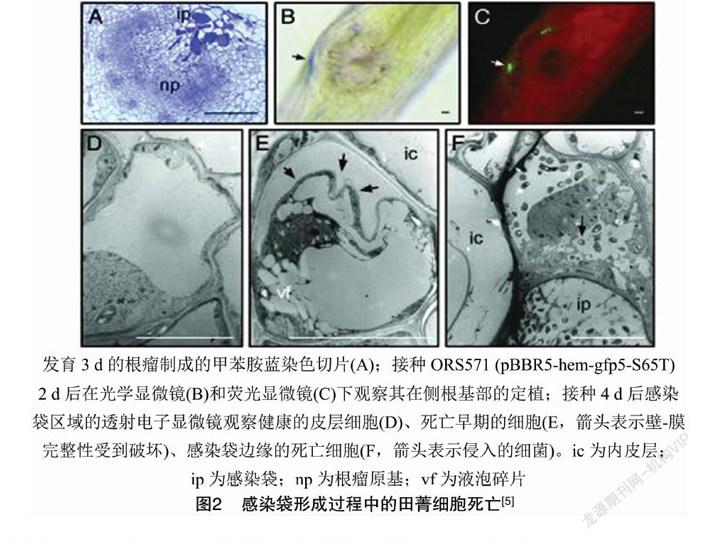
通过透射电子显微镜结合绿色荧光蛋白标记细菌发现,细菌的定植伴随着水培毛萼田菁(Sesbania rostrata)根毛局部细胞的死亡(图2)。乙烯、ROS合成抑制剂和H2O2清除剂均能够阻断Nod因子诱导的根毛卷曲,也没有细菌入侵、感染袋或根瘤原基形成的迹象,表明内源性乙烯和ROS介导了这些响应过程[5]。毛萼田菁水培根中,乙烯介导了Nod因子触发侧根基部的细胞分裂,增加具有死亡特征的细胞数量,积累酚类化合物,形成带有残存细胞壁的空腔,从而强化通气组织,成为淹涝胁迫反应的一部分[5]。尽管在陆生植物中,乙烯参与停滞生长和成熟,但在半水生植物中,乙烯能够刺激植株的生长和分裂过程[6]。研究表明,在毛萼田菁中,根瘤原基的起始取决于ROS,H2O2与细菌不同阶段的侵染共定位,但在根瘤原基中未检测到。H2O2首先在与细菌接触的外皮层细胞的细胞质/膜壁上产生。后来,位于感染袋两侧的植物细胞被大量的H2O2包围,并具有细胞死亡的特征。细胞间基质和细胞壁以及一些细胞内感染线中含有大量的H2O2[5]。H2O2作为大分子交联的底物,可能对于细胞壁的硬度和感染线的生长有正向作用[7]。细胞基质中的H2O2似乎并未损害细菌,这可能是由于根瘤菌产生了保护性酶并被胞外多糖所屏蔽[8]。 以上研究结果表明,活性氧和乙烯对水培毛萼田菁侧根基部结瘤起到正向作用。
2 田菁耐逆性的研究
田菁具有耐涝、耐盐、耐旱、耐贫瘠等特点,在胁迫环境下具有较强的生存能力,但是目前的理论研究主要集中于耐涝性和耐盐性2个方面。
2.1 耐涝
在淹涝胁迫下,生长的田菁与对照组相比可以看到大量的不定根和白色海绵根,根瘤数量明显增加且生物量增大[9](图3),根瘤内部微生物中有明显的多羟基丁酸(polyhydroxybutyricacid,PHB)颗粒。已知PHB颗粒可以作为多余碳的吸收池和还原动力,当细菌暴露在限氧条件下时,可以作为碳和能量的储备[10]。根系淹涝会影响根瘤中的氮代谢,并导致一系列代谢变化,改变碳水化合物、能量和氨基酸水平[11]。田菁根瘤中的代谢产物差异集中于次级代谢产物、氨基酸和糖类,对照组和胁迫组表现出不同的聚类,差异率约达到80%[9]。其中苯丙素受非生物刺激合成量增加,而基于苯丙素的聚合物(如木质素、木栓质和单宁)对植物的稳定性具有很大贡献[12]。田菁淹涝胁迫处理3 h,对根系转录组分析发现,5个上调的差异表达基因被注释为编码醇脱氢酶,乙醇发酵为田菁根部提供了能量,但这些差异表达基因(DEG)在淹涝胁迫27 h的田菁中均未显示出表达差异[13]。可能是由于淹涝胁迫诱导了田菁根皮层中通气组织的形成,增加了组织孔隙度,促进了氧在根内的运输(图3)。由于低氧诱导的转录因子可以介导厌氧反应相关基因的表达,在淹涝胁迫早期,bHLH转录因子家族的TF显著上调,而在淹涝胁迫后期,乙烯响应元件结合蛋白显著表达。淹涝胁迫田菁根中类胡萝卜素、类黄酮、类苯丙烷和脂肪酸合成基因下调表达,这些结果与胁迫导致根系总碳水化合物和淀粉合成相关酶、二磷酸腺苷(ADP)-葡萄糖焦磷酸化酶(AGPase)活性下降的研究结果一致,说明田菁根系可以通过调节消耗和产出响应淹涝胁迫[14]。
2.2 耐盐性
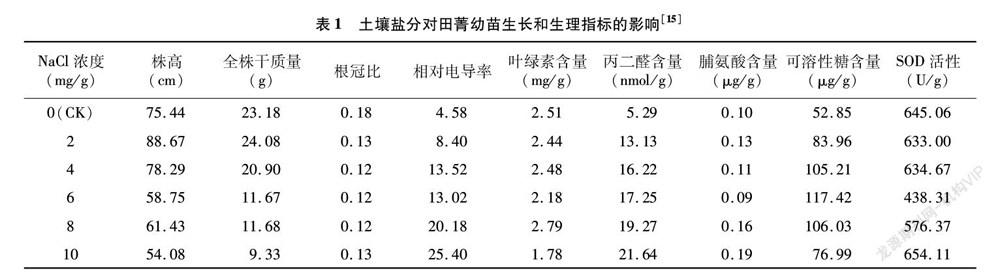
植株幼苗对NaCl耐性的综合评价分析表明,光叶决明、决明、紫穗槐、海滨木槿和田菁的综合评价值依次升高,分别为0.260、0.287、0.477、0.726、0.758,由此可见,田菁对NaCl胁迫具有较高的耐性[15]。但在盐分胁迫处理下,田菁生长和生理指标均受到一定程度的影响(表1)[15]。200 mmol/L NaCl处理丛枝菌根(arbuscular mycorrhiza,AM)与田菁的共生体后,田菁光系统Ⅱ效率值、碳水化合物含量以及ADP-葡萄糖焦磷酸化酶和淀粉合酶的活性得到提高,而叶绿素荧光的非光化学猝灭系数出现降低[16]。与对照相比,AM田菁共生体中与超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)和过氧化物酶(POX)相关的基因表达水平上调,与抗坏血酸盐和藻酸盐代谢以及类胡萝卜素生物合成的相关途径得到增强[17]。田菁中与光合作用、活性氧清除和特定转录因子有关的基因上调表达,通过与AM共生进一步提高了其自身的耐盐性[16]。盐胁迫后,丛枝菌根-田菁共生体中,菌根数量增加,田菁根部脱落酸(abscisic acid,ABA)浓度上升,内源独脚金内酯(strigolactone,SL)水平提高[18]。NaCl和外源ABA、H2O2能够诱导SL生物合成基因CCD7、CCD8和信号基因MAX2的上调表达,说明激素调节在田菁的耐盐过程中发挥着积极的作用[19]。除了丛枝菌根之外,研究人员还从田菁根瘤菌及周围土壤的宏基因组中克隆到一个命名为RSA的极端嗜盐淀粉酶,最适NaCl浓度为 5 mol/L,属于极端嗜盐酶。RSA嗜盐淀粉酶是从非嗜盐菌田菁根瘤菌中获得的,打破了嗜盐酶从嗜盐菌中获得的传统[20]。由此可见,田菁除了自身具备一定的耐盐能力外,与微生物的相互作用进一步增强了其对盐胁迫环境的适应能力。
3 田菁茎瘤在生产上的应用研究
田菁茎瘤固氮根瘤菌ORS571(Azorhizobium caulinodans ORS571)与毛萼田菁共生,既能形成茎瘤也能形成根瘤,首次由Dreyfus从茎瘤中分离出来[21]。ORS571具有自生固氮能力,也可以与宿主共生固氮。ORS571不但能够在田菁、银合欢和菜豆的根部结瘤,还能够定殖于谷类作物的根部[22]。已有研究表明,ORS571能夠在自然条件下与小麦共生,显著提高小麦的含氮量和干物质量[23]。ORS571可从根部侵染小麦,定殖于根的表皮、皮层、维管系统的细胞间隙和细胞内,并可以向上迁移到达叶片[24](图4)。田间试验结果表明,ORS571浸种侵染对小偃22、小偃6号、西农979、陕253、绵阳19、郑引1号、周麦18和矮抗58等小麦品种均有较明显的促生作用。浸种侵染后,幼苗平均根长和株高相较于对照组分别增加了17.04%和8.37%,并且葡萄糖有助于ORS571的浸种侵染和定殖[25]。RT-PCR结果表明,被ORS571侵染的小麦根部中6条与营养元素代谢有关的miRNA相对表达量呈现出先上调后下调的趋势。通过靶基因预测,miR164、miR167和miR169分别作用于NAC1基因、ARF8基因和HAP基因,能够促进侧根的起始和出现,增加侧根的数量,促进根的形态建成和对氮素的吸收。miR398表达受抑制后COX基因表达量增加,参与氧化还原反应,生成的ATP可以为植物根部从土壤中吸收氮素等必需的营养元素提供充足的能量。miR399表达量增加致使靶基因UBC表达下调,可以增加植物对无机磷的吸收和转运,应对磷素的缺乏[24]。
经过对ORS571全基因组测序后发现,基因组内含有一个共生岛,其中包含了多个转移相关的基因和与结瘤因子合成相关的基因。田菁根瘤菌共生岛在属间能够发生水平转移,进而扩大根瘤菌宿主范围。中慢生根瘤菌属(Mesorhizobium)的3种根瘤菌均可接受共生岛,而中华根瘤菌属(Sinorhizobium)部分菌株可接受共生岛,转移的频率为10-8~10-7。共生岛转移后,受体菌便获得了与新宿主结瘤的能力,固氮酶活性测定后发现所结茎瘤同样具有固氮活性。将毛萼田菁、紫云英、玉米作为诱导植物,分别检测其对ORS571共生岛水平转移频率的影响,发现共生岛的转移频率至少提高了10倍,不同植物提高的程度不同,可能与植物根系的分泌物成分相关,具体原因还有待研究[26]。
4 田菁在土壤改良中的应用研究
4.1 改善土壤结构
田菁的种植能够显著降低土壤容重(6.1%)和黏砂粒(14.2%)含量,提高土壤大团聚体(62.9%)、微团聚体(13.1%)、平均质量直径(18.0%)和总孔隙度(5.1%),改善土壤结构[28]。黄河三角洲连续3年种植田菁后发现,土壤水分的初始入渗率和稳定入渗率分别是对照的2.53、2.88倍,表明其对土壤结构具有明显的改善作用[29]。
4.2 提升土壤肥力
松嫩平原连续3年种植田菁后发现地表生物量(不包含田菁)增加了15.2倍,0~20 cm耕层土壤pH值由10.3降到8.3,可溶性盐含量由5.61 g/kg降到3.07 g/kg,有机质含量由20.03 g/kg升至22.21 g/kg,碱解氮含量由85.4 mg/kg升至 96.3 mg/kg[29]。天津滨海地区0~20 cm耕层土壤种植田菁后平均脱盐率高达45.97%,0~80 cm土层土壤脱盐率为10.81%,其脱盐效果优于苜蓿、苏丹草和碱蓬[30]。田菁秸秆不做还田处理的情况下会造成耕层土壤中速效P含量和速效K含量降低。江苏盐城滨海种植田菁和草木樨一个生长季后,土壤速效P含量降幅为2.17%~35.6%,翻压处理后速效P含量和速效K含量逐年回升[31]。上海市郊主要园艺场设施大棚因广泛分布的Ca2+、Mg2+次生盐渍化土壤而造成耕作障碍,利用γ-聚谷氨酸和田菁联合修复后,Ca2+、Mg2+处理效果显著,最大去除率分别达到90.26%和69.92%[32]。
4.3 吸收土壤重金属
土壤中过高含量的重金属能够抑制植株的固氮作用。但毛萼田菁的茎瘤巧妙避免了与重金属土壤的直接接触,从而正常发挥固氮作用。在研究毛萼田菁在铅锌矿尾矿中结瘤、固氮和重金属影响的试验中发现,保留茎瘤与去除茎瘤相比,植株全氮量和氮积累量分别提高了12.4%~34.0%和43.3%~131.4%,对镉、铜、铅、锌4种重金属的积累量逐渐递增,其中根部含量显著高于茎和叶,并随着土壤介质中重金属含量的增加而增加,尾矿土壤中植株铅和锌的含量分别是纯土壤中的3.2、4.8倍[33]。
4.4 改善后茬作物品质抑制杂草生长
在温室内种植甜玉米和田菁并全量还田后,发现后茬茄子果实数量分别较对照提高了23.61%和9.72%,总产量分别提高了24.15%和8.19%。田菁还能有效改善茄子品质,与对照相比,维生素C含量增加32.96%,可溶性糖含量增加10.56%,其效果显著优于高丹草[34]。此外,利用田菁淋溶液和田菁秸秆模拟还田试验发现,田菁可以通过化感作用抑制发育初期的恶性杂草稗草和三叶鬼针草的生长,尤其对稗草的影响最为显著。同时,在田菁的影响下,受体植物所在土壤中微生物数量和土壤酶活性得到显著提升[35]。因此,合理利用田菁不但能够活化土壤,提升土壤肥力,还能提高下茬作物品质,抑制田间杂草生长。
5 田菁的应用前景及展望
在医学领域,刺田菁[Sesbania bispinosa (Jacq.)]種子中含有2.01%的左旋多巴,已证明对帕金森病有效[36-37]。Shivamadhu等的研究表明,田菁叶片中的蛋白水解物可能在止血和伤口愈合过程中发挥作用[38]。在工业方面,田菁胚乳中的田菁胶已经被广泛应用在建筑、陶瓷、纺织、造纸和电池制造等领域中。已有试验表明,田菁胶能够替代目前大量进口的瓜尔胶,有望大幅降低产品成本,提高企业利润[39]。在农业方面,田菁因其结瘤固氮作用,无法消除NO-3型次生盐渍化土壤造成的连作障碍[32]。该问题可以通过田菁与需氮量大的禾本科作物轮作的方式得到解决。该种模式不但能够调节土壤肥力,还能均衡利用土壤养分和防治病、虫、草害,达到增产增收的目的。田菁具有较强的耐逆性,除了其自身相关的响应机制外,植株内部定殖的内生菌和根际微生物均增强了其在不良环境中的生存能力。除了田菁茎瘤固氮根瘤菌ORS571之外,从田菁根际土壤中获得的普沙根瘤菌 (Rhizobium pusense)YIC4105被用来防治有毒物质根皮苷积累引起的苹果幼苗连作障碍,并有望开发为具有促生功能的微生物接种剂和菌肥[40]。另一种从田菁根际土壤中分离得到的菌种N102能够显著提高盐胁迫下的玉米株高、根长、叶绿素含量、植株干质量等相关指标,并且对多种植物具有促生耐盐作用,具有成为盐碱地作物菌肥的潜力[41]。田菁根瘤及其根际土壤中还包含大量的固氮、解磷、解钾等功能性微生物。因此,在农业生产中以提高产量、提升质量、降低农药和化肥施用量、增强耐逆性为目标,以田菁在土壤中招募的特色微生物为基础,筛选出能够定殖于作物、蔬菜、果树根际甚至其内部的有益菌种,研制成菌剂和菌肥具有广阔的市场前景。现有研究成果表明,长喙田菁细胞间感染与根毛感染相比复杂性较低[42],因此,更容易在非豆科植物中实现应用。结合微生物可以通过基因组岛水平转移的特点,未来田菁有可能在功能性微生物应用到非豆科农作物生产过程中发挥重要桥梁作用。此外,田菁已成为研究根毛感染和细胞间感染的新型模式生物,可以在许多方面补充豆类模型的基础研究。未来,随着相关研究的深入,田菁有可能在更多的领域发挥作用。
参考文献:
[1]Capoen W,Oldroyd G,Goormachtig S,et al.Sesbania rostrata:a case study of natural variation in legume nodulation[J]. New Phytologist,2010,186(2):340-345.
[2]Bailey-Serres J,Voesenek L A C J.Flooding stress:acclimations and genetic diversity[J]. Annual Review of Plant Biology,2008,59:313-339.
[3]Ehrhardt D W,Wais R,Long S R.Calcium spiking in plant root hairs responding to Rhizobium nodulation signals[J]. Cell,1996,85(5):673-681.
[4]Capoen W,Goormachtig S,de Rycke R,et al.SrSymRK,a plant receptor essential for symbiosome formation[J]. Proceedings of the National Academy of Sciences of the United States of America,2005,102(29):10369-10374.
[5]Mitra S,Mukherjee A,Wiley-Kalil A,et al.A rhamnose-deficient lipopolysaccharide mutant of Rhizobium sp.IRBG74 is defective in root colonization and beneficial interactions with its flooding-tolerant hosts Sesbania cannabina and wetland rice[J]. Journal of Experimental Botany,2016,67(19):5869-5884.
[6]Bragina T V,Rodionova N A,Grinieva G M.Ethylene production and activation of hydrolytic enzymes during acclimation of maize seedlings to partial flooding[J]. Russian Journal of Plant Physiology,2003,50(6):794-798.
[7]Wisniewski J P,Rathbun E A,Knox J P,et al.Involvement of diamine oxidase and peroxidase in insolubilization of the extracellular matrix:implications for pea nodule initiation by Rhizobium leguminosarum[J]. Molecular Plant-Microbe Interactions,2000,13(4):413-420.
[8]Santos R,Hérouart D,Puppo A,et al.Critical protective role of bacterial superoxide dismutase in Rhizobium-legume symbiosis[J]. Molecular Microbiology,2000,38(4):750-759.
[9]Krishnan H B,Oehrle N W,Alaswad A A,et al.Biochemical and anatomical investigation of Sesbania herbacea (Mill.) McVaugh nodules grown under flooded and non-flooded conditions[J]. International Journal of Molecular Sciences,2019,20(8):1824.
[10]Quelas J I,Mesa S,Mongiardini E J,et al.Regulation of polyhydroxybutyrate synthesis in the soil bacterium Bradyrhizobium diazoefficiens[J]. Applied and Environmental Microbiology,2016,82(14):4299-4308.
[11]Oliveira H C,Freschi L,Sodek L.Nitrogen metabolism and translocation in soybean plants subjected to root oxygen deficiency[J]. Plant Physiology and Biochemistry,2013,66:141-149.
[12]Wang L H,Zhang Y X,Qi X Q,et al.Global gene expression responses to waterlogging in roots of sesame (Sesamum indicum L.)[J]. Acta Physiologiae Plantarum,2012,34(6):2241-2249.
[13]Colmer T D.Aerenchyma and an inducible barrier to radial oxygen loss facilitate root aeration in upland,paddy and deep-water rice (Oryza sativa L.)[J]. Annals of Botany,2002,91(2):301-309.
[14]Ren C G,Kong C C,Yan K,et al.Elucidation of the molecular responses to waterlogging in Sesbania cannabina roots by transcriptome profiling[J]. Scientific Reports,2017,7:9256.
[15]魏秀君,殷云龙,芦治国,等. NaCl胁迫对5种绿化植物幼苗生长和生理指标的影响及耐盐性综合评价[J]. 植物资源与环境学报,2011,20(2):35-42.
[16]Ren C G,Kong C C,Yan K,et al.Transcriptome analysis reveals the impact of arbuscular mycorrhizal symbiosis on Sesbania cannabina expose to high salinity[J]. Scientific Reports,2019,9:2780.
[17]Niyogi K K.PHOTOPROTECTION REVISITED:genetic and molecular approaches[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1999,50(1):333-359.
[18]Ren C G,Kong C C,Xie Z H.Role of abscisic acid in strigolactone-induced salt stress tolerance in arbuscular mycorrhizal Sesbania cannabina seedlings[J]. BMC Plant Biology,2018,18(1):74.
[19]Pandey A,Sharma M,Pandey G K.Emerging roles of strigolactones in plant responses to stress and development[J]. Frontiers in Plant Science,2016,7:434.
[20]楊 媛,姚甜甜,熊海涛,等. 田菁根瘤菌嗜盐α-淀粉酶的基因克隆表达与分子改造[J]. 广西科学,2017,24(2):201-205.
[21]Dreyfus B L,Dommergues Y R.Nitrogen-fixing nodules induced by Rhizobium on the stem of the tropical legume Sesbania rostrata[J]. FEMS Microbiology Letters,1981,10(4):313-317.
[22]Senthilkumar M,Madhaiyan M,Sundaram S P,et al.Induction of endophytic colonization in rice (Oryza sativa L.) tissue culture plants by Azorhizobium caulinodans[J]. Biotechnology Letters,2008,30(8):1477-1487.
[23]李 涛. 柚皮素与菜豆根瘤菌CFN42中基因RHERS01180对田菁根瘤菌共生岛水平转移的影响[D]. 南京:南京农业大学,2017:12-13.
[24]陈永超,齐怀廷,王小晶,等. 田菁茎瘤固氮根瘤菌对小麦叶组织的促生作用研究[J]. 西北植物学报,2016,36(7):1383-1390.
[25]刘华伟,孙 超,杨 呼,等. 田菁茎瘤固氮根瘤菌对小麦种子侵染的促生作用及其在根系内的定殖[J]. 植物营养与肥料学报,2012,18(1):210-217.
[26]吴 萍. 植物诱导田菁根瘤菌共生岛属间水平转移扩大根瘤菌宿主范围的研究[D]. 南京:南京农业大学,2014:42-44.
[27]Qiu L,Li Q A,Zhang J B,et al.Migration of endophytic diazotroph Azorhizobium caulinodans ORS571 inside wheat (Triticum aestivum L) and its effect on microRNAs[J]. Functional & Integrative Genomics,2017,17(2/3):311-319.
[28]谢文军,王济世,靳祥旭,等. 田菁改良重度盐渍化土壤的效果分析[J]. 中国农学通报,2016,32(6):119-123.
[29]侯贺贺,王春堂,王晓迪,等. 黄河三角洲盐碱地生物措施改良效果研究[J]. 中国农村水利水电,2014(7):1-6.
[30]王立艳,潘 洁,肖 辉,等. 种植耐盐植物对滨海盐碱地土壤盐分的影响[J]. 华北农学报,2014,29(5):226-231.
[31]朱小梅,温祝桂,赵宝泉,等. 种植绿肥对滨海盐渍土养分及盐分动态变化的影响[J]. 西南农业学报,2017,8(30):1894-1898.
[32]唐 冬.γ-聚谷氨酸和耐盐植物联合修复设施栽培盐渍化土壤[D]. 重庆:西南大学,2015:8-9.
[33]简曙光,杨中艺. 茎瘤对长喙田菁在铅锌尾矿环境适应中的意义 Ⅱ.茎瘤对长喙田菁固氮和积累重金属的影响[J]. 植物生态学报,2002,26(2):209-215.
[34]胡晓珊. 绿肥对温室土壤性状及后茬茄子产质的影响[D]. 海口:海南大学,2015:45-46.
[35]秦俊豪,温 莹,李君菲,等. 绿肥植物田菁的化感效应及对土壤肥力的影响[J]. 土壤,2015,47(3):524-529.
[36]Gautam B,Vadivel V,Stuetz W,et al.Bioactive compounds extracted from Indian wild legume seeds:antioxidant and type II diabetes-related enzyme inhibition properties[J]. International Journal of Food Sciences and Nutrition,2012,63(2):242-245.
[37]Katzenschlager R,Evans A,Manson A,et al.Mucuna pruriens in Parkinsons disease:a double blind clinical and pharmacological study[J]. Journal of Neurology,Neurosurgery,and Psychiatry,2004,75(12):1672-1677.
[38]Shivamadhu M C,Balaji K S,Jayarama S.Haemostatic property of new cystein protease(s) from Sesbania grandiflora:Its action on fibrinogens[J]. Biocatalysis and Agricultural Biotechnology,2017,12:10-14.
[39]李 睿,贾 鑫,王 晨,等. 田菁胶的改性和应用的研究进展[J]. 中国食物与营养,2019,25(7):52-55,20.
[40]任承钢,李 岩,解志红,等. 根际促生菌及其应用:CN201711374688.X[P]. 2018-04-20.
[41]王艳霞,解志红,张 蕾,等. 田菁根际促生菌的筛选及其促生耐盐效果[J]. 微生物学报,2020,60(5):1023-1035.
[42]Capoen W,Den Herder J,Rombauts S,et al.Comparative transcriptome analysis reveals common and specific tags for root hair and crack-entry invasion in Sesbania rostrata[J]. Plant Physiology,2007,144(4):1878-1889.
