饲草青贮微生物多样性研究进展及对策
2021-12-08字学娟
刘 悦 字学娟* 陈 婷 李 茂
(1.海南大学林学院,儋州 571737;2.中国热带农业科学院热带作物品种资源研究所,儋州 571737)
青贮是一种利用乳酸菌(lactic acid bacteria,LAB)进行发酵,长期保存新鲜青绿饲料作物、牧草等饲草的存贮方式[1]。青贮技术已有3 000多年的历史[2],随着保存技术的不断改进、管理技术的发展以及对发酵过程中微生物种类和作用认识的增强,目前已成为最常用的饲草保存技术。优质青贮饲料具备适口性好、养分含量高、消化率较高等优点,在粗饲料供应不足的冬春季是反刍动物优质饲料的重要来源[3],是动物维持生产性能的重要保障。
青贮饲料发酵过程由微生物参与,原料表面的微生物区系主要由醋酸菌属(Acetobacter)、梭菌属(Clostridium)、腐败菌、霉菌、酵母菌和LAB等构成。LAB起主导作用,主要通过以下2个途径实现:一是利用可溶性碳水化合物产生乳酸来降低pH;二是LAB与不良微生物竞争营养物质,还可以产生细菌素等具有抑菌活性的代谢产物,来抑制其生长[4]。据报道,每克青贮原料中LAB数量必须在105个以上才能保证青贮质量,然而自然条件下,青贮原料表面附着的好氧细菌数量要远远高于LAB数量[5],因此青贮调制时需通过使用添加剂来直接或间接增加LAB数量,从而保证青贮发酵品质。
从本质上来讲,饲草表面微生物区系影响青贮细菌群落的演替,进而影响了发酵产物。而由于饲草表面微生物特性存在差异,从而使发酵过程多样化。例如由于地理和气候因素,不同地区的饲草微生物多样性存在明显差异;由于植物对外界环境差异的适应性,当植物种类不同或是植物种类相同地区不同时,其表面附着的微生物群落都大不相同。因此,对饲草表面微生物和青贮发酵过程中微生物多样性的变化进行研究,从青贮微生态系统的角度调控青贮发酵品质具有重要的研究和实践价值。近年来,国内外研究人员将青贮微生物群落作为关注的重点,开展了大量研究。本文试图就饲草青贮微生物多样性研究进行阶段总结,以期为基于青贮微生物群落的青贮发酵品质调控提供科学依据。
1 青贮过程中微生物的演替
许多细菌在饲草表面可以存活,但在选择性培养基上不能培养,因此对其认知可能存在偏差。随着高通量测序技术的发展和应用,使我们得以认识发酵过程中微生物群的组成和动态[6]。在起始阶段,大肠杆菌(Escherichiacoli)大量繁殖,好氧细菌在前几小时活跃,直到氧气被消耗殆尽,LAB逐渐代替大肠杆菌,接着乳球菌属(Lactococcus)开始大量繁殖,发酵体系pH随之下降,从而抑制了酵母菌、霉菌及好氧细菌繁殖,随着发酵进行,发酵体系pH进一步降低,更耐酸的乳杆菌属(Lactobacillus)大量繁殖并主导发酵过程[7-8]。最后是有氧腐败阶段(二次发酵),由于空气的进入,使得青贮饲料的pH、温度升高,促使霉菌、梭菌及其他好氧菌生长繁殖,从而影响青贮品质。青贮发酵过程中常见的微生物见表1。通常为了加快发酵进程、促进乳酸发酵,青贮添加剂被广泛使用[3]。
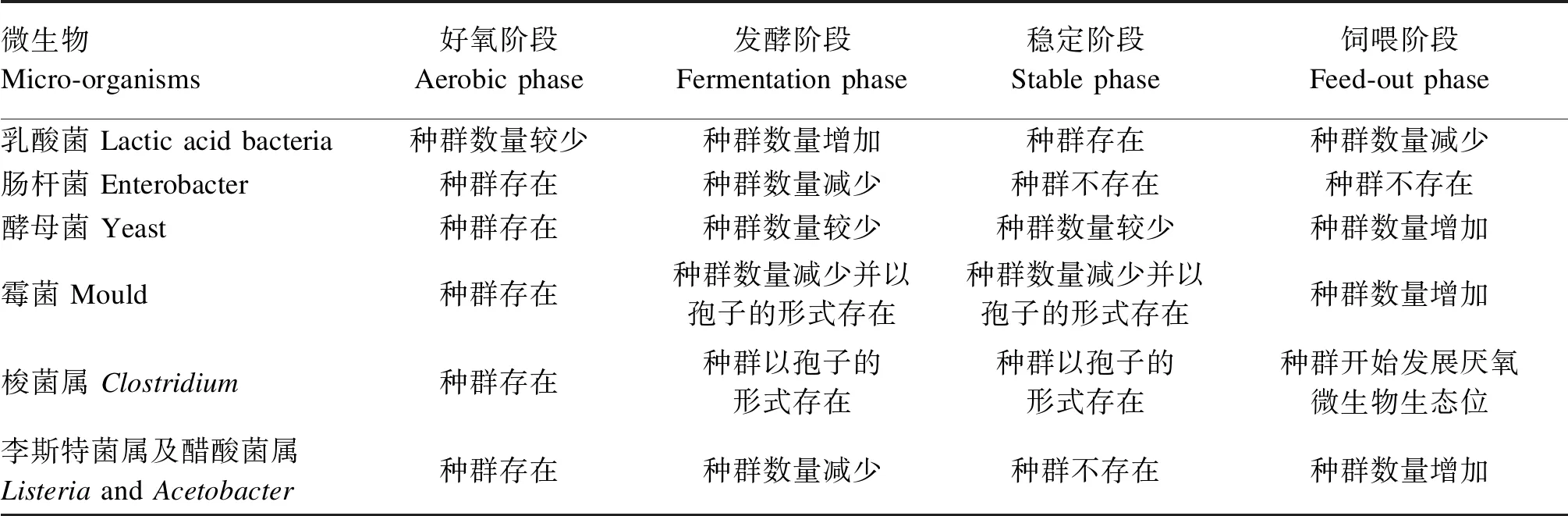
表1 青贮发酵过程中常见的微生物Table 1 Normally micro-organisms in silage fermentation process[9]
2 饲草青贮微生物多样性
2.1 不同区域饲草青贮微生物多样性差异
由于地理、气候条件的差异,使得饲草本身附着微生物群落结构有着极大的不同。因此青贮发酵体系中微生物群落的动态变化也各不相同。
青藏高原极端而独特的生态环境及其在局部地区的变化可能导致牧草附生微生物适应性进化并产生多样性,低海拔地区青贮中LAB包括戊糖片球菌(Pediococcuspentosaceus)、肠系膜明串珠菌(Leuconostocmesenteroides)和棒状乳酸菌(Lactobacilluscoryniformis),而高海拔地区LAB则包括肠系膜乳杆菌(Lactobacillusmesenteroides)和短乳杆菌(Lactobacillusbrevis)[10]。在青藏高原优势物种垂穗披碱草(Elymusnutans)青贮饲料中的LAB主要包括6个属,分别为肠球菌属(Enterococcus)、乳杆菌属、片球菌属(Pediococcus)、明串珠属(Leuconostoc)、魏斯氏菌属(Weissella)和乳球菌属[11];而热带气候条件下的青贮饲料乙酸发酵能力较强,主要微生物可能由乳杆菌属和肠杆菌属(Enterobacter)组成,而研究人员已证实这2种微生物是热带青贮饲料中最可能的优势菌属[12-13]。
在我国的其他地区也有相关研究报道,且乳杆菌属在大多数情况下为优势菌群。如在北方地区采集的47个玉米(ZeamaysL.)青贮样品中择优选择33个样品,丰富度在属水平排序依次为乳杆菌属和醋酸菌属[14]。在内蒙古自治区,卢强等[15]发现,苜蓿青贮不含添加剂的时候,除乳杆菌属外,肠球菌属、乳球菌属也起主要作用。且随着青贮发酵的发展,不同时期LAB的种类和丰度不同[15]。任海伟等[16]研究表明,甘肃白酒糟或菊芋渣混合发酵时优势菌也为乳杆菌属。刘蓓一等[17]在江苏的相关研究表明,乳杆菌属是大麦(HordeumvulgareL.)青贮的优势菌属,有氧暴露增加了有害菌不动杆菌属(Acinetobacter)、沙雷氏菌属(Serratia)的相对丰度。梁辛等[18]在广西南宁的研究发现,在甘蔗梢自然青贮初期以乳杆菌属、葡萄球菌属(Staphylococcus)、鞘氨醇单胞菌属(Sphingomonas)、甲基杆菌属(Methylobacterium)、根瘤菌属(Rhizobium)为主,发酵后期乳杆菌属占据绝对优势。但乳杆菌属并非在所有饲草中都占据优势地位,Li等[19]发现热带牧草柱花草青贮中优势菌群为魏斯氏菌属、肠杆菌属和泛菌属(Pantoea)。另外,有报道三江源试验区燕麦及其组合饲草的叶部优势菌群也以肠杆菌属、泛菌属、假单胞菌属(Pseudomonas)及欧文氏菌属(Erwinia)为主,筛选得到的优良菌株为肠杆菌属的屎肠球菌(Enterococcusfaecium)[20]。
2.2 不同青贮原料青贮微生物多样性差异
通常情况下,植物表面主要附着的细菌是好氧细菌,真菌是酵母菌和霉菌,对青贮发酵有利的LAB数量较少[21]。植物表面微环境如湿度、太阳辐射强度、植物表面结构以及营养元素分布等会影响附着微生物的构成。
2.2.1 不同牧草
一般来说,牧草表面附着的酵母菌数量为1~7 lg(CFU/g)FM,LAB数量为1~7 lg(CFU/g)FM,霉菌数量为1~6 lg(CFU/g)FM,有很大的变化范围[22-26]。因种类、生长环境和生育期的不同而异。禾本科牧草上不仅附着LAB数量少,且不良微生物数量较多。例如青贮前虉草(PhalarisarundinaceaL.)上附着的LAB数量较少[1.4~1.8 lg(CFU/g)FM],有大量的不良微生物,包括需氧细菌[4.6~5.9 lg(CFU/g)FM]、酵母菌[5.2~5.7 lg(CFU/g)FM]和霉菌[3.8~4.8 lg(CFU/g)FM][24];而在典型的木本饲草辣木(Moringaoleifera)和团花树(Neolamarckiacadamba)之中,研究人员发现青贮前蓝细菌(Cyanobacterium)占优势[24]。
2.2.2 同种牧草不同环境
苜蓿是一种豆科牧草,栽培面积大且营养丰富。马召稳[27]发现苜蓿的青贮微生物群落中海洋杆菌属(Oceanobacillus)、乳杆菌属和芽孢杆菌属(Bacillis)为优势菌属。与之不同的是,Ridwan等[28]发现苜蓿青贮生物群落优势菌为植物乳杆菌(Lactobacillusplantarum)、干酪乳杆菌、短乳杆菌、乳酸乳球菌(Lactococcuslactis)、黄杆菌(Flavobacterium)。造成这种差异的原因可能是地理位置的不同导致植物表面小气候不同,影响了微生物区系,也可能是因为品种的不同。另外,由于青贮是一个动态的过程,自然新鲜的牧草表面附着微生物在组成和数量上都与青贮期间及完成之后差异明显,而且附着的LAB数量在萎蔫过程中会增加一些[29],但有研究表明,苜蓿萎蔫过程没有改变LAB数量,但影响了多样性,植物乳杆菌是未萎蔫青贮和萎蔫青贮中的优势菌种[12]。
2.3 不同青贮添加剂对青贮微生物多样性的影响
牧草表面的LAB以异型发酵菌为主,其数量无法达到优质青贮LAB数量的最低标准(105CFU/g FM)[30],因此使用青贮添加剂来直接或间接增加LAB数量成为近几十年来饲草保存中研究最广泛的方向之一,其本质是通过调控微生物区系来改善饲草青贮发酵品质及营养特性。
2.3.1 LAB接种剂
长期以来,LAB作为青贮饲料接种剂,可与牧草附着的有害菌竞争营养物质并产生乳酸、乙酸及细菌素等代谢物质,抑制有害菌的活动与繁殖,有效地改善发酵品质、保存营养、避免腐败[31]。因此,接种外源LAB后会抑制牧草本身附着的不利于青贮发酵的真菌及好氧细菌,抑制效果与牧草本身附着菌的特性及青贮条件有关。
有报道燕麦青贮接种耐低温LAB增加了乳杆菌属的相对丰度,并抑制了不良微生物梭菌的生长,更好地保存了高水分燕麦青贮的养分[32]。大麦青贮饲料接种微生物菌剂也有类似的效果,不良细菌不动杆菌属和普罗威登菌属(Providencia)等以及酵母菌中的伊萨酵母属(Issatchenkia)和哈萨克斯坦酵母(Kazachstania)都受到抑制[33]。在苋菜(AmaranthusspinosusL.)和稻草(OryzasativaL.)混合青贮中加入植物乳杆菌,使LAB的相对丰度增加,肠杆菌科的相对丰度降低[34];在绿麦和燕麦青贮的研究中发现,随着青贮发酵的进行,早期优势菌群肠球菌的地位在发酵后期被添加剂中的植物乳杆菌所替代,这有利于在青贮中后期建立稳定的LAB群落,长期保存青贮饲料[35]。抗菌肽具有有益于消化吸收的氨基酸成分,因此可作为一种替代抗生素的新型青贮饲料添加剂,以减少其对动物造成的危害。抗菌肽产生菌可作为调控牧草青贮发酵的新型添加剂[36],有报道在苜蓿中添加产抗菌肽枯草芽孢杆菌(Bacillussubtilis),发酵后提高了LAB的相对丰度,降低了肠球菌的相对丰度,改善青贮发酵品质并改变了青贮期间和好氧暴露后的细菌群落[37]。环境因素会对外源菌群产生一定的影响,添加剂和较低的室内环境温度组合可以有效提高辣木叶青贮质量[38]。
芦苇金丝雀草(PhalarisarundinaceaL.)接种布氏乳杆菌青贮后降低细菌α多样性指数,改变青贮饲料中细菌群落的组成,但对青贮发酵和细菌群落组成的影响有限,说明LAB接种剂的效果存在差异[39]。虉草青贮饲料接种植物乳杆菌和布氏乳杆菌后细菌多样性显著下降,细菌组成发生改变,但乳杆菌属的相对丰度并未受到影响,同样也表明接种LAB影响有限[40]。
2.3.2 牧草附生微生物区系的移植
粪菌移植(fecal microbiota transplantation,FMT)是指健康供体粪便的微生物群落被整体转移到受体体内的过程。因而受体可获得有益细菌,改变肠道菌群组成[41]。其应用较为广泛,最近的研究发现移植健康成年猪的粪便微生物群落可以明显改变受体仔猪回肠中的菌群结构,增加结肠菌群的α多样性。FMT组仔猪回肠中乳杆菌属的相对丰度减少,棒状杆菌属(Corynebacterium)等的相对丰度增加。这说明早期FMT能够调节肠道菌群的组成[42]。而将健康牛犊的粪菌移植到腹泻的牛犊中,可以缓解腹泻,并具有恢复其肠道微生物组成的能力[43]。
在改善青贮饲料微生物区系方面,菌群移植也可发挥正面作用。移植青贮玉米和本地红三叶草附生菌群均有利于红三叶草青贮发酵品质和微生物群落结构的改善,因此,移植并重建饲草附生微生物区系是一种有效、环保的青贮方法[44]。用蒸馏水和苏丹草(Sorghumsudanense)、饲用高粱(Sorghumbicolor)、象草(Pennisetumpurpureum)和全株玉米(ZeamaysL.)4种牧草附着微生物对灭菌苏丹草进行青贮,结果表明饲料高粱的附生菌群对苏丹草青贮的微生物群落和发酵特性有积极影响[23]。
2.3.3 混合青贮
混合青贮是指2种及以上青贮原料混合后制作的青贮饲料。混合青贮的营养成分含量丰富,有利于LAB生长繁殖,可以更好地保存青贮饲料营养价值[45-48]。
添加富含可溶性碳水化合物(water soluble carbohydrates,WSC)的多年生黑麦草可以降低富含蛋白质的构树青贮的pH和附生微生物数量,对细菌群落有显著影响,有益微生物如乳杆菌和魏斯氏菌在整个青贮时间内占主导地位,肠杆菌的数量显著减少。Spearman秩相关分析表明,构树青贮乳酸含量与乳杆菌和嗜麦芽寡养单胞菌(Stenotrophomonas)的相对丰度呈正相关,而氨态氮(NH3-N)含量与肠杆菌的相对丰度呈正相关[45]。混合玉米秸秆增加了启封时乳杆菌的相对丰度(12.96%~50.82%)和暴露于空气后伊萨酵母属的相对丰度(2.02%~36.03%),且一定程度上提高了有氧稳定性。研究表明,混合调制玉米秸秆可以改善稻草青贮饲料的发酵品质和营养成分[46]。Wang等[47]在华北平原进行了类似的研究,玉米与苜蓿混合,随着玉米比例从0增加到40%,理想LAB的相对丰度增加,不良根瘤菌和甲基菌数量减少,并使菌群向更便于青贮饲料保存的方向转移。使用发酵全混合日粮(fermentation total mixed ration,FTMR)是一种很有前途的保存饲料的方法,但发酵过程中的变化以及与FTMR菌群的联系尚不完全清楚。添加22%燕麦青贮(oat silage,OS)的FTMR,发酵质量显著提高,表现为丁酸浓度降低,乳酸/乙酸降低,LAB数量增加,腐败酵母死亡速度加快;添加11%和22% OS后,出现了更多的异型发酵LAB,如布氏乳杆菌、短乳杆菌和魏氏乳杆菌;此外,添加22%的OS导致细菌相对丰度和多样性显著增加,以乳杆菌属复合物为主。在LAB复合体的物种中,棒状乳杆菌数量与乳酸、粗蛋白质和氨态氮含量呈正相关,表明其在改变发酵结构方面的潜在作用[48]。
2.3.4 酶接种剂
除了细菌接种剂,酶如纤维素酶(cellulase,CE)、半纤维素酶、果胶酶和淀粉酶等也常常添加在青贮饲料中,尤其是CE的应用最为广泛。单独使用CE和半乳糖苷酶(galactosidase,GA)以及与植物乳杆菌组合使用的处理大大增加了苜蓿青贮中乳杆菌属的相对丰度[49];CE和木聚糖酶用于甜高梁的青贮,可促进乳酸发酵,降低pH和微生物多样性,抑制不良微生物,保证青贮质量[50]。在豆渣与玉米秸秆混合青贮中加入LAB、CE和LAB+CE,发现其细菌组成与对照组差异显著,其中LAB +CE组乳杆菌属数量显著高于其他组,不良菌数量显著低于其他组[51]。当植物乳杆菌和/或CE对高水分苋菜、稻秸混合青贮时,添加剂提高了乳杆菌属的相对丰度,降低了魏斯氏菌属、片球菌属、乳球菌的相对丰度。综合来看,以植物乳杆菌和纤维素酶混合处理青贮品质最好[52]。
2.3.5 有机酸
青贮饲料厌氧发酵过程中可产生乳酸、乙酸等有机酸,抑制腐败相关细菌和真菌的生长,并有效保存青贮营养物质[3],但有机酸作为青贮添加剂对青贮微生物的影响报道较少。有研究比较了一年生黑麦草和苜蓿青贮中添加LAB接种剂(LABi,106CFU/g)和甲酸(FA,3 mL/kg)的效果,结果发现2种添加剂均能降低其微生物多样性,提高青贮品质[53];He等[46]研究发现,丙酸的加入可以抑制辣木叶青贮和暴露在空气中的微生物群落和脱酰胺活性。柠檬酸(citric acid,CA)是一种食品添加剂,添加CA可以提高砂仁叶片青贮饲料中LAB、片球菌和乳杆菌的相对丰度,降低大肠埃氏菌属-志贺氏菌属、肠杆菌属和泛菌属等不良微生物的相对丰度[54];在对王草(king grass,KG)的研究中发现,植物乳杆菌和CA处理使KG青贮细菌多样性降低,乳杆菌属的相对丰度增加,不良菌属假单胞菌属的相对丰度降低,进而提高发酵品质[55];在青贮木薯叶(cassava foliage,CF)中添加CA、苹果酸(malic acid,MA)及其与植物乳杆菌混合添加,发现青贮饲料品质改善,微生物群落中类芽孢杆菌(平均27.81%)和芽孢杆菌含量(平均16.04%)提高,说明CA和MA可提高CF青贮品质,且与植物乳杆菌组合效果更佳[56]。没食子酸(gallic acid,GA)可以作为一种绿色添加剂,在桑叶和柱花草(Stylosanthesguianensis)青贮饲料中添加GA,梭菌属和肠杆菌属的相对丰度降低,乳酸杆菌属的相对丰度增加[57];另外还发现GA提高了辣木叶的青贮品质、氨肽酶活性和抗氧化能力,其青贮微生物组成也随之发生变化[58]。单宁酸(tannic acid,TA)是一种广泛存在于植物中的多酚,具有抗菌特性和与蛋白质结合的能力,在桑叶和柱花草青贮中添加不同比例TA,均改善了桑叶和柱花草青贮的品质,增加了魏斯氏菌属、不动杆菌属的相对丰度,降低了梭菌属的相对丰度,其中以2% TA为适宜的添加浓度[59];在团花树树叶(Neolamarckiacadambaleaf,NCL;富含TA)单独青贮或添加聚乙二醇(单宁失活剂)青贮的研究中发现,添加聚乙二醇处理优势微生物群落为乳杆菌属取代。这表明添加聚乙二醇使该原料本身的单宁失活,促进了青贮饲料的乳酸发酵并抑制蛋白质降解[60]。
3 小结与展望
无论是饲草本身附着的还是外源添加的微生物,其组成和数量都决定着发酵过程中的青贮微生物群落结构和演替,进而影响青贮发酵品质。不同区域的环境因素、饲草种类以及青贮添加剂类型都不同程度地影响着饲草青贮微生物多样性。目前的研究集中在常规青贮添加剂产生的影响,未来应更多的研究新型绿色添加剂,如具有活性成分的植物提取物、具有抑菌活性的代谢产物以及乡土益生微生物资源及其组合利用。另外,青贮研究手段随着三代测序、代谢组、宏基因组和宏转录组等技术的成熟与应用,在种水平鉴定优良青贮微生物,通过差异代谢物、差异基因表达、功能基因和代谢调控网络的构建等,阐明微生物在青贮发酵中的作用及其对青贮添加剂的响应机制,为青贮发酵品质的调控、新型青贮添加剂的研发提供科学依据。
