烟酰胺腺嘌呤二核苷酸代谢介导动物肠道免疫功能机理的研究进展
2021-12-08黄艳娜蒋宗勇易宏波
甄 锐 黄艳娜 蒋宗勇 易宏波*
(1.广东省农业科学院动物科学研究所,畜禽育种国家重点实验室,农业农村部华南动物营养与饲料重点实验室,广东省畜禽育种与营养研究重点实验室,广州 510640;2.广西大学动物科学技术学院,南宁 530004)
烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)也称辅酶Ⅰ,是连接呼吸链和三羧酸循环的关键辅酶,可作为电子载体将H+传递至黄素蛋白参与糖异生、糖酵解和三羧酸循环等能量代谢过程。NAD不仅在能量代谢中发挥关键作用,还可以向细胞提供信号参与炎症、衰老、肿瘤等病理过程,其代谢异常会引起动物肌营养不良、神经衰弱、糖尿病等疾病[1-4]。近年研究发现,NAD代谢与动物肠道免疫功能密切相关,NAD代谢可调控巨噬细胞极化分型、蛋白质乙酰化修饰及肠道菌群[5-6]。动物肠道NAD代谢紊乱引起NAD消耗酶活性显著下降,造成肠细胞功能代谢障碍,导致动物肠道免疫稳态失衡。然而,有关NAD代谢对畜禽肠道免疫功能的研究鲜有报道。因此,借鉴NAD在人体疾病以及小鼠等动物模型中的应用,本文阐述了NAD代谢介导动物肠道免疫功能的可能机制,为其合理应用于畜禽生产实践提供理论依据。
1 NAD体内分布及其代谢途径
NAD在动物体内含量丰富,其浓度可能以隔室特异性的方式调节且受细胞类型、应激、个体年龄等因素的影响,进而调节氧化还原功能以及NAD消耗酶[7-10]。尽管NAD半衰期短且其浓度不断变化,但细胞内NAD浓度在健康状态下保持相对稳定[11]。NAD在体内器官组织中的浓度高低顺序为肝脏、肾脏、胰腺、心脏、脑、脾脏、小肠、骨骼肌、肺脏、白色脂肪,其中肝脏、肾脏中NAD浓度可达500 μmol/L以上[12]。
NAD的代谢途径如图1所示,其合成途径主要有3种:从头合成途径、补救合成途径和Preiss-Handler途径[13]。3种合成途径都是由NAD的前体物质进入细胞后再合成NAD参与细胞内的代谢反应。NAD从头合成途径通过犬尿氨酸途径将色氨酸(tryptophan,Trp)转化为喹啉酸(quinolinic acid,QA),随后通过喹啉酸酯磷酸核糖基转移酶(quinolinate phosphoribosyl transferase,QPRT)将其转化为烟酸单核苷酸(nicotinic acid mononucleotide,NAMN);Preiss-Handler途径利用犬尿氨酸途径来源的NAMN或饮食来源的烟酸通过相关酶促反应合成NAD;NAD补救合成途径是炎症状态下维持NAD浓度的主要合成途径,主要经烟酰胺磷酸核糖基转移酶(nicotinamide phosphoribosyl transferase,NAMPT)将烟酰胺(nicotinamide,NAM)转化为烟酰胺单核苷酸 (nicotinamide mononucleotide,NMN),再转化为NAD。
NAD消耗途径主要经多聚ADP核糖聚合酶(PARPs)、环状ADP-核糖合成酶(cADPRs)、sirtuins(SIRTs)3种以NAD为唯一底物的酶促反应消耗,从而产生NAM和以ADP核糖作为主要结构的其他代谢产物[14]。这些消耗途径主要与细胞增殖、凋亡、能量代谢及免疫等相关。
2 NAD代谢对动物肠道免疫功能的作用
NAD代谢能够调节动物肠道免疫功能,在维持机体免疫稳态中发挥重要作用。外源添加NAD可促进肠道黏液层黏蛋白2(MUC2)分泌,增强抗菌感染能力[15]。NAD改善脂多糖(LPS)诱导的小鼠肠道屏障损伤,通过抑制核转录因子-κB(NF-κB)缓解肠道炎症[16]。研究发现,阻断NAD合成会抑制PARPs和SIRTs的活性进而使单核细胞数量下降,肠黏膜免疫功能降低[17]。以上研究提示,NAD代谢对维持动物肠道黏膜免疫功能至关重要。同时,NAD的前体物质[NMN、烟酰胺核糖(NR)、烟酸、色氨酸等]具有抗炎作用。NMN减少小鼠骨骼肌中肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)表达[3],NR可以有效抑制自身免疫病小鼠的炎症[4],外源补充NR可通过NAD途径缓解小鼠肠炎[5]。研究表明,烟酸能够抑制LPS诱导巨噬细胞分泌TNF-α、IL-6、白细胞介素-8(IL-8)和一氧化氮(NO)等炎性因子[18]。色氨酸可通过芳香烃受体(AHR)维持肠道菌群平衡和调节肠道免疫[19]。此外,NAD的代谢产物(NAM等)也具有调控肠道免疫的功能。食物中添加NAM显著提高小肠上皮细胞抗菌肽的表达,缓解色氨酸缺乏或者血管紧张素转化酶2(ACE2)敲除小鼠肠道炎症和腹泻[20]。NAM具有抗结核分枝杆菌的作用,减弱中性粒细胞活性,能够有效缓解炎症[21-22]。人平均每天摄入色氨酸、烟酸、NAM、NR等NAD的前体物质20 mg可满足对NAD合成的基本需求,但促进NAD合成有助于提高肠道免疫功能[23]。因此,各种NAD的前体物质在动物中的合理应用至关重要。目前研究认为NR是最佳的NAD补充剂之一,与其他补充剂相比,NR具有更高的生物利用度和生物安全性[23-24]。但糖苷键的不稳定性使其合成成本较高,从而对其在动物生产中的广泛应用造成阻碍[25]。总而言之,NAD代谢在维持动物肠道免疫功能中发挥着重要作用,深入研究其作用机制以及改善NAD补充剂的生产工艺对于保障动物肠道健康具有重要的科学意义。
3 NAD代谢调控肠道免疫功能的可能机制
肠道免疫稳态由肠道菌群、免疫细胞、细胞因子等共同调控。组蛋白乙酰化在细胞炎症因子、抗菌肽等因子转录调控中发挥关键作用[26],而巨噬细胞是肠道抵抗细菌感染的重要免疫细胞。最近研究表明,NAD代谢调控动物肠道免疫稳态的作用机制可能与组蛋白乙酰化修饰、巨噬细胞M1/M2分型及其与肠道菌群互作相关[5-6]。
3.1 NAD代谢调控组蛋白乙酰化修饰
组蛋白是染色质重复单元核小体的重要组成部分[27],其乙酰化状态由组蛋白乙酰基转移酶(HATs)和组蛋白去乙酰化酶(HDACs)共同控制。目前哺乳动物中已发现18种HDACs,其中7种为NAD依赖性的SIRTs(去乙酰化酶)[28]。NAD/还原型烟酰胺腺嘌呤二核苷酸(NADH)比值变化与SIRTs的活性呈正相关,在炎症过程中发挥调控能量代谢和免疫功能的关键作用。研究表明,NAD浓度降低会抑制SIRT1活性,而补充NAD前体物质可提高NAD浓度,进而恢复SIRT1活性[3]。在炎症状态下,增加NAD的合成可激活SIRT1,进而调控核糖体S6激酶1(S6K1)去乙酰化,促进肠道干细胞更新,改善肠道黏膜屏障损伤修复[29]。激活的SIRT1也可通过调控p65蛋白去乙酰化抑制NF-κB转录,抑制炎症反应[30]。但在脓毒症等严重应激状态下,持续的NAD生成及SIRT1激活会使炎症过度反应乃至无法消退,抑制NAD合成可降低SIRT1活性,进而缓解过度炎症反应[31]。SIRT1可以促进免疫细胞的脂肪酸氧化和糖酵解反应,为机体免疫反应提供主要能量来源[32]。此外,SIRTs与HDACs在调控细胞免疫反应中存在交互作用,共同调控许多细胞和线粒体过程[33-34]。因此,NAD代谢可能通过SIRTs等去乙酰酶调节组蛋白乙酰化修饰,从而调控动物肠道免疫动态变化。
3.2 NAD代谢调控巨噬细胞极化分型
巨噬细胞是肠道抵抗细菌感染的重要免疫细胞。巨噬细胞可根据外部环境和刺激物的不同极化为2种表型:促炎M1型和抗炎M2型。M1型巨噬细胞具有较高的吞噬活性和抗原呈递能力,主要通过Th1型免疫途径介导急性炎症反应,清除胞内病原体。M2型巨噬细胞可促进CD4细胞向Th2型分化,诱导产生抑炎因子。2种不同极化巨噬细胞能够相互转化,发挥吞噬清除、加工提呈等免疫调节功能[35-36]。研究发现,NAD在维持巨噬细胞的抗炎M2型中起到关键作用。若巨噬细胞内的NAD浓度因炎症反应消耗而降低,则进入线粒体呼吸链反应的NAD浓度下降,引起线粒体跨内膜的质子梯度差降低,导致电子传递链复合物Ⅰ活性降低,加剧炎症反应[37]。然而,剧烈的炎症反应导致NAD被进一步大量消耗后会诱导抗炎M2型巨噬细胞转变为促炎M1型巨噬细胞,通过刺激NAMPT促进补救合成途径以维持NAD浓度,并使甘油醛-3-磷酸脱氢酶(GAPDH)活性升高,进一步加剧炎症反应(图2)[5]。过度炎症刺激可上调SIRT1和SIRT6的表达,进而诱导M2型巨噬细胞和单核细胞的代谢类型从糖酵解转变为脂肪酸氧化,从而缓解过度炎症反应[31]。研究揭示,NAD消耗严重时易引起能量崩溃,会激活丝氨酸-苏氨酸激酶3(RIPK3),活化后的RIPK3与凋亡抑制相关蛋白B细胞淋巴瘤-XL(Bcl-XL)形成复合物,从而特异性阻断半胱天冬酶介导的细胞凋亡;同时,RIPK3可促进混合谱系激酶结构域样蛋白(MLKL)磷酸化,进而引发巨噬细胞坏死[38]。然而,长期营养调控NAD代谢介导巨噬细胞极化分型,可能会引起慢性炎症,故外源添加NAD补充剂应避免长期过量使用。因此,NAD的正常代谢可避免巨噬细胞能量崩溃,对诱导巨噬细胞极化分型至关重要。
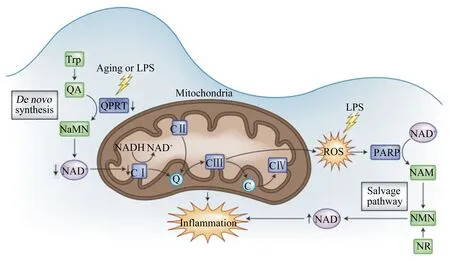
CⅠ/Ⅱ/Ⅲ/Ⅳ:电子传递链复合体Ⅰ/Ⅱ/Ⅲ/Ⅳ electron-transport chain complex Ⅰ/Ⅱ/Ⅲ/Ⅳ;Q:辅酶Q coenzyme Q;C:细胞色素C cytochrome C;Trp:色氨酸 tryptophan;QA:喹啉酸 quinolinic acid;QPRT:喹啉酸核糖转移酶 quinolate phosphoribosyltransferase;NaMN:烟酸单核苷酸 nicotinic acid mononucleotide;NAD:烟酰胺腺嘌呤二核苷酸 nicotinamide adenine dinucleotide;NADH:还原态烟酰胺腺嘌呤二核苷酸 reduced nicotinamide adenine dinucleotide;NAM:烟酰胺 nicotinamide;NMN:烟酰胺单核苷酸 nicotinamide mononucleotide;NR:烟酰胺核苷 nicotinamide riboside;PARP:多聚ADP核糖聚合酶 poly (ADP ribose)polymerase;ROS:活性氧 reactive oxygen species;Aging:衰老;LPS:脂多糖 lipopolysaccharide;Inflammation:炎症反应;Mitochodria:线粒体。图2 NAD合成途径调控免疫功能Fig.2 NAD synthetic pathways regulate immunity[5]
3.3 NAD代谢与肠道菌群互作
NAD代谢与肠道菌群存在互作,肠道菌群能够通过激活肠上皮细胞受体和去酰胺化等途径促进动物宿主体内NAD代谢。最新研究表明,外源补充的NAD前体物质(NAM或NR)主要经肠道菌群依赖性的去酰胺化途径促进宿主体内NAD合成;肠道菌群中的支原体可通过微生物烟酰胺酶(PncA)将肠道中的NAM或NR转化为烟酸,再激活经肠上皮细胞作用的去酰胺化途径促进烟酸转化为NAD;此外,肠道菌群还可通过PncA提高肠上皮细胞对NAMPT抑制剂的耐受性,进而加快NAD补救合成途径限速步骤的反应速率,促进NAD的合成[6]。肠道菌群分泌的吲哚类、吩嗪、萘醌邻苯二酚等产物可激活芳香烃受体(AHR),而AHR通过调节NAD代谢来调控SIRT1、SIRT3和SIRT6的活性,进而调控脂质代谢和肠道免疫功能[39]。反之,NAD代谢也会影响动物肠道菌群的组成。SIRT1的缺失会导致肠道乳杆菌数量减少,而添加SIRT1激动剂——白藜芦醇可增加结肠炎疾病模型中的乳杆菌数量[40],提示NAD代谢有可能通过SIRTs调控肠道乳杆菌等介导肠道炎症。同时,NAD代谢可以通过影响肠道菌群代谢产物调控肠道免疫功能。胆汁酸受体(FXR)表达主要受SIRT1去乙酰化调控,肠上皮细胞SIRT1的缺失会抑制肝细胞核因子1α(HNF1α)/FXR信号通路,减少回肠胆汁酸的吸收,引起肠道胆汁酸总量上升,从而导致肠道功能紊乱继发慢性肠道炎症[41]。以上研究表明,NAD代谢可通过SIRTs调控胆汁酸等途径影响肠道菌群的数量和丰度,肠道菌群通过去酰胺化等途径调节NAD代谢,这两者间的互作可能是影响肠道免疫稳态的重要因素。
4 小 结
综上所述,NAD参与多种生物氧化过程,通过其合成途径(从头合成、补救合成和Preiss-Handler)和消耗途径(PARPs、cADPRs、SIRTs等)维持体内代谢稳态。NAD代谢可能通过去乙酰酶SIRTs介导组蛋白乙酰化、诱导巨噬细胞极化分型以及与肠道菌群互作,进而调控动物肠道免疫动态变化。因此,NAD代谢可能是介导动物肠道免疫动态变化的重要因素,在维持动物健康方面具有重要意义(图3)。然而,在畜禽上有关NAD代谢及其对肠道免疫功能的研究较少,且NAD补充剂、剂量及途径等尚未清楚。为了使NAD补充剂更有效地应用于畜禽生产,后续研究可重点关注以下几个方面:1)NAD及其补充剂在畜禽的代谢周转规律;2)畜禽NAD代谢与肠道微生物的互作机理;3)NAD代谢介导畜禽肠黏膜免疫动态变化的机制。
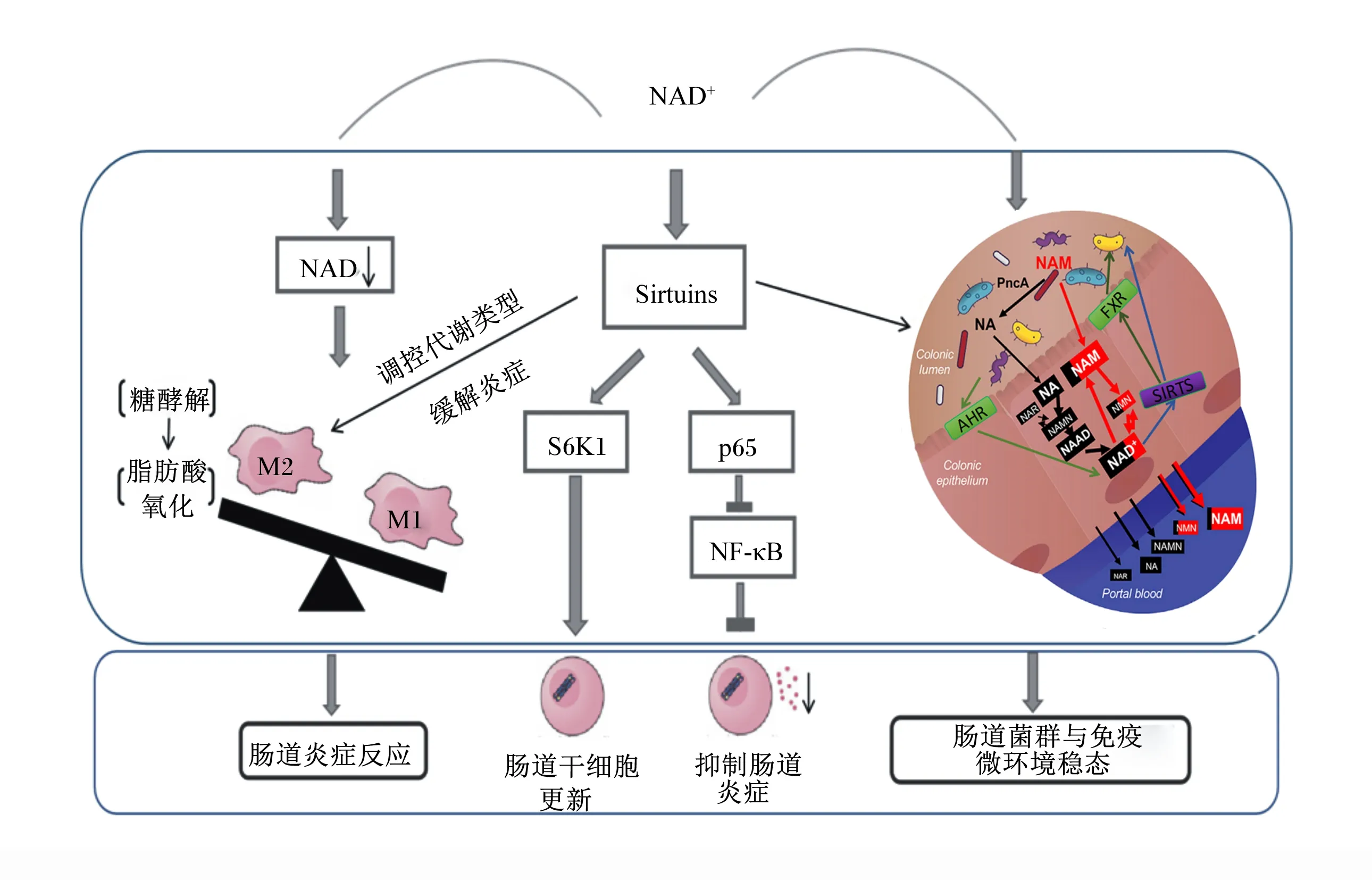
M1:M1型巨噬细胞 M1-like macrophages;M2:M2型巨噬细胞 M2-like macrophages;NA:烟酸 nicotinic acid;NAMN:烟酸单核苷酸 nicotinic acid mononucleotide;NAAD:烟酸腺嘌呤二核苷酸 nicotinic acid adenine dinucleotide;NAD:烟酰胺腺嘌呤二核苷酸 nicotinamide adenine dinucleotide;NAM:烟酰胺 nicotinamide;NMN:烟酰胺单核苷酸 nicotinamide mononucleotide;NAR:烟酸核苷 nicotinic acid riboside;SIRTs:去乙酰化酶 sirtuins;S6K1:核糖体S6激酶1 ribosomal protein S6 kinase 1;NF-κB:核转录因子-κB nuclear factor-κB;PncA:微生物烟酰胺酶 microbial nicotinamidase;AHR:芳香烃受体 aromatic hydrocarbon receptor;FXR:法尼醇X受体/胆汁酸受体 farnesoid X receptor;Colonic lumen:结肠腔;Colonic epithelium:结肠上皮细胞;Portal blood:门静脉血。图3 NAD代谢调控肠道免疫的可能机制Fig.3 Possible mechanism of NAD metabolism regulating intestinal immune[6,34,36]
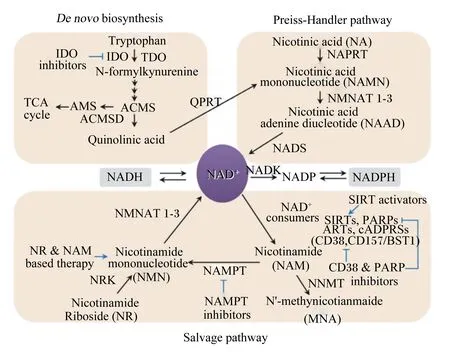
Denovobiosynthesis:从头合成;Preiss-Handler pathway:Preiss-Handler途径;Salvage pathway:补救合成途径;Tryptophan:色氨酸;IDO:吲哚胺2,3-双加氧酶 indoleamine 2,3-dioxygenase1;IDO inhibitors:IDO抑制剂;TDO:色氨酸2,3-双加氧酶 tryptophan 2,3-dioxygenase;N-formylkynurenine:N-甲酰犬尿氨酸;ACMS:2-氨基-3-羧酸半醛 2-amino-3-carboxymuconate semialdehyde;ACMSD:ACMS脱羧酶 ACMS decarboxylase;AMS:丙烯酰胺 acrylamides;TCA cycle:三羧酸循环 tricarboxylic acid cycle;Quinolinic acid:喹啉酸;QPRT:喹啉酸酯磷酸核糖基转移酶 quinolinate phosphoribosyl transferase;NA:烟酸 nicotinic acid;NAMN:烟酸单核苷酸 nicotinic acid mononucleotide;NAPRT:烟酸磷酸核糖基转移酶 nicotinic acid phosphoribosyl transferase;NMNAT:烟酰胺单核苷酸腺苷酰转移酶 nicotinamide mononucleotide adenylyl transferase;NAAD:烟酸腺嘌呤二核苷酸 nicotinic acid adenine dinucleotide;NADS:烟酰胺腺嘌呤二核苷酸合酶 nicotinamide adenine dinucleotide synthase;NAD+:烟酰胺腺嘌呤二核苷酸 nicotinamide adenine dinucleotide;NADH:还原态烟酰胺腺嘌呤二核苷酸 reduced nicotinamide adenine dinucleotide;NAM:烟酰胺 nicotinamide;NMN:烟酰胺单核苷酸 nicotinamide mononucleotide;NR:烟酰胺核苷 nicotinamide riboside;NRK:烟酰胺核苷激酶 nicotinamide riboside kinase;NADK:烟酰胺腺嘌呤二核苷酸激酶 nicotinamide adenine dinucleotide kinase;NAMPT:烟酰胺磷酸核糖基转移酶nicotinamide phosphoribosyl transferase;NAMPT inhibitors:NAMPT抑制剂;NADP:烟酰胺腺嘌呤二核苷酸磷酸 nicotinamide adenine dinucleotide phosphate;NADPH:还原态烟酰胺腺嘌呤二核苷酸磷酸 reduced nicotinamide adenine dinucleotide phosphate;SIRTs:去乙酰化酶Sirtuins;PARPs:多聚ADP核糖聚合酶Poly (ADP ribose)polymerase;ARTs:二磷酸腺苷核糖转移酶 ADP-ribose transferases;cADPRSs:环状ADP-核糖合成酶 cyclic ADP-ribose synthases;CD38:分化簇38 cluster of differentiation 38;CD157:分化簇157 cluster of differentiation 157;NNMT:烟酰胺N-甲基转移酶 nicotinamide N-methyltransferase;MNA:N′-亚甲基噻吩N′-methynicotianmaide。
图1 NAD代谢途径
Fig.1 NAD metabolic pathway[13]
[16] HAN X N,UCHIYAMA T,SAPPINGTON P L,et al.NAD+ameliorates inflammation-induced epithelial barrier dysfunction in cultured enterocytes and mouse ileal mucosa[J].The Journal of Pharmacology and Experimental Therapeutics,2003,307(2):443-449.
[17] GERNER R R,KLEPSCH V,MACHEINER S,et al.NAD metabolism fuels human and mouse intestinal inflammation[J].Gut,2018,67(10):1813-1823.
[18] GRANGE P A,RAINGEAUD J,CALVEZ V,et al.Nicotinamide inhibits Propionibacterium acnes-induced IL-8 production in keratinocytes through the NF-kappaB and MAPK pathways[J].Journal of Dermatological Science,2009,56(2):106-112.
[19] GAO J,XU K,LIU H N,et al.Impact of the gut microbiota on intestinal immunity mediated by tryptophan metabolism[J].Frontiers in Cellular and Infection Microbiology,2018,8:13.
[20] HASHIMOTO T,PERLOT T,REHMAN A,et al.ACE2 links amino acid malnutrition to microbial ecology and intestinal inflammation[J].Nature,2012,487(7408):477-481.
[21] FERREIRA R G,MATSUI T C,GODIN A M,et al.Neutrophil recruitment is inhibited by nicotinamide in experimental pleurisy in mice[J].European Journal of Pharmacology,2012,685(1/2/3):198-204.
[22] MURRAY M F.Nicotinamide:an oral antimicrobial agent with activity against bothMycobacteriumtuberculosisand human immunodeficiency virus[J].Clinical Infectious Diseases,2003,36(4):453-460.

[24] MARTENS C R,DENMAN B A,MAZZO M R,et al.Chronic nicotinamide riboside supplementation is well-tolerated and elevates NAD+in healthy middle-aged and older adults[J].Nature Communications,2018,9(1):1286.
[25] MAKAROV M V,MIGAUD M E.Syntheses and chemical properties of β-nicotinamide riboside and its analogues and derivatives[J].Beilstein Journal of Organic Chemistry,2019,15:401-430.
[26] FISCHER N,SECHET E,FRIEDMAN R,et al.Histone deacetylase inhibition enhances antimicrobial peptide but not inflammatory cytokine expression upon bacterial challenge[J].Proceedings of the National Academy of Sciences of the United States of America,2016,113(21):E2993-E3001.
[27] ESKANDARIAN H A,IMPENS F,NAHORI M A,et al.A role for SIRT2-dependent histone H3K18 deacetylation in bacterial infection[J].Science,2013,341(6145):1238858.
[28] 易宏波,王丽,熊云霞,等.组蛋白去乙酰化酶调控肠道抗菌肽表达的研究进展[J].动物营养学报,2019,31(10):4421-4426.
YI H B,WANG L,XIONG Y X,et al.Research advance on antimicrobial peptide expression regulated by histone deacetylase in intestines[J].Chinese Journal of Animal Nutrition,2019,31(10):4421-4426.(in Chinese)
[29] IGARASHI M,GUARENTE L.mTORC1 and SIRT1 cooperate to foster expansion of gut adult stem cells during calorie restriction[J].Cell,2016,166(2):436-450.
[30] CARUSO R,MARAFINI I,FRANZE,et al.Defective expression of SIRT1 contributes to sustain inflammatory pathways in the gut[J].Mucosal Immunology,2014,7(6):1467-1479.
[31] VACHHARAJANI V T,LIU T F,WANG X F,et al.Sirtuins link inflammation and metabolism[J].Journal of Immunology Research,2016,2016:8167273.
[32] LIU T F,VACHHARAJANI V T,YOZA B K,et al.NAD+-dependent sirtuin 1 and 6 proteins coordinate a switch from glucose to fatty acid oxidation during the acute inflammatory response[J].The Journal of Biological Chemistry,2012,287(31):25758-25769.
[33] FOULADI M.Histone deacetylase inhibitors in cancer therapy[J].Cancer Investigation,2006,24(5):521-527.
[34] YASEEN A L,CHEN S,HOCK S,et al.Resveratrol sensitizes acute myelogenous leukemia cells to histone deacetylase inhibitors through reactive oxygen species-mediated activation of the extrinsic apoptotic pathway[J].Molecular Pharmacology,2012,82(6):1030-1041.
[35] 李智伟,丁剑冰.巨噬细胞极化特点及其在胞内菌感染中免疫调节功能的研究进展[J].中国免疫学杂志,2019,35(20):2554-2558.
LI Z W,DING J B.Polarization characteristics and immunoregulatory functions of macrophage in intracellular infections[J].Chinese Journal of Immunology,2019,35(20):2554-2558.(in Chinese)
[36] 付爱坤,胡胜兰,杜威,等.益生菌对巨噬细胞的免疫调节作用[J].动物营养学报,2013,25(12):2833-2837.
FU A K,HU S L,DU W,et al.Immunomodulation effect of probiotics on macrophage[J].Chinese Journal of Animal Nutrition,2013,25(12):2833-2837.(in Chinese)
[37] MINHAS P S,LIU L,MOON P K,et al.Macrophage de novo NAD+synthesis specifies immune function in aging and inflammation[J].Nature Immunology,2019,20(1):50-63.
[38] PAJUELO D,GONZALEZ-JUARBE N,TAK U,et al.NAD+depletion triggers macrophage necroptosis,a cell death pathway exploited by mycobacterium tuberculosis[J].Cell Reports,2018,24(2):429-440.
[39] BOCK K W.Aryl hydrocarbon receptor (AHR)functions:balancing opposing processes including inflammatory reactions[J].Biochemical Pharmacology,2020,178:114093.
[40] LARROSA M,YAÉZ-GASCN M J,SELMA M V,et al.Effect of a low dose of dietary resveratrol on colon microbiota,inflammation and tissue damage in a DSS-induced colitis rat model[J].Journal of Agricultural and Food Chemistry,2009,57(6):2211-2220.
[41] RIDLON J M,KANG D J,HYLEMON P B,et al.Bile acids and the gut microbiome[J].Current Opinion in Gastroenterology,2014,30(3):332-338.
