铜离子对肺癌细胞增殖的影响及相关基因的临床意义
2021-12-07王桂珍周光飚
吴 冉,王桂珍,程 昕,3,周光飚
1.贵州大学医学院生物医学系,贵州 贵阳 550025;
2.国家癌症中心/中国医学科学院肿瘤医院分子肿瘤学国家重点实验室,北京 100021;
3.哈佛医学院达纳-法伯癌症研究所癌症生物学系,马萨诸塞州 波士顿 02215
不同微量元素在生物体内发挥不同的生物学功能,并在一定程度上参与癌症的发生、发展[1]。铜作为酪氨酸激酶及铜蓝蛋白等多种酶的关键辅助因子,在生物体的生长发育过程中发挥重要作用。有研究[2]表明,铜是维持机体正常生物学功能的必需微量元素,具有氧化还原性质,能维持生物体内催化、氧化、细胞呼吸及各类生命活动。此外,也有研究[3]指出,铜离子能调节肿瘤的氧化磷酸化和生长过程,可参与致癌信号转导通路BRAF转导和肿瘤发生[4],对生物体有一定的潜在毒性[5]。因此,生物体的铜离子含量应该维持在一个相对稳定的状态,否则将会破坏生物体的内环境稳态,引起机体的应激反应,从而造成不必要的伤害。
研究表明,破坏铜离子在体内的平衡可能会促进癌症的发生、发展。由于铜离子在许多生物学过程中是重要的辅助因子,在不同的癌症表型中常会出现铜离子的身影,例如铜可以通过激活参与细胞生长和代谢的酶LOX、SPARC、MEK1和MEMO1来增强癌细胞转移的能力[6]。饮食中铜和锌的摄入量与患肺癌风险相关[7-8]。铜是多种金属酶活性必需的微量元素之一,血清中铜或铁含量较高的人,会增加死于癌症的风险[9]。此外,研究发现,肺癌患者血清中铜离子含量比健康对照组高[10-11],且肺癌患者癌组织中的铜、钙、镁和锌含量也显著高于正常肺组织[12-13]。但这些研究主要报道了患者血清或癌组织中的主要/微量元素含量的异常变化,而在细胞水平上研究铜离子浓度对细胞的增殖及信号转导通路影响的报道较少。肺癌是全世界最常见的癌症,每年有210万新发及180万死亡病例,在中国,肺癌也是最常见的癌症,每年新发及死亡病例分别为78.7万及63.1万[14-15]。本文以肺癌作为肿瘤模型,系统性研究铜离子浓度对细胞增殖的影响及其铜伴侣蛋白编码基因在肺癌发展和预后中的意义。
1 材料和方法
1.1 材料
人肺癌细胞系A549和人正常肺上皮细胞系16HBE由国家癌症中心/中国医学科学院肿瘤医院分子肿瘤学国家重点实验室传代培养,DMEM培养基、RPMI-1640培养基、0.25%胰酶及胎牛血清均购自美国Gibco公司,A/J小鼠购自上海南方模式生物科技股份有限公司,脱脂奶粉购自美国BD公司,抗细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)抗体、抗磷酸化ERK(phosphorylated ERK,p-ERK)抗体均购自美国CST公司,抗β-actin抗体购自美国Sigma公司,化学发光液购自大连美仑生物技术有限公司。
1.2 方法
1.2.1 细胞生长曲线实验
将A549细胞和16HBE细胞接种于6孔板中,每孔0.8×105个细胞。待细胞贴壁完全后,实验组用浓度为5 μmol/L的Cu2+溶液分别处理A549和16HBE细胞,对照组用等体积溶剂进行处理,分别于加药后24、48和72 h,用0.25%的胰酶消化细胞,台盼蓝染色后计数,每个实验重复3次后,用GraphPad Prism 7软件绘制生长曲线图。
1.2.2 蛋白样品的制备及蛋白质印迹法(Western blot)实验
将16HBE细胞接种于6孔板中,每孔2×105个细胞。待细胞贴壁后,将含不同浓度的铜离子溶液与细胞一起温育48 h后,弃去培养基,用预冷的磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤3次。然后将浓度为1×十二烷基硫酸钠(sodium dodecyl sulphate,SDS)的上样缓冲液(每3×105个细胞加入100 μL上样缓冲液)加入6孔板中,用预冷的细胞刮将细胞刮下,并转至Eppendorf试管中。将上述Eppendorf试管置于99 ℃水浴锅煮12 min,每间隔3 min用涡旋仪振荡混匀1次,得到的蛋白样品用12 000 r/min离心1 min后取10 μL的蛋白量进行SDS聚丙烯酰胺凝胶电泳(SDS polyacrylamide gel electrophoresis,SDS-PAGE);湿转至NC膜上,在电压为110 V条件下转膜2 h。取出NC膜并放入提前配置好的含5%脱脂奶粉的1×洗膜缓冲液(tris-buffered saline Tween,TBST)中,室温放置1~2 h,用一抗稀释液以1∶1 000比例稀释抗p-ERK、抗ERK和抗β-actin抗体,将上述封闭后的NC膜放入目的抗体溶液中,4 ℃平板摇床温育过夜,第2天用TBST洗膜3次,每次10 min;再放入稀释好的带辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗中,常温温育1~2 h后,用TBST洗膜3次,每次5 min,用化学发光成像仪显影。
1.2.3 构建动物肺癌模型
4~5周龄雌性A/J小鼠在SPF级别动物房中饲养,对小鼠进行编号,待小鼠充分适应动物房无菌环境1周后开始给予烟草致癌物4-甲基亚硝铵-1-(3-吡啶基)-1-丁酮[4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone,NNK],来诱发小鼠产生肺癌。将A/J小鼠随机分为对照组和NNK组,每组10只。通过灌胃方式给予NNK组小鼠100 mg/kg的NNK,1周两次,连续5周。同时对照组小鼠给予相同体积的溶剂。在灌胃结束后,通过颈椎脱臼法处死小鼠,并将小鼠的肺组织取出,放置-80 ℃保存,以备后续实验。本研究的所有动物实验均按照中国医学科学院肿瘤医院动物管理与使用委员会批准的指南进行。
1.2.4 H-E染色
将40%的甲醛溶液固定、石蜡包埋的小鼠肺组织标本切成5 μm厚的切片,通过二甲苯脱蜡和不同浓度的乙醇对切片进行脱蜡处理。随后用苏木精染色5 min,用盐酸乙醇分化后,用伊红染液染色1~3 min;经过不同浓度梯度的乙醇与二甲苯彻底脱水透明后,用中性树胶封盖,在普通光镜下观察组织形态。
1.2.5 小鼠体内铜离子的检测
对小鼠肺组织样品进行称重,取200 mg肺癌组织及对应癌旁正常组织,液氮冷冻状态下研磨成粉末。将粉末在预冷的混合酸(HNO3∶HClO4=1∶1)中过夜,并转移至5 mL去离子水中,随后用电感耦合等离子体质谱仪(inductively-coupled plasma-mass spectrometry,ICP-MS)对铜离子浓度进行测定。
1.3 统计学处理
利用癌症基因组图谱(The Cancer Genome Atlas,TCGA)和Oncomine等数据库分析铜伴侣蛋白超氧化物歧化酶(copper chaperone for superoxide dismutase,CCS)、细胞色素C氧化酶铜伴侣蛋白17(cytochrome C oxidase copper chaperone 17,COX17)和抗氧化剂1铜伴侣蛋白(antioxidant 1 copper chaperone,ATOX1)在患者中的表达情况,利用Kaplan-Meier Plotter网站分析上述基因表达水平与患者预后的关系。在GraphPad Prism 8软件中采用双尾Student’st检验对实验结果进行数据分析。P<0.05为差异有统计学意义。
2 结果
2.1 铜离子促进细胞增殖
用浓度为5 μmol/L的铜离子溶液处理人肺癌细胞A549,同时用等体积溶剂处理对照组细胞,并于第1、2和3天检测细胞的增殖情况。结果显示,相较于对照组,用含铜离子的溶液处理细胞后,细胞数目明显增加(P=0.038 6),说明铜离子能促进A549的增殖(图1A)。在正常人肺上皮细胞来源的16HBE细胞中,浓度为5 μmol/L的铜离子也可促进细胞增殖,与对照组相比,差异有统计学意义(P=0.031 4,图1B)。上述结果表明铜离子可促进细胞增殖。
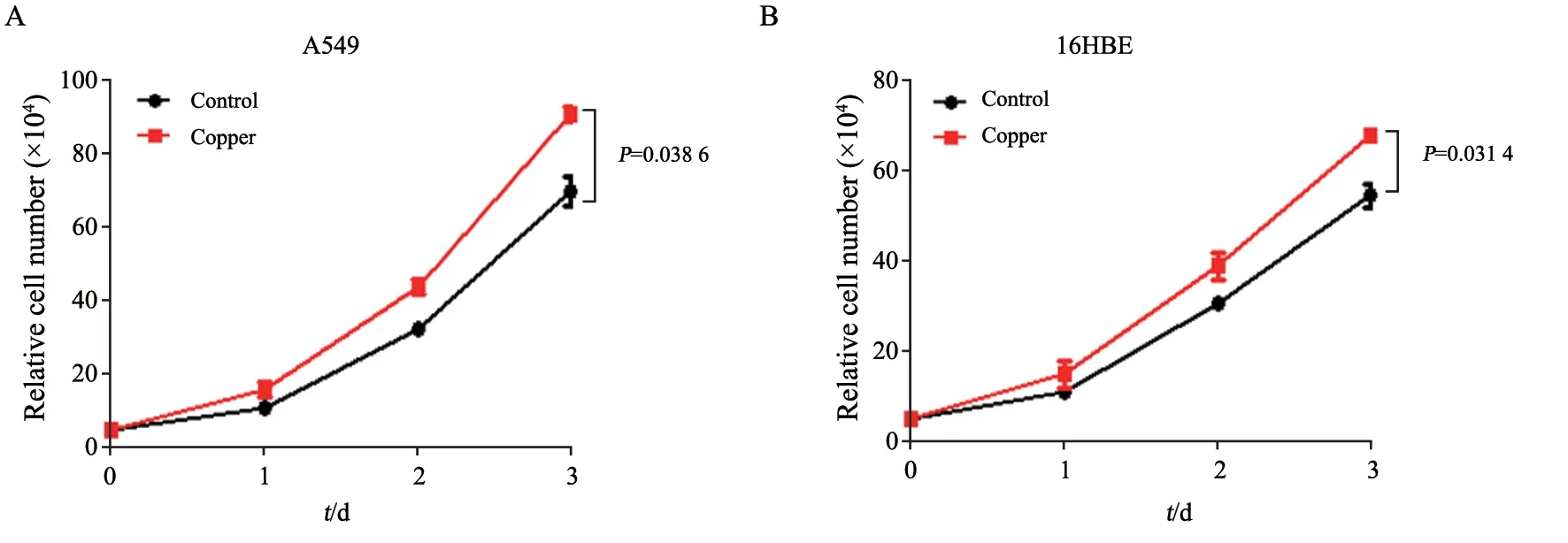
图1 铜离子促进A549和16HBE细胞增殖Fig.1 Copper ions promote the proliferation of A549 and 16HBE cells
2.2 铜离子能提高细胞内ERK的磷酸化水平
ERK作为一类丝/苏氨酸蛋白激酶,是传递丝裂原信号的信号转导蛋白,也是多种生长因子的下游蛋白,能通过被磷酸化参与调节细胞的增殖、分化和存活等[16]。本研究分析了铜离子对细胞内ERK信号通路的影响,用浓度为2.5、5.0和10.0 μmol/L的铜离子溶液处理16HBE细胞,并于48 h后提取蛋白进行SDS-PAGE,通过Western blot检测p-ERK、ERK蛋白的表达情况。结果显示,随着铜离子浓度的升高,p-ERK蛋白的表达量也随之升高(图2A、2B),说明铜离子能在一定程度上诱导细胞内ERK的磷酸化,从而促进细胞增殖。

图2 铜离子对16HBE细胞内ERK的影响Fig.2 The effects of copper ions on ERK in 16HBE cells
2.3 小鼠肺癌组织中铜离子的含量高于正常组织
将A/J小鼠在SPF级别的动物房中饲养并用耳号进行标记,随机分为两组。1周后通过对小鼠给予NNK建立小鼠肺癌模型。每周详细观察并记录小鼠的体重和状态,用小动物计算机体层显像仪(small animal computed tomography,micro-CT)成像和对小鼠肺组织取材观测小鼠肺部肿瘤生长情况,并通过H-E染色鉴定肿瘤类型。实验结果显示,NNK可以诱发小鼠肺癌的产生(图3A)。进一步通过ICP-MS检测小鼠肺癌组织和正常肺组织的铜离子含量,结果表明,小鼠肺癌组织中的铜离子含量高于正常肺组织(图3B)。

图3 小鼠肺癌组织中的铜离子含量高于正常肺组织Fig.3 Copper ion concentration was higher in mouse lung cancer tissues than in normal lung tissues
2.4 铜伴侣蛋白编码基因在肺癌组织中高表达
研究发现,铜离子进入细胞质后,主要通过CCS、COX17和ATOX1等,实现铜离子在不同细胞器中的运输,进而发挥相应的生物学功能[17]。因此,本研究利用多种数据库,进一步分析了铜伴侣蛋白编码基因在肺癌患者癌组织和正常组织中的表达差异。通过对TCGA数据库中肺癌患者数据进行分析发现,在肺腺癌患者中,肺癌组织中的CCS、COX17和ATOX1基因的mRNA表达水平显著高于正常肺组织(图4A~4C)。此外,通过对Oncomine基因芯片数据库进行分析发现,在Garber、Stearman、Okayama、Su、Hou和Selamat数据中,肺癌组织中的CCS基因的mRNA表达水平高于癌旁组织(图4D);在Garber、Okayama和Wachi数据中,肺癌组织中的COX17基因的mRNA表达水平也高于癌旁组织(图4E);在Garber、Okayama、Hou和Landi数据中,肺癌组织中的ATOX1基因的mRNA表达水平也高于癌旁组织(图4F)。

图4 铜伴侣蛋白编码基因CCS、COX17和ATOX1在肺癌患者癌组织中的表达水平显著高于正常肺组织Fig.4 The expression levels of copper chaperone protein-encoding genes CCS,COX17 and ATOX1 were significantly higher in cancer tissues than in normal lung tissues
2.5 铜伴侣蛋白编码基因与患者预后的关系
为进一步研究铜伴侣蛋白编码基因CCS、COX17和ATOX1与肺癌患者预后的关系,利用Kaplan-Meier Plotter网站对3个铜伴侣蛋白编码基因的表达水平与肺癌患者的预后进行了统计学分析。结果表明,在肺腺癌患者中,铜伴侣蛋白编码基因CCS、COX17和ATOX1的表达水平与患者的预后及生存呈负相关(图5),说明肺癌患者体内铜伴侣蛋白的表达水平可作为判断患者临床疗效和评估预后的依据。
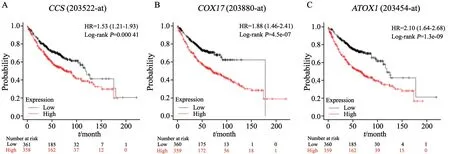
图5 铜伴侣蛋白编码基因的表达水平与肺腺癌患者的预后呈负相关Fig.5 The expression levels of copper chaperone protein-encoding genes were negatively correlated with prognosis of patients with lung adenocarcinoma
3 讨 论
铜离子是人体生命活动所必需的一种重要微量元素。人体内铜离子的含量异常往往会引起一系列的疾病[18]。本研究发现,铜离子可以诱导细胞内ERK磷酸化,从而促进肺癌细胞和正常细胞的增殖。有研究[19]发现,培养羊的胰腺类器官时,铜离子能以ATOX1依赖的方式直接结合MEK,从而激活MEK-ERK信号转导通路,而小鼠细胞中铜离子转运蛋白1(copper transporter 1,CTR1)的缺失和突变都可降低MEK1磷酸化ERK的能力,说明MEK1-ERK相互作用需要铜离子的参与,而铜离子伴侣蛋白ATOX1和CTR1在铜离子与MEK的直接结合中均扮演重要角色。此外,二价铜离子可启动两种受体酪氨酸激酶(receptor tyrosine kinase,RTK)介导的下游信号转导通路,包括AKT和ERK[20],说明铜离子还可能参与RTK的激活,从而导致ERK的磷酸化。
吸烟是引发肺癌的主要外因,吸烟者发生肺癌的风险是非吸烟者的20~30倍,且二手烟也会增加肺癌的发病风险[21],吸烟可引起各种类型的肺癌[22]。烟草燃烧产生的烟雾中有60多种已知的致癌物,包括多环芳烃类(如苯并芘)、苯、丙烯及亚硝胺类(如NNK)[23]。这些致癌物一般先与DNA形成加合物,再直接或间接诱使抑癌基因如TP53突变失活或癌基因如KRAS突变激活[23-25]。对亚硝胺类敏感的CYP2E1一般诱发肺腺癌[26]。在Cu2+和NADPH的存在下,亚硝胺的代谢物NNK和NNN能够产生显著水平的DNA氧化,从而增加癌症发生的风险;同时,香烟烟雾中也含有大量的金属离子,其中也包括铜离子;电子烟中的铜离子含量甚至可以达到普通香烟的6倍,这进一步解释了肺癌组织中高浓度铜离子的来源[27]。
在机体正常组织中,铜离子主要通过铜伴侣蛋白来实现在不同细胞器中的运输,进而发挥相应的生物学功能。目前,铜伴侣蛋白是肿瘤研究的热点。本研究发现,CCS、COX17和ATOX1在人肺癌组织中的表达水平显著高于正常组织,且这些蛋白的表达水平与肺癌患者的预后和生存呈负相关,这在一定程度上说明高浓度的铜离子在肿瘤的发生、发展中起着重要作用。铜离子浓度与肿瘤的恶性程度显著相关,也预示着铜伴侣蛋白可作为判断患者临床疗效和评估预后的一项依据。ATOX1和CCS7都是铜离子发挥生物学功能不可或缺的蛋白,且二者与铜离子相结合的结构区域有一定的相似性。抑制剂DC_AC50可以通过结合ATOX1和CCS的铜转运界面,阻断铜离子在细胞内的转运,在裸鼠移植瘤模型中表现出显著的抑瘤效果[28]。COX17与铜离子的作用方式则不同于ATOX1和CCS。COX17主要存在于细胞线粒体膜结构中,COX17与铜离子作用后可能通过调节肿瘤细胞的代谢从而影响肿瘤的发生、发展。也有研究[29-30]发现,在小鼠和人类细胞环境中,MEK1铜离子结合区的突变会降低BRAFV600E突变驱动的信号转导和肿瘤发生,而铜离子螯合剂对这类突变型的肿瘤有着显著疗效,说明无论是通过螯合治疗降低铜离子的浓度,还是通过抑制剂抑制铜离子的转运,对肿瘤细胞都有着一定的抑制作用,减少铜离子对癌细胞内恶性通路的激活是十分有潜力的治疗方向。然而,由于铜离子本身是一种重要的必需微量元素,而目前大部分铜配体药物均是采取全身给药方式,不加甄别地实现全身铜耗竭,因此往往会导致一些不良反应,例如影响铜离子与血管生成素的结合及新生血管生成等,最终导致红斑、视神经炎、呕吐和白细胞减少等不良反应[31]。因此,如何在开发靶向铜离子药物及给药系统的同时避免影响其正常的生理功能,将是未来研究的重点。
本研究发现,高浓度铜离子能诱导ERK磷酸化,并促进肿瘤细胞增殖,并探索了铜离子在肿瘤组织与正常组织中的浓度差异。ERK信号转导通路的激活除了与细胞的增殖和生存相关外,还可诱导机体产生炎症反应[32-33]。因此,在今后的研究中,可以结合其可能的对人体免疫调节作用,综合研究铜离子促进肿瘤发生、发展的机制。此外,本研究表明,铜伴侣蛋白编码基因表达水平与肺癌患者预后呈负相关,因此可以通过抑制铜伴侣蛋白的作用,减弱肿瘤细胞对铜离子的过量摄取和阻断铜离子参与的肿瘤发生、发展过程,从而为肿瘤治疗提供新的思路。
