PAFR对卵巢癌细胞顺铂敏感性的影响及机制研究
2021-12-07徐丛剑
俞 弋,丛 青,徐丛剑,姜 伟
复旦大学附属妇产科医院妇科,上海 200011
卵巢癌是女性生殖系统中死亡率最高的一种恶性肿瘤。起病隐匿,缺乏早期有效的诊断方法,病理学类型复杂,预后较差[1]。目前卵巢癌的治疗方式仍是手术及术后辅助铂类药物为主的化疗,但易出现化疗耐药及转移复发[2]。炎症微环境对恶性肿瘤的发生、发展及转移至关重要。血小板活化因子(platelet-activating factor,PAF)作为迄今为止发现的内源性生物活性最强的一种磷脂类炎性因子,与PAF受体(PAF receptor,PAFR)结合后参与体内多种生理病理学过程[3-5]。
本课题组的前期研究[6]发现,PAFR在上皮性卵巢癌组织及细胞系中高表达,PAF能明显刺激PAFR阳性的卵巢癌细胞系增殖及侵袭。此外,在构建的裸鼠卵巢癌腹腔种植瘤模型中给予顺铂(cisplatin,CDDP)和(或)银杏内酯B(PAFR特异性拮抗剂),结果显示,银杏内酯B具有体内抑制卵巢癌的作用,并可增强肿瘤细胞对于CDDP的敏感性[7]。但相关机制尚不明确。本研究将在前期研究的基础上,探索CDDP作用后的卵巢癌细胞中PAFR的表达对卵巢癌细胞CDDP敏感性的影响,并探讨相关分子机制。
1 材料和方法
1.1 细胞系及主要试剂
浆液性卵巢癌细胞系SKOV-3和乳突状卵巢腺癌细胞系CAOV-3购自中国科学院典型培养物保藏委员会细胞库,CDDP、PAF和WEB2086(PAFR抑制剂)购自美国Sigma-Aldrich公司,兔抗人PAFR抗体购自美国Abcam公司,兔抗人phospho/total-ERK/AKT/P70S6K抗体购自美国Cell Signaling Technology公司。
1.2 蛋白质印迹法(Western blot)检测
收集各组细胞蛋白,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDS-PAGE)分离细胞裂解物并转移至硝酸纤维素膜上。温育一抗,4 ℃过夜,加入对应的二抗温育1 h,再次洗膜后加入荧光发光液检测。各组实验中涉及同一种蛋白的磷酸化及非磷酸化状态及内参蛋白是采用膜再生液洗膜的方法。
1.3 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)
使用TRIzol试剂从不同实验组卵巢癌细胞系中提取总RNA。将提取的RNA在紫外分光光度计下检测,读取260 nm波长处的吸光度(D)值及D260nm/D280nm比值,将RNA反转录合成cDNA。PCR程序:94 ℃ 30 s,52 ℃ 40 s,72 ℃ 40 s,共35个循环;然后72 ℃延伸10 min。通过2-ΔΔCt法计算各组mRNA的表达量并进行比较分析。
1.4 细胞增殖检测
采用MTT法检测PAFR抑制剂对卵巢癌细胞系CDDP敏感性的影响。调整细胞密度为1×104个/mL接种到96孔板中。不同实验组及对照组细胞在37 ℃下温育72 h后,向每孔中加入MTT溶液(5 mg/mL),并将96孔板在37 ℃下再温育4 h。使用多孔扫描分光光度计测量490 nm波长处的D值。实验重复3次。
1.5 细胞凋亡检测
将卵巢癌细胞系以4×104个/孔的密度接种到96孔板中培养,转染后培养48 h,加入3 μg/mL DDP。依据凋亡试剂盒说明书进行操作,采用流式细胞术进行检测。实验重复3次。
1.6 免疫荧光定位
将圆形细胞爬片置于24孔细胞培养板内,每孔加入5 000个卵巢癌细胞系并分为CDDP组和空白组,每组细胞设3个复孔。以免疫荧光封闭液在常温下封闭1 h,一抗4 ℃温育过夜。复温,二抗避光常温温育1 h;在载玻片上加1滴防淬灭封片剂,将上述圆形细胞爬片细胞面贴附于载玻片之上,在倒置荧光显微镜下观察并拍照。
1.7 统计学处理
2 结果
2.1 CDDP作用于卵巢癌细胞对PAFR表达的影响
用不同浓度的CDDP作用于卵巢癌SKOV-3和CAOV-3细胞24 h,RTFQ-PCR及Western blot结果显示,随着CDDP处理浓度的增加,SKOV-3和CAOV-3细胞中PAFR的mRNA表达及蛋白水平升高并呈剂量依赖性(P<0.01)。处理细胞的CDDP为最低剂量(2.5 μmol/L)时,PAFR RNA水平增加1.2倍;处理细胞的CDDP为最高剂量(60 μmol/L)时,PAFR RNA水平增加3.2倍。随着CDDP处理剂量的增加,SKOV-3和CAOV-3细胞中PAFR蛋白表达水平分别升高3.4和4.0倍。此外,用相同浓度(10 μmol/L)的CDDP处理细胞不同时间,RTFQ-PCR及Western blot结果显示,1 h后PAFR的RNA及蛋白表达水平均较空白对照组升高,并在处理24 h后表达量达到高峰(P<0.01,图1)。上述结果说明,CDDP能够引起卵巢癌细胞中PAFR的表达升高,并且这种升高呈现剂量及时间依赖性。
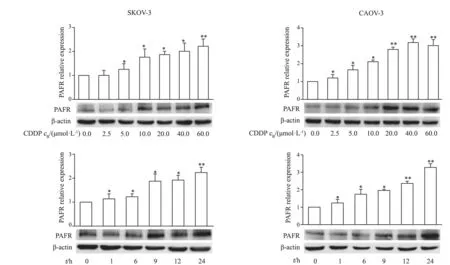
图1 CDDP能够引起卵巢癌SKOV-3和CAOV-3细胞中PAFR表达升高Fig.1 CDDP induces increased PAFR expression in human ovarian cancer SKOV-3 and CAOV-3 cells
2.2 核因子κB(nuclear factor Kappa-B,NFκB)/p65及缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)在CDDP引起卵巢癌细胞PAFR表达升高中的作用
有文献[8-9]报道,CDDP能够调节细胞内转录因子(如NF-κB/p65、HIF-1α等)的活性,而在一些肿瘤细胞中PAFR所发挥的作用也与转录因子NF-κB/p65及HIF-1α相关[10-11]。因此,为研究转录因子NF-κB/p65及HIF-1α是否参与卵巢癌细胞中CDDP调节PAFR表达的过程,首先观察CDDP作用于SKOV-3和CAOV-3细胞后NF-κB/p65及HIF-1α的表达。用10 μmol/L CDDP处理细胞不同时间后,Western blot结果显示,在细胞核蛋白中,随着CDDP处理时间的延长,NF-κB/p65及HIF-1α的蛋白表达水平逐渐升高。在各组细胞总蛋白中,NF-κB/p65及HIF-1α的蛋白表达水平并无明显改变(图2A、2B)。免疫荧光定位结果显示,CDDP组细胞中NF-κB/p65及HIF-1α的蛋白表达呈现明显的核聚集(图2C)。上述结果说明,CDDP作用于卵巢癌细胞后能够增加细胞核中NF-κB/p65及HIF-1α的蛋白表达。
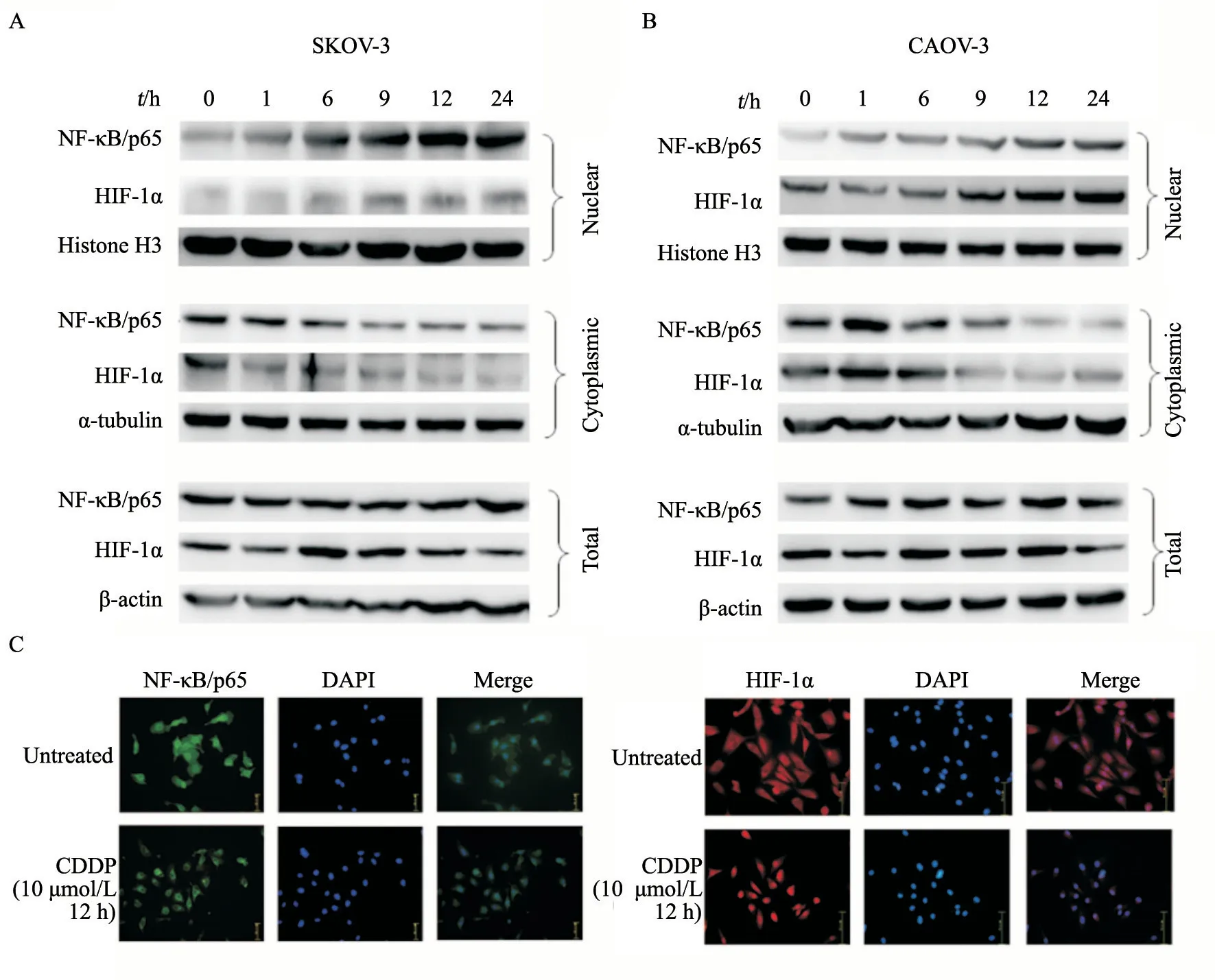
图2 CDDP可引起卵巢癌细胞株中转录因子NF-κB/p65及HIF-1α的核聚集Fig.2 CDDP treatment enhances the nuclear localization of NF-κB/p65 and HIF-1α
此外,本研究采用小RNA干扰技术沉默NF-κB/p65及HIF-1α后给予10 μmol/L CDDP处理细胞株24 h。Western blot及RTFQ-PCR结果显示,沉默NF-κB/p65及HIF-1α后,CDDP作用的卵巢癌细胞系中PAFR的RNA及蛋白表达水平均显著降低。与HIF-1α-siRNA相比,沉默NF-κB能够更加有效地抑制CDDP诱导的PAFR表达(图3A~3D)。细胞凋亡实验结果显示,与CDDP组细胞相比,CDDP与NF-κB-siRNA或HIF-1αsiRNA联合作用时,细胞凋亡率明显升高,差异有统计学意义(P<0.05,图3E、3F)。上述结果说明,在卵巢癌细胞中,CDDP通过转录因子NF-κB/p65及HIF-1α增加PAFR的表达。
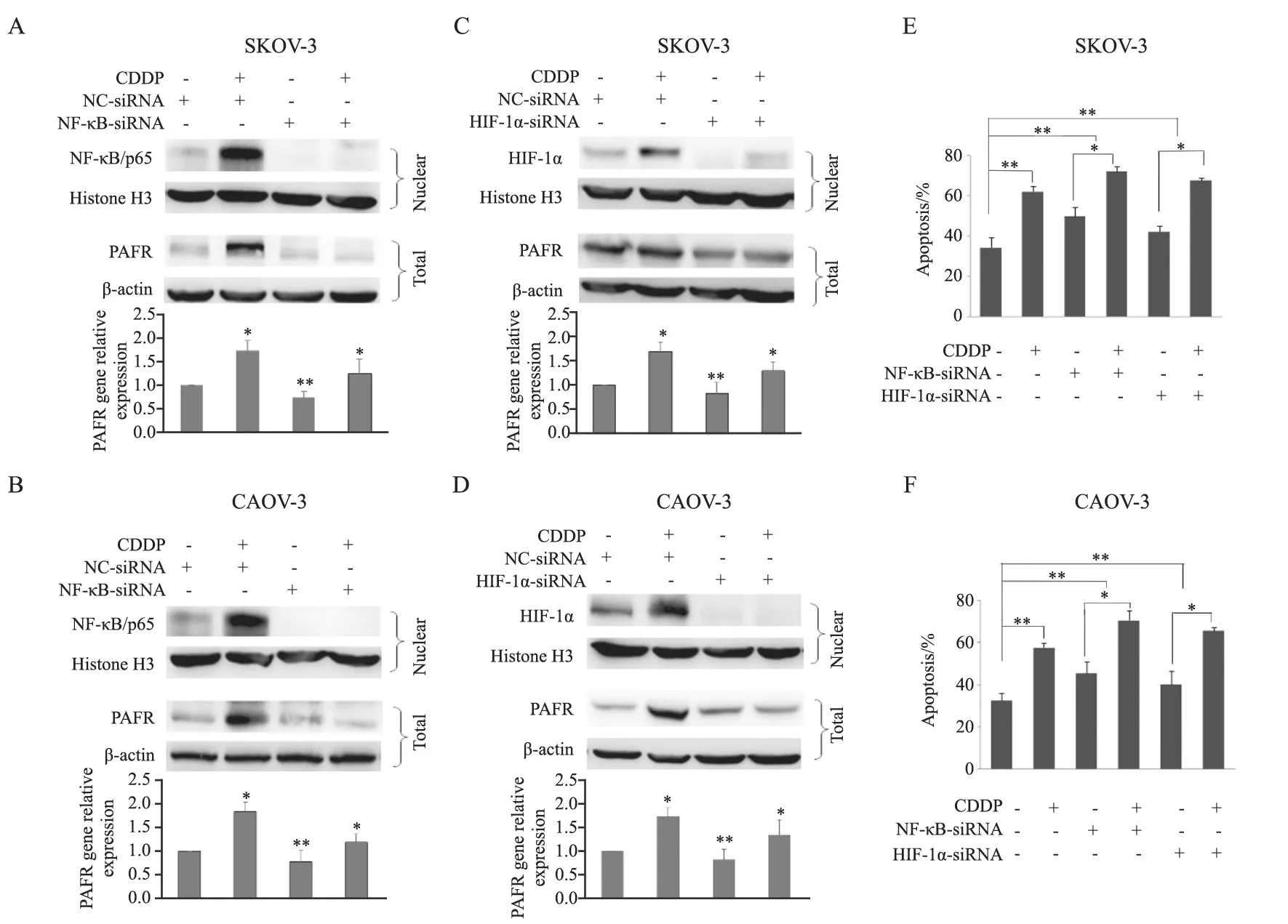
图3 CDDP通过转录因子NF-κB/p65及HIF-1α增加卵巢癌细胞株中PAFR的表达Fig.3 NF-κB/p65 and HIF-1α are involved in CDDP-induced PAFR expression in ovarian cancer cells
2.3 抑制PAFR对卵巢癌细胞CDDP敏感性的影响
为探索CDDP 作用于卵巢癌细胞时上调PAFR的作用,用100 μmol/L PAFR特异性小分子拮抗剂WEB2086预处理SKOV-3和CAOV-3细胞1 h后再给予10 μmol/L CDDP作用24 h。细胞活力实验结果显示,WEB2086+CDDP组细胞增殖能力与对照组相比明显降低(P<0.01);在细胞培养基中加入PAF后卵巢癌细胞系活性增强,而PAF+CDDP+WEB2086组细胞增殖能力与PAF+CDDP组相比亦明显降低(P<0.01,图4A)。细胞凋亡实验结果显示,与CDDP组相比,WEB2086+CDDP组细胞凋亡率明显升高(P<0.01,图4B)。此外,通过小RNA干扰技术沉默PAFR。Western blot结果显示,si-PAFR能够有效地抑制卵巢癌细胞中PAFR蛋白的表达。细胞凋亡实验显示,CDDP+PAFR-siRNA组细胞的凋亡率与对照组相比明显升高(P<0.05)。这一结果亦在Western blot中进行验证,CDDP+si-PAFR组细胞中的cleaved-PARP/caspase-3蛋白表达水平明显升高。Cleaved-PARP/caspase-3作为细胞凋亡的标志蛋白[12],cleaved-PARP、cleavedcaspase-3表达越高,细胞凋亡率越高(图4C)。上述结果说明,无论是通过特异性小分子拮抗剂或RNA干扰抑制PAFR表达均能够显著地提高卵巢癌细胞对于CDDP的敏感性。
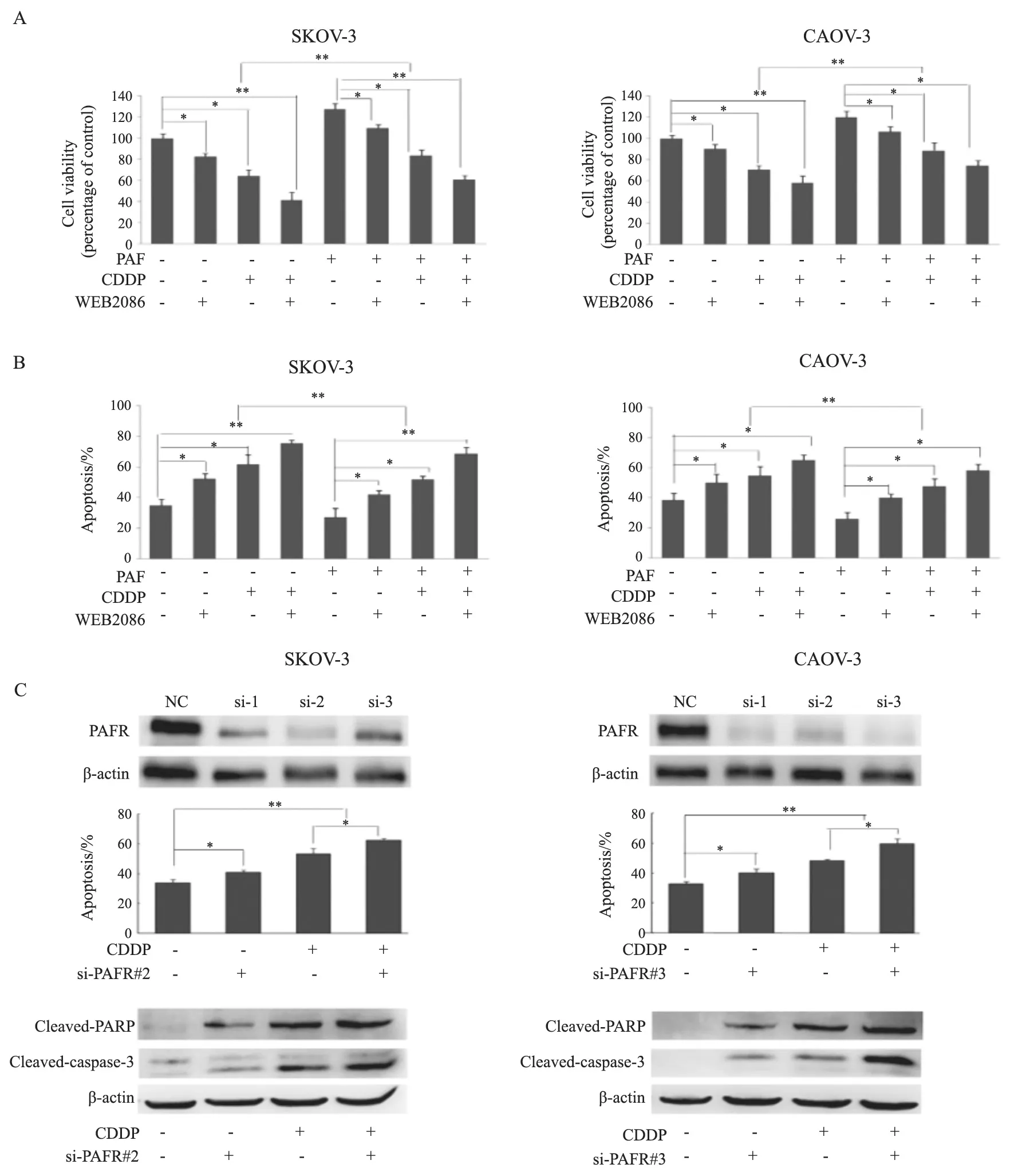
图4 抑制PAFR表达能够提高卵巢癌细胞株对CDDP敏感性Fig.4 PAFR suppression enhances the CDDP sensitivity of ovarian cancer cells
2.4 CDDP作用卵巢癌细胞后PAFR下游信号通路的激活
mTOR-PI3K-AKT及MAPK通路是细胞增殖及凋亡的两个重要信号转导通路[13]。多项研究[14-16]证实,在多种癌细胞中PAF/PAFR信号轴可以激活相关信号通路分子。本研究验证了AKT及ERK是否位于受CDDP作用而激活的PAFR下游信号通路中。用相同浓度(10 μmol/L)的CDDP作用于卵巢癌细胞不同时间,Western blot结果显示,在SKOV-3和CAOV-3细胞中,随着CDDP处理时间的延长,phospho-P70S6K/AKT/ERK蛋白表达水平均有所升高。将PAF加入细胞培养基中,p-P70S6K、p-AKT和p-ERK蛋白表达水平与对照组相比均有明显升高(图5A、5C)。为验证AKT及ERK信号蛋白的激活是否为PAFR依赖性,实验用不同浓度的PAFR特异性拮抗剂WEB2086预处理SKOV-3和CAOV-3细胞1 h后再给予10 μmol/L CDDP和(或)100 nmol/L PAF处理,Western blot结果显示,随着PAFR特异性拮抗剂WEB2086浓度的升高,p-P70S6K、p-AKT和p-ERK蛋白表达水平逐渐降低(图5B、5D)。上述结果说明,CDDP作用于卵巢癌细胞后,受激活的PAF/PAFR能够激活下游的AKT及ERK信号通路分子。

图5 CDDP通过PAFR激活下游的AKT及ERK信号通路分子Fig.5 AKT and ERK signaling pathways lies downstream of activated PAFR in CDDP-treated ovarian cancer cells
3 讨论
化疗是中晚期卵巢癌治疗的主要方法。然而,化疗耐药是导致卵巢癌患者复发死亡的主要原因之一。化疗药物一方面通过各种机制试图杀死癌细胞,而另一方面,化疗药物又激活了癌细胞的自我保护机制,从而对抗药物的作用。因此,肿瘤化疗的开始也意味着化疗耐药的发生[17]。阐明化疗药物所激发的细胞自我防御机制,探索有效的靶蛋白是克服化疗耐药的有效途径。
CDDP是卵巢癌化疗的一线药物。铂类化合物的作用机制主要是引起DNA链交联,破坏DNA分子结构,从而抑制DNA复制和转录,促进癌细胞的死亡[18]。本课题组在既往研究[6]中选择携带荧光报告基因的SKOV-3-luciferase细胞构建裸鼠的腹腔卵巢癌种植模型进行体内研究,采用腹腔注射的方式给予CDDP和(或)银杏内酯B,使用小动物活体成像的方法动态观察上述药物对裸鼠腹腔种植瘤生长的抑制作用,结果证实,银杏内酯B具有体内抑制卵巢癌生长的作用。已有文献[19]报道,银杏内酯B能够通过抑制氧化应激及NF-κB活性而减轻脂多糖引起的急性肺损伤。NF-κB通常在细胞质中通过与阻断NF-κB核转位的抑制蛋白IκB-α/β结合而处于失活状态。在多种肿瘤细胞中,NF-κB被激活并参与多种损伤及炎症反应[20]。多项体内、体外实验[21-23]均证实,NF-κB及HIF-1α等分子途径与CDDP耐药相关,尽管其具体机制尚不明确。根据本课题组既往研究[6]结果,银杏内酯B具有体内抑制卵巢癌生长的作用,并可以增强肿瘤细胞对CDDP的敏感性,提示NF-κB及HIF-1α可能参与CDDP在卵巢癌细胞中的作用过程并与PAFR的调节有关。
本研究进一步证明此结论并探索相关机制。当CDDP作用于SKOV-3和CAOV-3卵巢癌细胞系后,细胞核蛋白中转录因子NF-κB/p65及HIF-1α的表达量升高,进而PAFR的RNA和蛋白表达水平升高。当抑制PAFR表达时,卵巢癌细胞对CDDP的敏感性明显增强,即抑制细胞增殖,促进细胞凋亡,并将癌细胞阻滞在G0/G1期,说明当CDDP应用于卵巢癌细胞,发挥抗肿瘤效果的同时,也激起了细胞内的自我防御机制。CDDP作用于卵巢癌细胞后,PAFR的表达升高有可能是卵巢癌细胞化疗药物耐受的一种分子机制。
本课题组既往研究[6]结果已证实在卵巢癌细胞中,PAFR与EGFR通过一系列的细胞内分子信号转导通路传输信号,并共同激活下游的信号通路分子,如P70S6K、4EBP1、AKT及ERK蛋白等,发挥协同作用共同促进卵巢癌的发展[24]。P70S6K、4EBP1及AKT是PI3K/AKT/mTOR信号转导通路中重要的蛋白分子,ERK是MAPK信号转导通路中重要的蛋白分子。而PI3K/AKT/mTOR和MAPK信号转导通路均是细胞代谢和抗凋亡的重要转导途径,不仅与多种恶性肿瘤的发生、发展及预后有关,并且与多种一线化疗药物关系密切[25]。
本研究发现,用CDDP处理卵巢癌细胞后,PAFR表达上调,从而对抗CDDP的抗肿瘤效应。继而进一步探索CDDP作用于卵巢癌细胞后,上调的PAFR下游信号转导通路的变化。结果显示,当用同一浓度的CDDP作用于SKOV-3和CAOV-3细胞不同时间时,P70S6K/AKT/ERK蛋白均被激活,即phospho-P70S6K/AKT/ERK表达水平升高。而当向CDDP处理的卵巢癌细胞培养液中添加PAF时,phospho-P70S6K/AKT/ERK蛋白的表达水平均较无PAF添加的细胞组有所上升,提示CDDP作用于卵巢癌细胞后,PAFR的表达上升,从而与PAF相结合,进一步激活下游的信号通路分子,进而在卵巢癌细胞CDDP耐药中发挥作用。
综上所述,当CDDP 作用于卵巢癌细胞后,通过转录因子NF-κB/p65及HIF-1α能够上调PAFR的表达,抑制PAFR后可以增加卵巢癌细胞对CDDP的敏感性。此外,当CDDP作用于卵巢癌细胞后,上调的PAFR与细胞内的特异性配体PAF作用可以进一步促进下游信号通路分子P70S6K、AKT、ERK的激活从而发挥生物学效应。因此,PAFR可能成为卵巢癌靶向治疗的新靶点,这有望为联合辅助治疗提供一个新方向。
