4种唑类杀菌剂对蛋白核小球藻的急性毒性及其致毒机理
2021-12-07刘敏覃礼堂莫凌云梁延鹏曾鸿鹄
刘敏,覃礼堂,2,*,莫凌云,2,梁延鹏,3,曾鸿鹄,2
1. 桂林理工大学环境科学与工程学院,桂林 541004 2. 桂林理工大学,广西环境污染控制理论与技术重点实验室科教结合科技创新基地,桂林 541004 3. 桂林理工大学,广西环境污染控制理论与技术重点实验室,桂林 541004
各类化学污染物一旦排入水体环境将不可避免地残留其中,进而引起水环境的污染[1]。唑类杀菌剂是一类具有抗真菌性质的化学物质,被广泛用作农业、畜牧业和人类真菌病的抗真菌药物[2-3]。它们化学性质稳定,容易在环境中积累,从而残留在水体、食物、农作物和土壤中[4-6]。唑类杀菌剂在水体中检出频率和检出浓度较高,特别是三唑醇,检出浓度达到几十纳克每升[7],三唑酮在我国九龙江检出浓度最高达到12 μg·L-1[8],克霉唑和氯咪巴唑也同时在鱼类中检出[5]。唑类杀菌剂的大量使用不可避免地随降雨和地表径流进入水体,从而对水生生物产生威胁[9],进一步影响人类及其他生物的健康[2]。
考虑到杀菌剂在生活和农业实践中的广泛应用,需要进行更多有关唑类杀菌剂对水生生物潜在毒性的研究,以充分评估其对水环境的生态风险[10]。研究表明,三唑醇和三唑酮能够影响青蛙在水体中的活动,对超氧化物歧化酶(SOD)和过氧化氢酶(CAT)有不同程度的影响,对青蛙的肝脏组织和甲状腺激素水平的影响也因性别存在差异[11]。同时,三唑酮对枝角类浮游动物种群表现出明显的抑制作用[12],低剂量长期暴露下对水生生物的繁殖能力造成一定的损伤[13]。水蚤(Daphniasimilis)、涡虫(Dugesiajaponica)和多齿新米虾(Neocaridinadenticulate)3种水生生物在克霉唑和氯咪巴唑的48 h暴露下,氯咪巴唑对3种实验物种的急性毒性均>1 mg·L-1,克霉唑对水蚤的毒性最大,48 h-LC50为0.08 mg·L-1[10]。因此,有必要开展唑类杀菌剂对水生生物的生态毒性研究。
绿藻作为水生生态系统中重要的初级生产者,在水生生态系统的氧气生产中起着至关重要的作用[14]。其中,蛋白核小球藻(Chlorellapyrenoidosa)是单细胞绿藻,在水体中分布均匀,且繁殖速度快,易于培养,是一种理想的毒理学指示生物[15]。据报道,绿藻在农药刺激下能够产生活性氧(ROS)[16],ROS能通过抑制和干扰与光合过程及相关蛋白质合成等抑制叶绿体代谢,干扰光合装置的功能,最终影响细胞的生长[13],同时激活细胞的抗氧化酶如SOD和CAT,以防止自由基在氧化应激下对细胞产生损伤[14]。目前对绿藻的毒性研究大部分是采用标准的96 h绿藻急性微板毒性测试考察单一物质的毒性效应[17],例如,采用微板毒性实验分析法系统测定三嗪类农药对蛋白核小球藻的毒性效应[18];曾莎莎等[19]在96 h的急性暴露下进行了5种有机磷农药对蛋白核小球藻的毒性相互作用研究等,但是唑类杀菌剂对绿藻的致毒机理却鲜有报道。
本文研究了4种唑类杀菌剂(三唑醇、三唑酮、克霉唑和氯咪巴唑)对蛋白核小球藻的急性毒性及其毒性机制。通过评估唑类杀菌剂对蛋白核小球藻生长率的影响,判断其96 h急性毒性,并结合叶绿素和总蛋白(TP)含量、氧化损伤(ROS和丙二醛(MDA))、抗氧化损伤能力(SOD和CAT)和细胞凋亡相关的生理生化指标,揭示唑类杀菌剂对蛋白核小球藻的致毒机理,为全面准确评价唑类杀菌剂在环境中的潜在风险提供科学依据。
1 材料与方法(Materials and methods)
1.1 目标污染物及试剂
研究选取4种唑类杀菌剂为目标污染物,三唑醇(CAS No. 55219-65-3),纯度为98.9%;三唑酮(CAS No. 43121-43-3),纯度为97.7%;克霉唑(CAS No. 23593-75-1),纯度为98.0%;氯咪巴唑(CAS No. 38083-17-9),纯度为98.0%。其中,三唑醇购自Dr. Ehrenstorfer GmbH,三唑酮和氯咪巴唑购自CATO Research Chemicals Inc.,克霉唑购自Toronto Research Chemicals。
TP定量试剂盒、CAT试剂盒、SOD试剂盒、微量MDA试剂盒、ROS试剂盒和Annexin V-FITC/PI细胞凋亡试剂盒均购自南京建成生物工程研究所。95%乙醇(分析纯)和98%冰醋酸(分析纯)购自西陇科学股份有限公司。
1.2 受试生物及藻种培养
受试生物蛋白核小球藻(Chlorellapyrenoidosa)购自中国科学院典型培养物保藏委员会淡水藻种库(FACHB),其编号为[FACHB]-5,使用BG11培养基进行培养[20]。
在无菌的超净工作台中将蛋白核小球藻纯藻种转移至装有100 mL新鲜配制的BG11培养基的250 mL无菌锥形瓶内,封好瓶口,放置在光照培养箱内培养,培养温度22 ℃,光照条件2 000~3 000 lx,光暗周期12 h∶12 h[21]。每天定时摇动3~4次,并随机调换位置,每隔2~3 d接种一次,接种时间应在藻类细胞代谢最旺盛时期(上午10:00—11:00左右),至绿藻基本达到同步生长,取对数生长期的绿藻进行试验,试验前并在显微镜观察试验藻液是否被污染[22]。
1.3 绿藻毒性测试
先将4种目标污染物标准品分别用BG11培养基[20]溶解,配制成高浓度的储备液,三唑醇、三唑酮、克霉唑和氯咪巴唑的储备液的浓度分别为6.76E-05、6.81E-05、2.31E-05和2.73E-05 mol·L-1。实验时将储备液按照0.5和0.2的稀释因子逐级稀释,得到一系列所需浓度的试验液。在预实验的基础上每种目标污染物共设置7个实验组和1个对照组,每组设置3个平行。其次,在无菌条件下将处于对数生长期、初始密度约为4×105个cell·mL-1的蛋白核小球藻均匀藻液,分装于250 mL的锥形瓶中,每瓶20 mL藻液。再次,向各锥形瓶中依次添加对应剂量的目标污染物并补培养基至总体积为100 mL。加入目标污染物后,将蛋白核小球藻置于原培养条件下继续培养,每天定时摇动3~4次[22],连续培养至96 h。每24 h在681 nm下用紫外可见分光光度计(中国上海元析仪器有限公司,UV-9000S)测定藻液吸光度OD681[16]。并计算不同浓度暴露后的生长抑制率,计算公式如下[23]:
I=1-(ODti-ODt0)/(OD0i-OD00)
(1)
式中:ODti为第i时刻污染物处理组藻液的OD值,OD0i为i时刻空白对照组藻液的OD值。
1.4 浓度-抑制率数据拟合
采用经典的两参数非线性函数Weibull(式(2))、Logit(式(3))和Hill(式(4))对浓度-抑制率数据进行非线性最小二乘拟合[24],选择确定系数(R2)最大或均方根误差(RMSE)最小者为最优拟合函数[25]。式(2)~(4)可以计算出不同浓度下所对应的效应值,同样可以利用函数的反函数计算出不同效应下所对应的浓度[26]。
E=1/(1+exp(-α-βlog10(c)))
(2)
E=1-exp(-exp(α+βlog10(c)))
(3)
E=(α×c)/(β+c)
(4)
式(2)和(3)中α、β是Weibull和Logit的位置与斜率参数,式(4)中α、β是Hill的最大效应和EC50;式(2)、(3)和(4)中E为效应,即污染物对绿藻的生长抑制率,c是单个污染物或混合物的浓度。
1.5 蛋白核小球藻生理生化指标的测定。
1.5.1 TP含量、抗氧化酶活性和MDA含量的测定
蛋白核小球藻暴露96 h后,取30 mL均匀藻液,依次进行冷冻离心洗涤,研磨破碎的步骤获取粗酶液。将粗酶液作为待测样品采用考马斯亮蓝法[27]、钼酸铵法[28]、羟胺法[29]和硫代巴比妥酸(TBA)法[30-31]分别测定并计算TP、CAT、SOD和MDA的含量。根据公式(5)计算抑制率。
I=1-(cti/c0i)
(5)
式中:cti为第i时刻污染物处理组藻液各项生理指标的浓度,c0i为i时刻空白对照组的藻液各项生理指标的浓度。
1.5.2 ROS含量的测定
蛋白核小球藻暴露96 h后取5 mL均匀藻液,依次经过冷冻离心洗涤、藻细胞染色、37 ℃避光孵育、洗涤过滤的步骤获取待测藻液,用流式细胞仪(美国贝克曼库尔特有限公司,524C CytoFLEX)检测。上述具体方法参照南京建成生物工程研究所提供的方法以及Knauert和Knauer[32]采用的化学荧光法,并略有改进。根据公式(5)计算其抑制率。
1.5.3 叶绿素含量的测定[33]
蛋白核小球藻暴露96 h后,取30 mL均匀藻液,依次通过冷冻离心、超声破碎、95%乙醇提取和冷冻离心等步骤后取上清液,用紫外分光光度计(中国上海元析仪器有限公司,UV-9000S)在470、649和665 nm波长下进行测定,计算公式如下:
Chla=13.59×OD665-6.88×OD649
(6)
Chlb=24.96×OD649-7.32×OD665
(7)
类胡萝卜素= (1000×OD470-2.05×OD665-114.8×OD649)/245
(8)
1.5.4 细胞凋亡的测定
蛋白核小球藻暴露96 h后取5 mL均匀藻液,依次经过冷冻离心、洗涤浓缩、Annexin V-FITC染色、避光孵育和碘化丙啶(PI)染色获得染色藻液。过滤后用流式细胞仪(美国贝克曼库尔特有限公司,524C CytoFLEX)检测。以上所述的具体方法参照南京建成生物工程研究所提供的方法。根据式(5)计算细胞凋亡率。
2 结果(Results)
2.1 4种唑类杀菌剂对蛋白核小球藻的96 h急性毒性
4种唑类杀菌剂对蛋白核小球藻的96 h急性毒性的浓度-效应数据的线性函数拟合结果列于表1,其浓度-效应曲线绘于图1。由表1可知,Weibull、Logit或Hill函数能较好地拟合这4种目标污染物对蛋白核小球藻96 h急性毒性的浓度-效应数据,R2均>0.981,RMSE均<0.039。不同污染物对蛋白核小球藻的毒性大小不同,以半数效应浓度的负对数(pEC50)评估毒性大小,4种目标污染物96 h时毒性大小为:氯咪巴唑>克霉唑>三唑醇>三唑酮,其中克霉唑和氯咪巴唑的毒性明显大于三唑醇和三唑酮。藻类对不同种污染物敏感程度差异很大,造成这种毒性差异的主要原因可能与污染物自身的结构性质有关[34]。
由图1可知,4种目标污染物对蛋白核小球藻的毒性效应均表现为抑制作用,蛋白核小球藻的生长抑制率随着污染物浓度的增大而增大。在96 h的暴露下,4种唑类杀菌剂中抑制率最大的为氯咪巴唑。
2.2 唑类杀菌剂对蛋白核小球藻细胞中叶绿素含量的影响
叶绿素作为光合系统的重要组成部分,不仅吸收光能,保证光合作用的稳定运行,而且能反映环境胁迫状况,较好地反映藻类的生长发育状况[35-36]。如图2所示,蛋白核小球藻在4种唑类杀菌剂暴露96 h后,随着污染物浓度的升高,叶绿素a(Chla)、叶绿素b(Chlb)和类胡萝卜素(Car)含量明显降低,三者抑制率的变化趋势与生长抑制率的变化趋势相似,呈现出良好的正相关(P<0.01),表明唑类杀菌剂对蛋白核小球藻叶绿素的合成具有浓度依赖毒性。如图2(b)所示,三唑酮在低浓度下对蛋白核小球藻叶绿素的合成有促进作用,抑制率分别为-9.08%、-9.86%和-8.95%。这可能是蛋白核小球藻在环境胁迫下做出的一种自我保护的反应。值得注意的是,如图2(c)和2(d)所示,克霉唑和氯咪巴唑能够显著降低藻类的叶绿素含量,但是随着暴露浓度的增加,对Chla和Chlb的抑制作用均没有明显的增加,这与TP含量的变化情况相似。这可能是因为叶绿素在植物体中大多与蛋白质结合在一起,蛋白质受到破坏必定会对叶绿素产生影响,两者息息相关[16]。
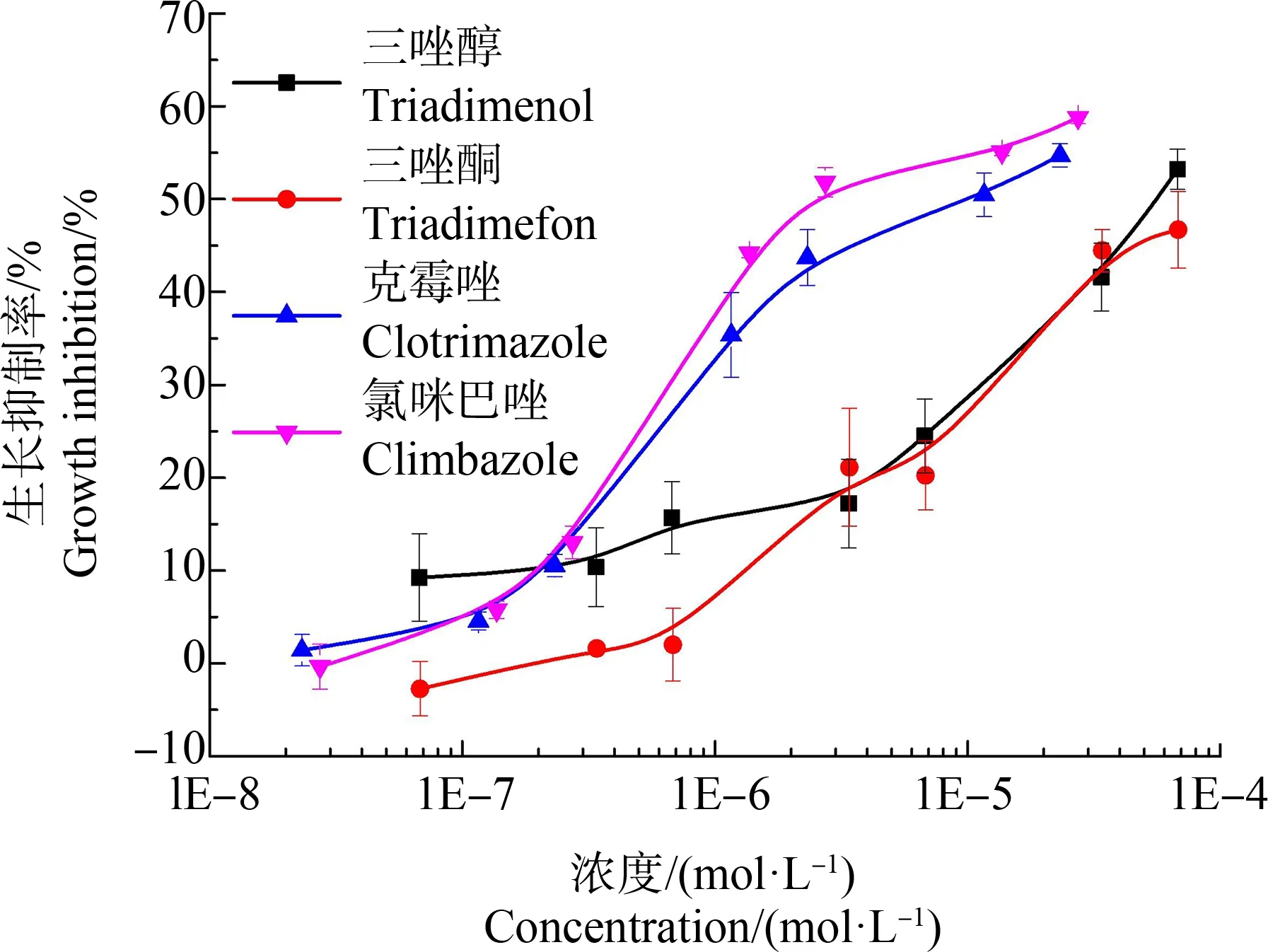
图1 4种唑类杀菌剂对蛋白核小球藻96 h的 生长抑制率曲线Fig. 1 Growth inhibition of Chlorella pyrenoidosa for 96 h exposure to four azole fungicides

表1 4种唑类杀菌剂对蛋白核小球藻96 h的浓度-效应曲线拟合参数Table 1 Fitting parameters of concentration-effect curve of four single azole fungicides on Chlorella pyrenoidosa after 96 h exposure
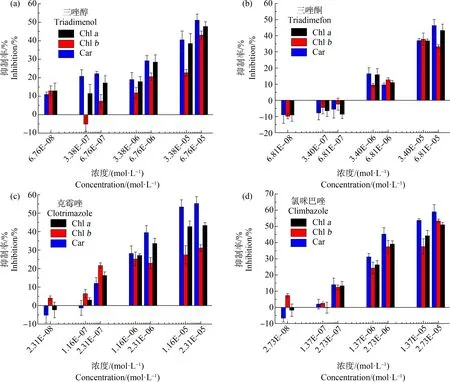
图2 4种唑类杀菌剂暴露96 h对蛋白核小球藻叶绿素a(Chl a)、叶绿素b(Chl b)和类胡萝卜素(Car)含量的影响Fig. 2 Effects of four azole fungicides on the chlorophyll a (Chl a)、chlorophyll b (Chl b) and carotenoid (Car) content of Chlorella pyrenoidosa after 96 h exposure
2.3 唑类杀菌剂对蛋白核小球藻的氧化损伤
2.3.1 对TP含量的影响
唑类杀菌剂对蛋白核小球藻TP含量的影响如图4所示。在4种唑类杀菌剂的作用下,蛋白核小球藻的TP含量表现出明显的浓度-效应关系,即随着污染物浓度的升高,TP含量的抑制率也随之升高,而且TP含量与污染物的浓度呈现良好的正相关(P<0.01)。其中,克霉唑对蛋白核小球藻的TP含量的影响存在着“低促高抑”的现象,最低浓度的促进作用达到28.6%。根据藻细胞的生长抑制率和TP含量变化的结果,蛋白核小球藻的氧化应激随污染物浓度的增加明显增强。

图3 毒性机理图Fig. 3 Toxicity mechanism diagram

图4 4种唑类杀菌剂暴露96 h对蛋白核小球藻生长和总蛋白(TP)含量的影响Fig. 4 Effects of four azole fungicides on the growth and total protein (TP) content of Chlorella pyrenoidosa after 96 h exposure
2.3.2 蛋白核小球藻对唑类杀菌剂的氧化应激反应

MDA的含量可以反映机体脂质过氧化的程度,间接反映出细胞的损伤程度[39]。由图5可知,蛋白核小球藻暴露于4种唑类杀菌剂96 h后,MDA的含量均随着污染物浓度的升高而升高。但是在低浓度下,MDA的产生受到抑制,这可能与ROS的产生受到抑制有关系。高浓度的污染物暴露下,MDA大量产生,尤其是三唑醇和氯咪巴唑2种污染物对MDA产生的促进作用分别达到131.98%和136.34%。这与最近的一些研究结果相似[43],蛋白核小球藻细胞中MDA的大量产生表明机体在唑类杀菌剂的刺激下产生氧化应激反应。
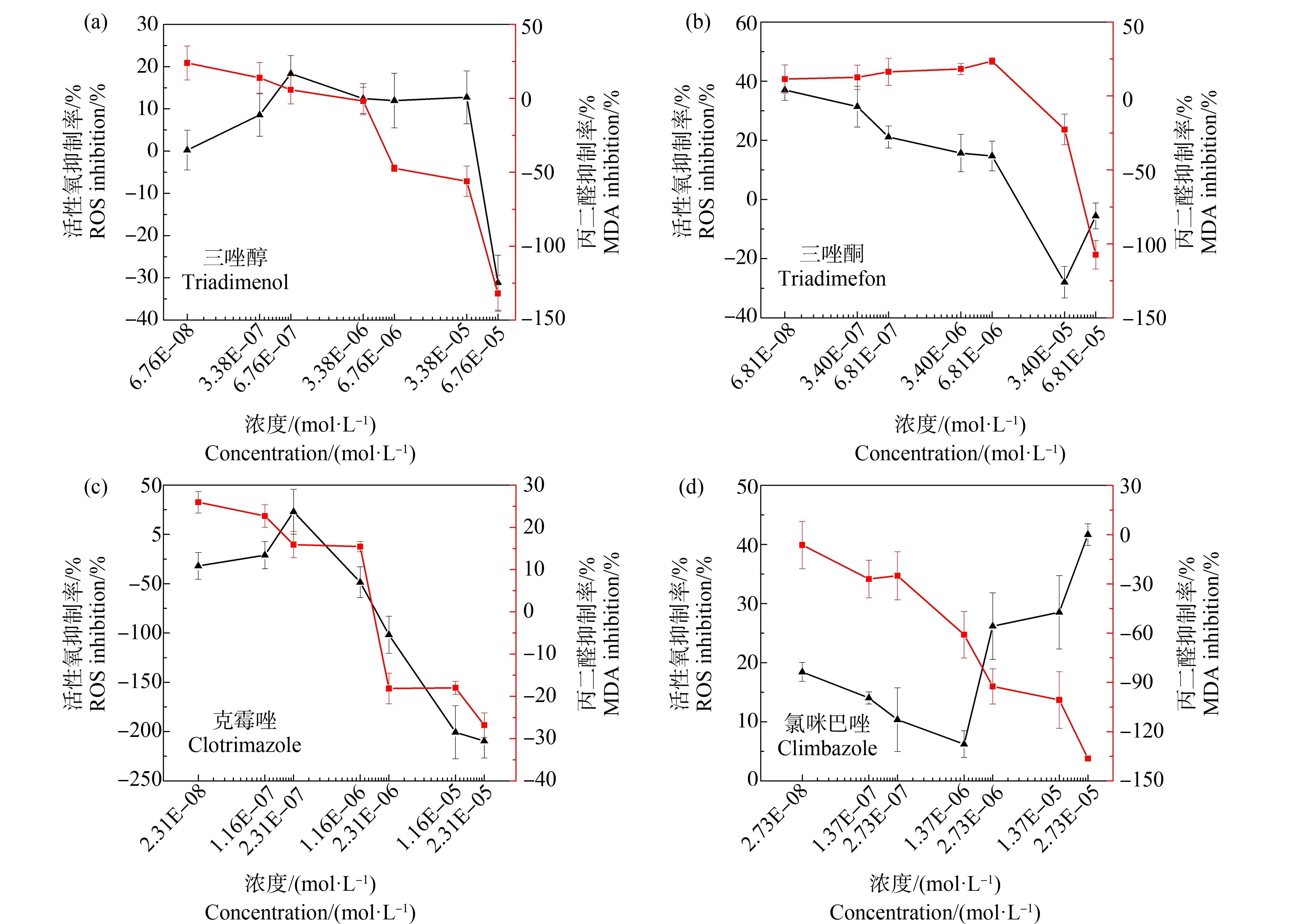
图5 4种唑类杀菌剂暴露96 h对蛋白核小球藻活性氧(ROS)和丙二醛(MDA)含量的影响Fig. 5 Effects of four azole fungicides on the reactive oxygen species (ROS) and malondialdehyde (MDA) content of Chlorella pyrenoidosa after 96 h exposure
CAT是生物体内另一种抗氧化酶,是防止细胞免受氧化应激损伤的第二道防线,CAT可以将H2O2还原为H2O和O2[41]。由图6可知,随着污染物浓度的升高,促进了CAT的产生,尤其是三唑醇、三唑酮和氯咪巴唑对CAT产生的促进作用明显,大小顺序为氯咪巴唑>三唑醇>三唑酮。但在氯咪巴唑高浓度作用下,CAT的促进作用逐渐减小,这可能与ROS产生受到的抑制变大有关。在中低浓度作用下,克霉唑对蛋白核小球藻细胞的CAT产生有抑制作用,但随着污染物浓度的升高,抑制作用降低,在最高浓度时出现促进。这可能因为在污染物刺激下ROS大量产生从而激发CAT合成酶的活性。
2.4 唑类杀菌剂对蛋白核小球藻的凋亡损伤
如图7所示,经过4种唑类杀菌剂处理96 h后,蛋白核小球藻出现不同程度的凋亡,而且随着污染物浓度的升高,毒性越大,细胞凋亡的程度越严重。这说明,唑类杀菌剂能够诱导蛋白核小球藻的凋亡,而且呈现出明显的剂量-效应关系。由细胞凋亡率曲线可知,4种污染物的毒性大小为三唑醇>克霉唑>氯咪巴唑>三唑酮。
3 讨论(Discussion)
唑类杀菌剂的高稳定性使其在环境中长期暴露,这对水生生物及人体健康造成了潜在的威胁。本研究根据唑类杀菌剂对蛋白核小球藻的96 h急性毒性,进一步揭示了不同污染物对蛋白核小球藻的致毒机理。4种唑类杀菌剂在96 h暴露下对蛋白核小球藻的毒性大小存在差异,根据生长抑制率曲线拟合得到的pEC50,判断其毒性大小为:氯咪巴唑>克霉唑>三唑醇>三唑酮。同时,本实验还通过检测细胞凋亡来判断唑类杀菌剂对蛋白核小球藻的急性毒性,其毒性大小为:三唑醇>克霉唑>氯咪巴唑>三唑酮。产生这种差异的原因可能与绿藻细胞的“休眠”有关,即绿藻细胞受到污染物刺激时形成的一种自我保护机制[46-47]。休眠状态下,绿藻细胞是完整的,只是将各种机能消耗降到最低,而PI染料可以染色丧失细胞膜完整性的细胞,无法染色保持了完整细胞膜的绿藻细胞。因此,相较于分光光度法,采用细胞凋亡检测方法判断蛋白核小球藻的细胞活性更加准确。
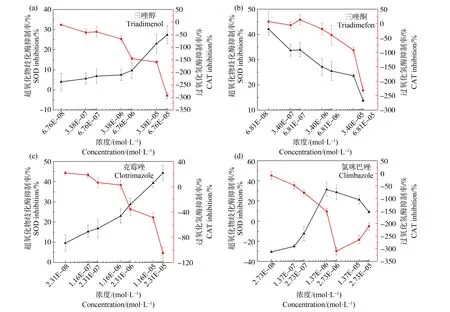
图6 4种唑类杀菌剂暴露96 h对蛋白核小球藻超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性的影响Fig. 6 Effects of four azole fungicides on the superoxide dismutase (SOD) and catalase (CAT) activities of Chlorella pyrenoidosa after 96 h exposure
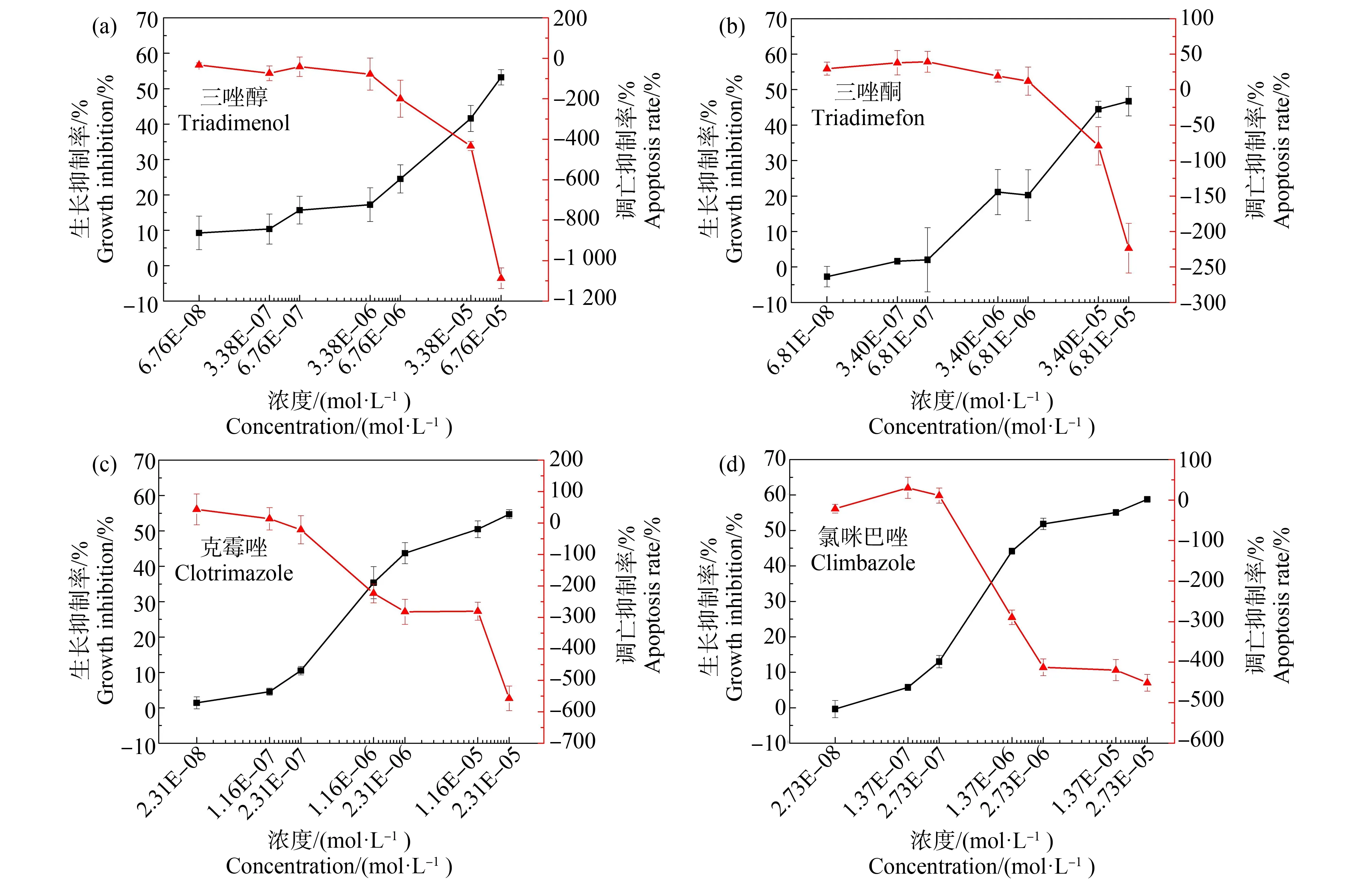
图7 4种唑类杀菌剂暴露96 h对蛋白核小球藻细胞凋亡的影响Fig. 7 Effects of four azole fungicides on the cell apoptosis of Chlorella pyrenoidosa after 96 h exposure
通过研究蛋白核小球藻对唑类杀菌剂的氧化应激反应发现,不同污染物对同一生物氧化抗氧化系统的影响不同。4种唑类杀菌剂在低浓度暴露下,ROS、CAT、SOD和MDA的产生均呈现不明显的抑制状态,说明在低浓度下,蛋白核小球藻可能通过其他的机制来耐受污染物,或者由于产生的ROS量过低,不能影响绿藻的正常代谢,不足以刺激抗氧化系统来清除ROS[48]。但是随着污染物浓度的升高,ROS的含量、MDA的含量以及抗氧化酶SOD和CAT的活性均出现了不同程度的促进或者抑制作用。在氯咪巴唑的暴露下,随污染物浓度的升高,ROS产生的抑制率先降低后升高,这可能是因为随污染物浓度的升高,ROS积累量增加,促进了MDA的大量产生,从而放大了ROS的作用,促进了抗氧化酶SOD和CAT的合成,加速了ROS的清除。当三唑醇、三唑酮和克霉唑作用于蛋白核小球藻时,污染物浓度的升高促进了ROS和MDA的大量产生,从而激发机体的抗氧化机制,SOD和CAT的活性增强,以清除多余的ROS。而随着三唑醇和克霉唑浓度的增加,SOD的产生受到抑制,抑制率与三唑醇和克霉唑的浓度正相关,这与郭庆亮[49]的研究结果相似。这可能是因为在高浓度暴露下SOD合成酶的活性并不能被成功激活,从而导致SOD的产生受到抑制。
蛋白质不仅是构成细胞的结构材料和各种反应进行的催化剂,也是植物体代谢变化的重要指标[35]。研究发现,4种唑类杀菌剂的暴露浓度越高,TP产生的抑制率升高,即TP含量降低。蛋白核小球藻对污染物的耐受能力有限,随着污染物浓度的升高,代谢能力降低,蛋白质分解,最终导致蛋白质含量降低。这种情况的产生与叶绿素含量的降低密切相关,叶绿体中光合作用产生的能量和有机物是植物体正常进行各种代谢活动的重要保证[31]。本研究也证明,随着污染物浓度的升高,产生了对Chla、Chlb和Car的抑制。其中,Chla是主要的光合色素,Chlb是植物体普遍存在的辅助色素[50],2种光合色素含量的降低必定会阻碍光合作用的正常进行。在植物体中,Car的积累和固定发生在叶绿体中,负责吸收光能传递给叶绿素,推动光化学过程。同时,Car还与叶绿素的结合蛋白有关,它的降低同样对蛋白质的合成产生影响[51]。
本实验进行了单一污染物对绿藻的急性毒性及其致毒机理的研究,然而环境中的农药是以各种形式和浓度共存,形成复杂的混合物并产生联合毒性[52]。因此,未来需要关注环境浓度下的唑类杀菌剂与其他污染物对藻类的联合毒性效应,并揭示其毒性机制,这将会对地表水体中唑类杀菌剂的生态风险评价及防治提供重要的依据。
