miR-760靶基因BATF3在非小细胞肺癌组织中的表达及其对肿瘤细胞恶性生物学行为的影响
2021-12-06李琼李秋燕张艳
李琼,李秋燕,张艳
(1. 兰州新区第一人民医院 重症医学科,兰州 730300;2. 永登县人民医院 心血管内科,兰州 730300;3. 兰州大学第一医院 麻醉科,兰州 730013)
肺癌是肺部最常见的恶性肿瘤,发病率和死亡率居恶性肿瘤首位[1],其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌发病率的80%以上[2]。目前,治疗NSCLC的方法有手术、化疗、放疗、免疫治疗和基因治疗等,但肺癌患者,尤其是晚期肺癌患者的5年生存率仅15%,早期诊断、早期治疗对提高患者的预后尤其重要[3],超过70%的NSCLC患者首次确诊时即为晚期。因此,迫切需要探究NSCLC的发生发展机制以推动临床诊治[4]。
miRNA是1类由18~28个核苷酸组成的非编码RNA分子,在基因表达的转录后调控中发挥重要作用并参与细胞的多种病理生理过程[5],一些miRNA已被报道具有抑癌或原癌基因的功能[6]。目前已发现490多种miRNA分子[7],miR-760是其中之一。更多的研究表明,miR-760表达的失调可见于多种恶性肿瘤,并与其生长、侵袭和转移有关[8-13]。miR-760通过调节Notch1/HES1-PTEN/AKT信号通路抑制肝癌细胞对阿霉素的耐药性[12];miR-760通过靶向SP1介导的PTEN/AKT信号通路抑制结直肠癌细胞的增殖和侵袭[13],但其在NSCLC病灶中的表达及功能尚不清楚。

1 资料与方法
1.1 研究对象
1.1.1 临床资料 收集2016年6月至2018年6月于兰州大学第一医院手术治疗的36例NSCLC患者肿瘤组织与癌旁正常组织,所有样本均置-80 ℃冰箱保存。患者年龄(48.0±4.6) 岁, 男性/女性为20/16。所有患者TNM分期均为T1或T2期,其中T1期17例, T2期19例, 肿瘤长径分别为(2.2±0.7) cm和(5.6±1.8) cm,患者术前均未接受任何形式抗肿瘤治疗。本研究获得兰州大学第一医院医学伦理委员会批准,所有患者或家属均自愿签署知情同意书。
1.1.2 实验材料 人传代NSCLC细胞系(A549、H1299和H23)及正常人传代肺上皮细胞(BEAS-2B),均购自北京北纳创联生物技术研究院。DMEM培养液、10% FBS、TRIzol试剂、反转录试剂盒、qRT-PCR扩增试剂盒、MTT和细胞凋亡检测试剂盒,均购自Sigma-Aldrich公司。miR-760模拟物(mimics)和阴性对照(negative control,NC)、pcDNA3.1-BATF3和空白对照(blank vector)、LipofectamineTM2000试剂盒,均购自Thermo Fisher Scientific公司。兔抗人多克隆BATF3抗体、兔抗人β-actin抗体和山羊抗兔IgG二抗,均购自Abcam公司。qRT-PCR引物由TaKaRa公司合成。
1.2 方法
1.2.1 细胞的培养与转染 将1.1.2细胞系冷冻管置于37 ℃温水浴中解冻,于37 ℃、5% CO2细胞培养箱中稳定3~4 h;用含10% FBS的DMEM培养液培养细胞,待铺底率达40%~50%时按LipofectamineTM2000 试剂盒说明书转染miR-760至培养细胞,完成操作后将转染液更换为正常细胞培养液继续培养。
1.2.2 RNA抽提与qRT-PCR检测 按照说明书通过TRIzol试剂从肿瘤组织和细胞系中提取总RNA。将抽提的RNA浓度稀释至500 ng/mL,用反转录试剂盒从总RNA中反转录cDNA。qRT-PCR检测miR-760和BATF3 mRNA的表达,扩增引物序列详见表1。反应条件:94 ℃ 2 min,1个循环;94 ℃ 30 s,62 ℃ 40 s,35个循环。结果用2-△△Ct法计算,实验重复3次。

表1 目标基因的引物序列

1.2.4 Western blotting检测目标蛋白的表达 添加蛋白裂解液至组织样本与细胞系,提取总蛋白;加入5×蛋白上样缓冲液后煮沸10 min,用10% SDS-PAGE分离蛋白,将其转移至PVDF膜。用5%脱脂奶粉溶液封闭载体膜1 h,加入兔抗人多克隆BATF3抗体(1∶1 000)于4 ℃条件下孵育过夜;PBS漂洗后加入山羊抗兔IgG(1∶8 000)室温孵育1 h,漂洗后滴加ECL液显影;通过凝胶成像系统获取蛋白质条带图片,用ImageJ软件分析结果,实验重复3次。
1.2.5 MTT法检测肿瘤细胞的增殖能力 分别取转染后24、48、72和96 h的A549细胞,用0.25%胰蛋白酶消化后,111.8×g离心5 min;用10% FBS调整细胞密度至1.0×103个/mL;将细胞接种于96孔板,加MTT(20 μL/孔)孵育4 h;PBS漂洗3次后每孔滴加150 μL二甲基亚砜,室温孵育15 min。通过酶标仪读取光密度[D(490 nm)]值,计算肿瘤细胞的增殖率。
1.2.6 Transwell法检测肿瘤细胞的迁移能力 将6×104个肿瘤细胞添加至200 μL无血清培养液中,过夜(饥饿)培养。用0.25%胰蛋白酶消化细胞后加入10% FBS调整细胞密度至1×106个/mL。取150 μL细胞悬液接种于Transwell上室,下室加入450 μL含10% FBS的培养液,于37 ℃、5% CO2培养箱中培养24 h。用90%甲醇固定,0.05%结晶紫染色,置倒置相差显微镜下计数。

2 结果
2.1miR-760mRNA在NSCLC肿瘤组织和细胞系中的表达qRT-PCR检测miR-760 mRNA在36例NSCLC患者肿瘤组织与正常癌旁组织中的表达。结果显示,miR-760 mRNA在NSCLC患者肿瘤组织中的表达量显著低于正常癌旁组织(P<0.01,图1A)。
qRT-PCR检测miR-760 mRNA在NSCLC细胞系(A549、H1299和H23)及正常人肺上皮细胞(BEAS-2B)中的表达。结果显示,miR-760 mRNA在NSCLC细胞系中的表达量显著低于正常肺上皮细胞,且在A549细胞中的表达量最低(均P<0.01,图1B)。

注:A. miR-760 mRNA在NSCLC肿瘤及正常癌旁组织中的相对表达量;B. miR-760 mRNA在NSCLC肿瘤细胞系、正常人肺上皮细胞中的相对表达量。与癌旁组织相比,**P<0.01; 与BEAS-2B组相比, ##P<0.01。图1 miR-760 mRNA在NSCLC肿瘤组织和细胞系中的表达
2.2BATF3mRNA在NSCLC肿瘤组织和细胞系中的表达qRT-PCR检测BATF3 mRNA在36例NSCLC患者肿瘤组织与正常癌旁组织中的表达。结果显示,BATF3 mRNA在NSCLC患者肿瘤组织中的表达量显著高于正常癌旁组织(P<0.01,图2A)。
qRT-PCR检测BATF3 mRNA在NSCLC细胞系(A549、H1299和H23)及正常人肺上皮细胞(BEAS-2B)中的表达。结果显示,BATF3 mRNA在NSCLC细胞系中的表达量显著高于正常人肺上皮细胞,且在A549细胞中的表达量最高(均P<0.01,图2B)。
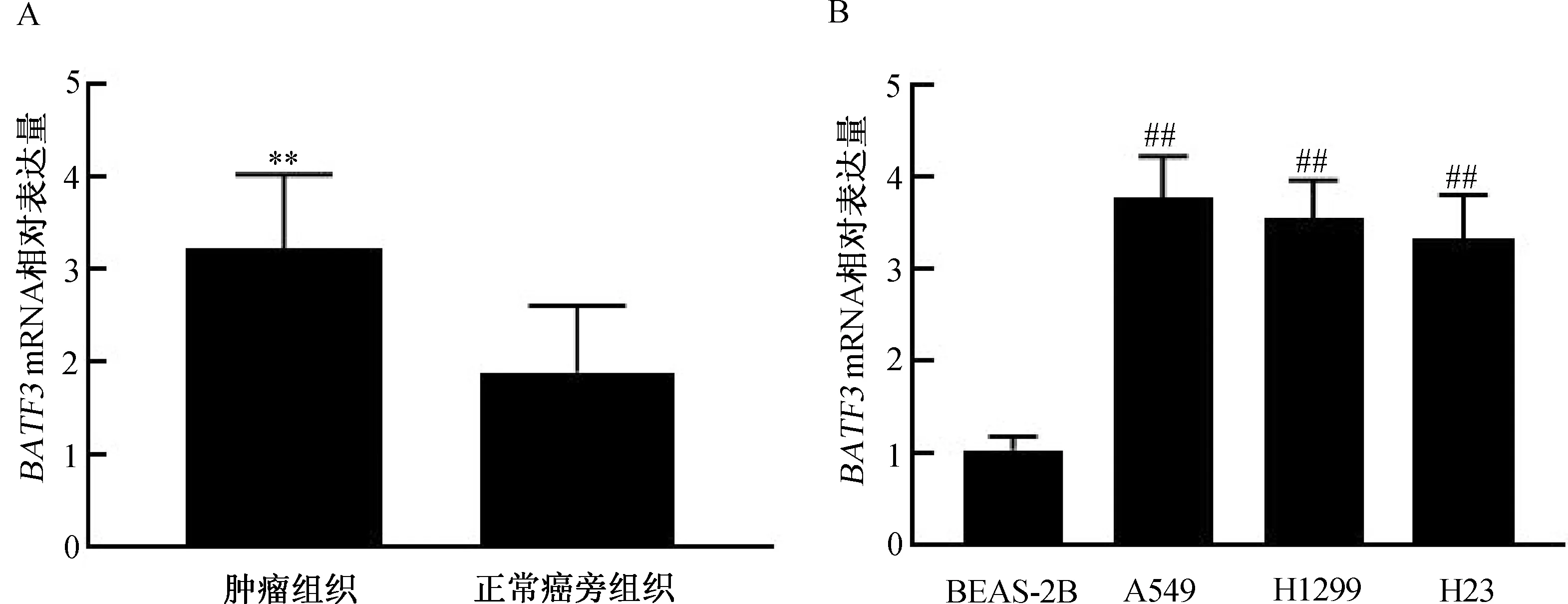
注:A. BATF3 mRNA在NSCLC肿瘤及正常癌旁组织中的相对表达量;B. BATF3 mRNA在NSCLC肿瘤细胞系、正常人肺上皮细胞中的相对表达量。与癌旁组织相比,**P<0.01; 与BEAS-2B组相比, ##P<0.01。图2 BATF3 mRNA在NSCLC肿瘤组织和细胞系中的表达
2.3 过表达miR-760对NSCLC肿瘤细胞系恶性生物学行为的影响由于A549细胞miR-760表达量较其他细胞低(图1),因此,选择将miR-760 mimics转染至A549细胞。qRT-PCR检测发现,转染操作后miR-760相对表达量显著上调(P<0.01,图3A)。过表达miR-760可显著抑制A549细胞的增殖和迁移(均P<0.01,图3B、3C)。

注:A. 转染实验后A549细胞miR-760的相对表达量;B. 转染miR-760对A549细胞增殖的影响;C. 转染miR-760对A549细胞迁移的影响(结晶紫染色,×400)。与miR-760 NC组相比,**P<0.01。图3 转染miR-760对A549细胞系恶性生物学行为的影响


注:A. BATF3 与miR-760的3'UTR可能存在结合位点;B. BATF3与miR-760的3'UTR结合位点;C. WT BATF3 3'UTR和Mut BATF3 3'UTR与miR-760的结合情况;D. miR-760 mimics转染A549细胞后对 BATF3蛋白表达的影响。与miR-760 NC组相比,**P<0.01。图4 BATF3是NSCLC细胞中miR-760的靶基因
2.5 miR-760靶向BATF3影响NSCLC细胞的恶性生物学行为将pcDNA3.1-BATF3转染至A549细胞,Western blotting检测发现BATF3蛋白表达显著上调(P<0.01,图5A)。经miR-760 mimics转染和pcDNA3.1-BATF3共转染,过表达BATF3显著促进了miR-760 mimics诱导的A549细胞的增殖和迁移(均P<0.01,图5B、5C),即miR-760与BATF3协同作用促进了NSCLC细胞的增殖和迁移。

注:A. pcDNA3.1-BATF3转染组与空白对照组BATF3蛋白的表达水平;B. BATF3转染对A549细胞增殖的影响;C. BATF3转染对A549细胞迁移的影响(结晶紫染色,×400)。与空白对照组相比,**P<0.01; 与miR-760 mimics+空白载体组相比, ##P<0.01。图5 miR-760靶向BATF3影响NSCLC细胞的恶性生物学行为
3 讨论
肺癌是国内最常见的恶性肿瘤之一,也是导致肿瘤相关死亡的主要原因之一[18]。NSCLC是肺癌中发生率和死亡率最高的肿瘤类型,许多患者在发现时已为晚期[19]。目前,肺癌的治疗手段主要是手术治疗辅以化疗,但患者的预后很差[20]。所以,提高患者早期诊断率、生存率和预后效果是亟待解决的问题,这迫切需要厘清NSCLC的发生发展分子机制。
miRNA除了参与细胞正常的生理过程,还参与肿瘤细胞的病理过程[21]。研究发现,miR-10a/b在髓系分化和急性髓系白血病的发生中发挥重要的调节作用[8],miR-140在结直肠癌上皮间质转化和肿瘤转移过程中发挥抑制作用[9]。miR-760是miRNA家族的重要成员,其异常表达与多种肿瘤的发生发展密切相关[13]。本研究发现,肿瘤组织中miR-760的表达量显著低于癌旁组织(P<0.01),这与Yan等[22]的研究结果一致,提示miR-760的异常低表达与NSCLC的发生发展有关。进一步研究发现,miR-760表达升高显著抑制NSCLC细胞系A549的增殖与迁移(均P<0.01)。
研究发现,BATF-/-小鼠Th17缺乏,并且对通常诱发类似多发性硬化症的自身免疫条件具有抵抗力[23]。BATF3是BATF家族的重要成员,研究发现BATF3的异常表达与多种肿瘤的发生发展密切相关[24-25]。本研究通过检测NSCLC组织与癌旁组织BATF3的表达发现,肿瘤组织BATF3的表达量显著高于癌旁组织(P<0.01);检测NSCLC细胞与正常肺上皮细胞发现,肿瘤细胞BATF3的表达量显著高于正常细胞(均P<0.01),这与Cao等[26]的研究结果一致,提示BATF3的异常高表达参与NSCLC的发生发展过程。
研究发现miR-150通过靶向PDCD4促进宫颈癌细胞的恶性发展[10];miR-1179通过靶向精子相关抗原5介导的AKT信号通路抑制人NSCLC细胞的生长和侵袭[11];miR-760通过靶向BATF3/AP-1/CyclinD1信号通路抑制人结直肠癌细胞的生长[26]。本研究通过质粒构建和荧光素酶报告基因实验发现,BATF3是miR-760的直接靶点;进一步将pcDNA3.1-BATF3转染至A549细胞,发现BATF3蛋白表达显著上调(P<0.01);A549细胞经miR-760 mimics转染和pcDNA3.1-BATF3共转染,发现过表达BATF3促进miR-760 mimics诱导的A549细胞的增殖和迁移,提示miR-760通过与BATF3互作抑制NSCLC细胞的增殖和迁移,即miR-760靶向BATF3调控NSCLC细胞系A549的恶性发展。
综上所述,miR-760在NSCLC组织与细胞系中低表达;BATF3在NSCLC组织与细胞系中高表达;miR-760的过表达能抑制NSCLC组织中BATF3的表达,miR-760靶向BATF3调控NSCLC细胞的恶性生物学行为。以上研究提示BATF3未来可能作为NSCLC的治疗靶标。
