硼替佐米为基础的化疗方案对多发性骨髓瘤患者肾功能及预后的影响*
2021-12-06黄海彬唐举贤陈琪
黄海彬,唐举贤,陈琪
南方医科大学第三附属医院血液科(广东广州510630)
多发性骨髓瘤(multiple myeloma,MM)属于恶性浆细胞疾病中最常见的一种,主要是由于骨髓中单克隆性浆细胞恶性增殖,分泌大量单克隆M 蛋白,损伤靶器官,常见的临床表现为骨痛、肾功能不全、贫血和感染[1-2]。随着医疗技术的不断发展及老龄化人口的不断增加,MM的发病率呈逐年上升的趋势,发病率约占恶性肿瘤的1%,血液系统肿瘤的10%,男性发病率高于女性,发病年龄多为50~60岁[3]。目前MM仍为不可治愈的疾病,发病机制尚不明确,常用的治疗方案包括化疗、造血干细胞移植、靶向治疗等[4]。以靶向药物为基础的治疗方案极大地提高了MM患者治疗的有效率,显著延长患者的生存时间[5-6]。硼替佐米于2003年经美国FDA批准上市,属于可逆性的蛋白酶体抑制剂,选择性地结合蛋白酶体的活性位点,可逆地抑制蛋白酶体活性,减少细胞核内NF-κB和IκB的降解,减少骨髓瘤细胞生长因子的分泌,促进肿瘤细胞的凋亡[7]。MM导致的肾功能损伤是影响患者预后和生活质量的主要因素,改善MM患者的肾功能是临床医生密切关注的重点。目前有关含硼替佐米的化疗方案对MM患者肾功能保护作用的研究尚少,且目前仍无足够的临床证据证明肾功能是否是影响含硼替佐米化疗方案治疗效果的关键因素。本研究回顾性分析以硼替佐米为基础的化疗方案对肾功能损伤的MM患者的治疗效果,进一步评价硼替佐米对MM患者肾功能的保护作用,为临床上MM患者规范化治疗提供依据。
1 资料与方法
1.1 一般资料 回顾性分析2011年10月至2017年8月至南方医科大学第三附属医院接受化疗的60例MM患者的临床病理资料,男38例,女22例,所有患者均符合NCCN的MM 指南(2016年第2版)中初发多发性活动型骨髓瘤的诊断标准[8]:(1)骨髓浆细胞比例大于15%,同时有原浆或幼浆细胞,或活检确诊为浆细胞瘤;(2)血清单克隆免疫球蛋白IgG>35 g/L,IgA>20 g/L,IgM>15 g/L,IgD>2 g/L,IgE>2 g/L,尿液中单克隆免疫球蛋白>1 g/24 h;(3)存在广泛的骨质疏松和(或)溶骨病变;符合(1)和(2)即可诊断为MM,全部符合即可诊断为进展性MM。纳入标准为:(1)未经治疗或治疗后效果不佳/复发的MM患者;(2)患者同意使用硼替佐米为基础的化疗方案进行治疗;(3)患者临床分期明确,可根据外周血和尿液等相关检查指标评估治疗效果。入组年龄>18岁且<80岁。排除标准为:(1)冒烟型(无症状性)骨髓瘤;(2)不分泌型骨髓瘤;(3)浆细胞白血病。采用国际分期系统(ISS)对所有患者进行临床分期:Ⅰ期、Ⅱ期、Ⅲ期。依据化疗方案分为观察组和对照组,两组患者的一般资料差异均无统计学意义(P>0.05),见表1。
表1 两组患者一般资料 ±s

表1 两组患者一般资料 ±s
项目 例数 年龄(岁)性别(例)ISS分期(例)M蛋白分型(例)男女 Ⅱ期 Ⅲ期 IgA型 IgG型 IgM 型 轻链型观察组30 57.2±11.5 18 12 9 21 8 14 3 5对照组 30 58.9±9.6 20 10 10 20 7 12 1 10 P值0.338 0.673 0.562 0.776
1.2 治疗方案 观察组患者均采用硼替佐米为基础的化疗方案,包括:VTD(硼替佐米+沙利度胺+地塞米松)、VCD(硼替佐米+环磷酰胺+地塞米松)和PAD(硼替佐米+脂质体多柔比星+地塞米松),硼替佐米剂量为:1.3 mg/m2,第1、4、8和11天静脉注射。对照组患者的化疗方案不含硼替佐米,包括:VD(长春新碱+地塞米松)、MP(长春新碱+地塞米松)、VAD(吡柔比星+长春新碱+地塞米松),共进行4个疗程化疗。
1.3 收集临床资料 初诊时询问病史,记录患者的年龄、性别、既往史等个人基本情况,每个疗程治疗前后均需完善血常规、肝肾功能、尿便常规、血清免疫球蛋白定量、血清蛋白电泳、血β2微球蛋白和骨髓X线等相关检查,评估患者的肾功能及治疗效果;记录患者治疗过程中及治疗后不良反应的发生情况;对所有患者进行为期2年的随访,记录患者的生存情况。
1.4 疗效评估 依据NCCN的指南(2016年第2版)中MM缓解标准评估患者的治疗效果,分为:完全缓解(CR)、很好的部分缓解(VGPR)、部分缓解(PR)、微小反应(MR)、疾病稳定(SD)和疾病进展(PD)。所有患者均随访2年,评估治疗效果。总有效率(ORR)=(CR+VGPR+PR)/总例数×100%。1.5 肾功能评估 通过外周血中肌酐(Scr)和尿素氮(BUN)的含量评估患者的肾功能,所有患者均空腹8 h以上,经静脉取血,离心后取血清备用,采用生化仪检测外周血中Scr和BUN的含量。
1.6 实验室检查 患者入院前和治疗后完善相关检查,记录外周血中免疫球蛋白的变化情况,评估两组患者的治疗效果。
1.7 不良反应评价 依据美国国立癌症研究院不良事件通用命名标准第四版(NCICTCAE 4.0)的标准对不良反应进行分级,记录各组患者于治疗期间和治疗后2年内不良反应的发生情况。
1.8 统计学方法 采用SPSS 22.0统计软件,组间比较采用两两样本独立t检验,计数资料采用χ2检验,Kaplan-Meier方法进行生存分析,以P<0.05为差异有统计学意义。
2 结果
2.1 化疗效果比较 观察组患者均完成4个疗程化疗,ORR为83.3%,对照组中有1例患者因严重的感染未完成4个疗程的化疗,有1例患者疾病进展,ORR为46.6%,显著低于观察组(P<0.01)。见表2。

表2 化疗4个疗程后的治疗效果比较 例
2.2 肾损伤的变化情况比较 治疗前两组患者外周血中Scr和BUN的含量差异无统计学意义(P>0.05),化疗4个疗程和随访2年时患者的肾功能均有所改善,观察组患者外周血中Scr和BUN的含量均显著低于对照组(P<0.01),见表3。其中,对照组中有1例患者因肾功能损伤加重放弃化疗,仅进行透析处理。
表3 肾损伤变化情况 ±s

表3 肾损伤变化情况 ±s
项目 Scr(μmol/L)BUN(mmol/L)治疗前 化疗4疗程 随访2年 治疗前 化疗4疗程 随访2年观察组 423.06±68.43 318.55±53.90 191.17±66.65 33.04±7.69 15.38±3.99 7.86±3.21对照组 453.13±92.82 482.01±129.53 387.19±97.59 35.79±5.51 36.56±6.52 25.11±5.76 P值>0.05 <0.01 <0.01 >0.05 <0.01 <0.01
2.3 免疫球蛋白变化情况比较 治疗前两组患者的免疫球蛋白间的差异无统计学意义(P>0.05),化疗4个疗程和随访2年,患者外周血中免疫球蛋白均有所降低,治疗后观察组患者外周血中免疫球蛋白均显著低于对照组(P<0.01)。见表4。

表4 治疗前后免疫球蛋白的变化情况 g/L
2.4 不良反应比较 与对照组相比,观察组患者外周神经毒性的发生率显著增加(P<0.05),血液学毒性(血小板减少、中性粒细胞减少、贫血)的发生率显著降低(P<0.05),感染的发生率显著降低(P<0.05)。见表5。

表5 不良反应比较 例(%)
2.5 生存分析 入组患者均至少随访2年,采用Kaplan-Meier方法进行生存分析,结果如图1所示,观察组患者2年生存率显著高于对照组(P<0.01)。
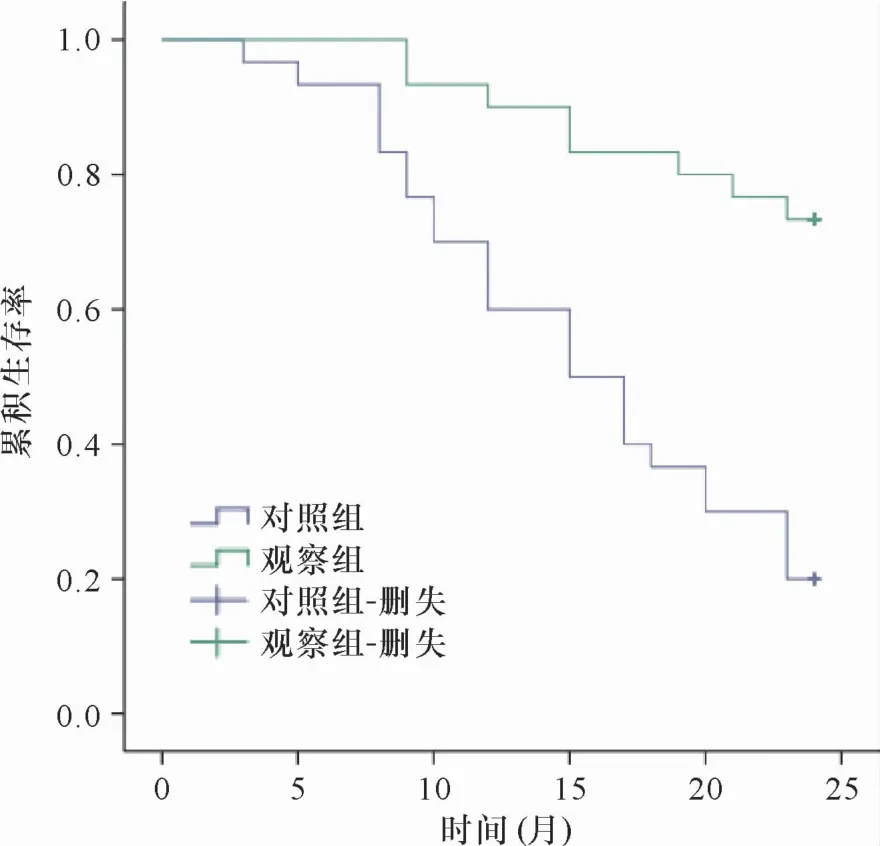
图1 两组患者2年生存曲线
3 讨论
MM是常见的血液系统恶性肿瘤,因临床分型和分期不同导致患者生存时间差别大,异基因造血干细胞移植是目前可治愈MM的唯一方法,但患者年龄和治疗成本是限制其在临床广泛推广的重要因素,故MM 患者的生存率很低[9]。新药时代使得MM的治疗取得突破性进展,如以硼替佐米、来那度胺等药物为基础的化疗方案使得MM患者的10年生存期显著延长[10]。Mushtaq等[11]对临床上MM常用的化疗方案进行Meta分析,结果提示初治的MM患者采用VCD方案进行化疗,其治疗有效率显著优于VAD方案,显著提高患者的总生存率。2018年NCCN指南仍推荐初治、复发难治和移植后患者将硼替佐米为基础的化疗方案作为一线治疗方案[12]。为了更好地分析硼替佐米对肾功能损失的MM患者的治疗效果及对肾功能的保护作用,本研究回顾性分析以硼替佐米为基础的化疗方案(VTD、VCD和PAD)与传统化疗方案对肾功能损伤的MM患者预后的影响,结果发现含硼替佐米的化疗方案组患者的ORR为80.0%,而不含硼替佐米的化疗方案组患者的ORR仅为46.7%。本研究还发现以硼替佐米为基础的化疗方案还可有效降低MM治疗期间血液学不良反应和感染的发生率,增加患者的2年生存率,硼替佐米作为可逆性的蛋白酶体抑制剂,不仅能作用于泛素和蛋白酶体,促进肿瘤细胞凋亡,还可影响骨髓微环境中细胞因子的释放和循环,阻止细胞粘连,增强骨髓瘤细胞对化疗药物的敏感性[13]。硼替佐米与来那度胺、地塞米松和马法兰等多种药物均在疗效上均具有协同作用,可显著增加化疗方案对MM患者的治疗有效率[14-15]。免疫球蛋白的含量可有效用于MM的诊断及MM患者治疗后效果的评估,在MM的诊断分型和预后判断方面具有重要的意义[16],本研究发现观察组患者完成化疗后免疫球蛋白的含量明显降低,该结果与Meziane等[17]的研究结果相一致。
MM患者常见的不良反应包括肾功能不全,早在2009年美国肾脏病临床研究数据就提示肾功能衰竭是导致MM患者死亡的重要因素[18]。MM患者分泌的单克隆轻链超出肾小管重吸收程度,过多的游离轻链聚集于远端肾小管,形成管型并阻塞肾小管,形成“管型肾病”,导致肾功能损伤[19]。游离轻链还可激活核因子κB(NF-κB),促进肾脏中炎症因子和肿瘤坏死因子的释放,进一步损伤肾小管上皮细胞[20]。本研究发现,Ⅱ期或Ⅲ期肾功能损伤的MM患者采用硼替佐米为基础的方案进行化疗时不需调整硼替佐米的剂量,在治疗期间患者的肾功能有所恢复,且治疗效果佳。硼替佐米不通过肾脏代谢,肾功能与硼替佐米的治疗效果间无相关性[21]。本研究对MM患者进行为期2年的随访,进一步发现与常规化疗方案相比,采用硼替佐米为基础化疗方案的患者外周血中Scr和BUN的含量显著降低,肾功能可获得显著的恢复。硼替佐米抑制蛋白酶体20S亚单位的活性,抑制NF-κB的活性,降低肾功能损伤,也是逆转MM患者肾功能损伤的重要原因[22-23]。上述结果高度提示,伴有严重肾功能损伤的MM患者采用硼替佐米为基础的化疗方案可显著改善患者的肾功能,提高治疗有效率,改善预后。
骨髓瘤细胞分泌的单克隆M蛋白直接压迫神经根可导致周围神经病变,同时,大量的临床研究证据也高度提示硼替佐米具有严重的外周神经毒性[24]。本研究发现采用硼替佐米为基础的化疗方案可显著增加MM患者外周神经毒性的发生率,患者使用硼替佐米的剂量越大则不良反应越严重,呈明显的剂量依赖性,该结果高度提示在临床上使用硼替佐米时应密切关注神经毒性的发生率,并提前进行预防处理。硼替佐米导致外周神经毒性的机制尚不明确,Corthals等[25]研究认为硼替佐米对周围神经中蛋白酶体活性的抑制作用可破坏线粒体介导的Ca2+细胞内环境的稳态,进而产生外周神经毒性。Koh等[26]研究发现硼替佐米采用皮下注射时可外周神经毒性的发生率显著低于静脉注射,给予营养神经药物进行对症处理也可有效降低不良反应的发生率。
综上所述,本研究结果发现以硼替佐米为基础的化疗方案可显著提高MM患者的治疗有效率,改善肾功能,显著提高MM患者的生存率。
