miR-200b在辐射诱导胸腺淋巴瘤中的作用及其机制的初探
2021-12-06冯珍兰蔡建明蒋建明
叶 晖,冯珍兰,程 赢,蔡建明,蒋建明
(1.海军军医大学第一附属医院,上海 200433;2.温州医科大学公共卫生与管理学院,浙江 温州 325035;3. 海军军医大学海军医学系,上海 200433)
电离辐射作为一种公认的环境致癌因素,在电离辐射暴露后的远后效应中,辐射致癌是公众关注的焦点。辐射致癌是一个十分复杂的过程[1-3]。流行病学研究表明,长期暴露于较低剂量辐射的人群患癌风险会增加,高剂量或高剂量率的电离辐射会显著增加癌症罹患率[4]。为进一步研究辐射致癌机制,我们以BALB/c小鼠为研究对象,建立了辐射诱导胸腺淋巴瘤(Radiation Induced Thymic Lymphoma, RITL)模型[5]。在该模型中,我们发现miR-21、miR-200c等miRNAs在RITL组织中异常表达,而在正常胸腺组织中表达水平较低[6-7]。
miRNAs是一类长度约22个核苷酸、内源性、呈单链短发卡结构的非编码小RNA分子,可以沉默靶标mRNA,并以转录后方式调控靶标基因的表达[8-10]。研究表明,miRNAs广泛参与人类癌症进程,miRNAs的缺失或功能障碍会导致癌症的进展。例如,miR-143和miR-145作为肿瘤抑癌基因,在胃肠道肿瘤、乳腺癌、肺癌脑转移过程中发挥重要作用[11-13]。
为了探讨miR-200b在辐射诱导胸腺淋巴瘤中的作用与初步机制,在本研究中,我们首先建立RITL动物模型,检测miR-200b在RITL样本中的表达水平,随后通过构建miR-200b敲低和过表达细胞系,检测miR-200b表达变化对细胞增殖及凋亡的影响,并在此基础上利用miRNA数据库TargetScan预测miRNA潜在靶点,以进一步探究其可能的通路,最终明确miR-200b在辐射诱导胸腺淋巴瘤中的作用及其初步机制。
1 材料和方法
1.1 主要试剂及仪器
胎牛血清购自美国Gibco公司,培养基、EDTA-胰酶、磷酸盐缓冲液(PBS)购自美国Hyclone公司,电转试剂(Amaxa Cell Line Nucleofector Kit)购自德国Amaxa公司,CCK-8(Cell Counting Kit-8)试剂购自日本同仁化学试剂公司,Annexin V-FITC/PI-PE凋亡试剂盒购自北京全式金公司,TRIzol试剂购自美国InvitroGen公司,miR-NC、miR-200b、Anti-miR-NC、Anti-miR-200b、TBK1质粒为上海吉玛公司产品。双荧光素酶报告系统购买自Promega公司。荧光定量PCR仪为美国Thermofisher产品,流式细胞仪为美国Backman产品,酶标仪为BioTek产品。
1.2 动物饲养与模型建立
4~5周龄,雄性BALB/c小鼠购自海军军医大学实验动物中心。每笼小鼠5~7只,体重(16±2) g,养于日夜交替采光、24 ℃恒温动物房中。采取小鼠全身分隔照射的方式构建小鼠RITL模型,1.75 Gy/次(剂量率:0.58 Gy/min),1次/周,共4周。照射后15个月后检测BALB/c小鼠成瘤情况。照射源为海军军医大学辐照中心60Co γ射线源。
1.3 细胞培养和转染
小鼠胚胎成纤维细胞NIH/3T3购自美国模式培养物集存库(ATCC, American Type Culture Collection),培养条件为DMEM+10%胎牛血清+1%双抗,置于37 ℃、5% CO2的培养箱中培养,每日换液,隔日传代。按照转染miRNAs的不同将细胞分为miR-NC、miR-200b、Anti-miR-NC、Anti-miR-200b四组,随后采用电穿孔法转染miRNAs。miRNAs序列如下:miR-200b: 5’ -UAAUACUGC CUGGUAAUGAUGA-3’;anti-miR-200b: 5’-AU CAUUACCAGGCAGUA UAAAU-3’;miR-NC: 5’-UUCUCCGAACGUGUCAGGUTT-3-3’;anti-miR-NC: 5’ -UUGUACUACACAA AAGUACUG-3’。
1.4 RNA提取及QRT-PCR
采用Trizol法按照说明书提取总RNA,采用260/280 nm比值法测定样品的RNA纯度和浓度。采用上海吉玛公司的Hairpin-itTM miRNA反转录及qRT-PCR试剂盒。以GAPDH为内参,使用比较Ct法计算miRNA的相对表达水平。miR-200b-3p引物:R 5’-GTCGTATCCAGTGCAGGGTCCGA GGTATTTCGCACTGGATACGACTCATCA-3’,F 5’-GCCGGT AGCTTATCAGACTGA-3’。GAPDH引物:F 5’-AATGGATTTGGACGCATTGGT-3’,R 5’-TTTGCACTGGTACGTGTTGAT-3’。
1.5 细胞活力与凋亡检测
miRNAs转染后24小时进行细胞活力与细胞凋亡的检测。细胞活力利用酶标仪,采用CCK-8试剂进行检测,相对细胞活力(%)=(A处理-A空白)/(A对照-A空白)×100%。细胞凋亡采用流式细胞术进行检测,细胞进行Annexin V-FITC/PI-PE双染色,室温孵育15 min后进行流式细胞术分析,凋亡率=100%-左下象限%(FITC-/PE-)。
1.6 miRNA靶点预测和荧光素酶测定
利用miRNA数据库TargetScan(http://www.targetscan.org/index.html)分析miRNA潜在靶点。采用Promega公司双荧光素酶报告系统按照说明书检测荧光素酶活性。
1.7 TBK1蛋白水平流式检测
细胞消化后离心,经75%乙醇固定、 0.5% Triton-X打孔后,使用PBS重悬,按照1∶1 000的抗体浓度标记胞内TBK1,室温孵育15 min后采用流式细胞仪检测。
1.8 统计分析
采用SPSS 19.0统计软件进行分析,符合正态分布的数据以均值±单次测量标准差表示。两组之间的差异情况采用两独立样本t检验进行比较。单因素方差分析(ANOVA)用于符合正态分布且方差齐的3组及3组以上之间差异的比较。采用Spearman相关分析方法分析TBK1蛋白与miR-200b表达水平的相关性,p<0.05为差异具有统计学意义。
2 结果
2.1 miR-200b在RITL组织的表达情况
为了检测miR-200b在RITL组织中的表达,我们首先在3对RITL组织样本(样本T1、T2和T3)中进行micro-array,以小鼠的正常胸腺组织样本(N1、N2、N3)作为对照,结果示于图1。如图1A所示,miR-200b在RITL样本(T1、T2、T3)中的表达水平显著下降。随后对9对RITL组织和正常胸腺组织中的miR-200b进行qRT-PCR验证,如图1B所示,在RITL组织中miR-200b水平明显低于正常胸腺组织。表明miR-200b在RITL组织中显著下调,提示miR-200b可能在RITL中发挥作用。

(A) miR-200b在RITL和正常胸腺组织中的表达水平;(B) qRT -PCR检测9对RITL组织和正常胸腺组织中miR-200b的相对表达,将每对正常胸腺组织中miR-200b的相对表达水平归一化为1;N:正常胸腺组织,T:RITL组织。
2.2 过表达与敲低miR-200b细胞模型的建立
随后以NIH/3T3细胞为实验对象,通过转入miR-NC、miR-200b、Anti-miR-NC、Anti-miR-200b构建miR-200b过表达与敲低细胞模型,并采用qRT-PCR验证,结果示于图2。如图2所示,miR-200b电转可上调NIH/3T3细胞内miR-200b水平8倍左右,而Anti-miR-200b电转可下调NIH/3T3内miR-200b表达水平约40%~50%。

图2 miR-200b过表达与敲低细胞模型的建立
2.3 过表达或敲低miR-200b对细胞增殖及凋亡的影响
为了检测miR-200b表达水平对细胞增殖的影响,我们采用CCK-8检测细胞增殖,结果示于图3。如图3A/B所示,过表达miR-200b可抑制NIH/3T3细胞增殖,敲低miR-200b则促进NIH/3T3细胞增殖。随后通过流式细胞仪检测细胞凋亡,发现如图3C/D所示过表达miR-200b后NIH/3T3细胞凋亡率显著升高,而敲低miR-200b后NIH/3T3细胞凋亡率降低。这表明过表达miR-200b可明显抑制细胞增殖,增加细胞凋亡,而下调miR-200b后可促进细胞增殖,抑制细胞凋亡。
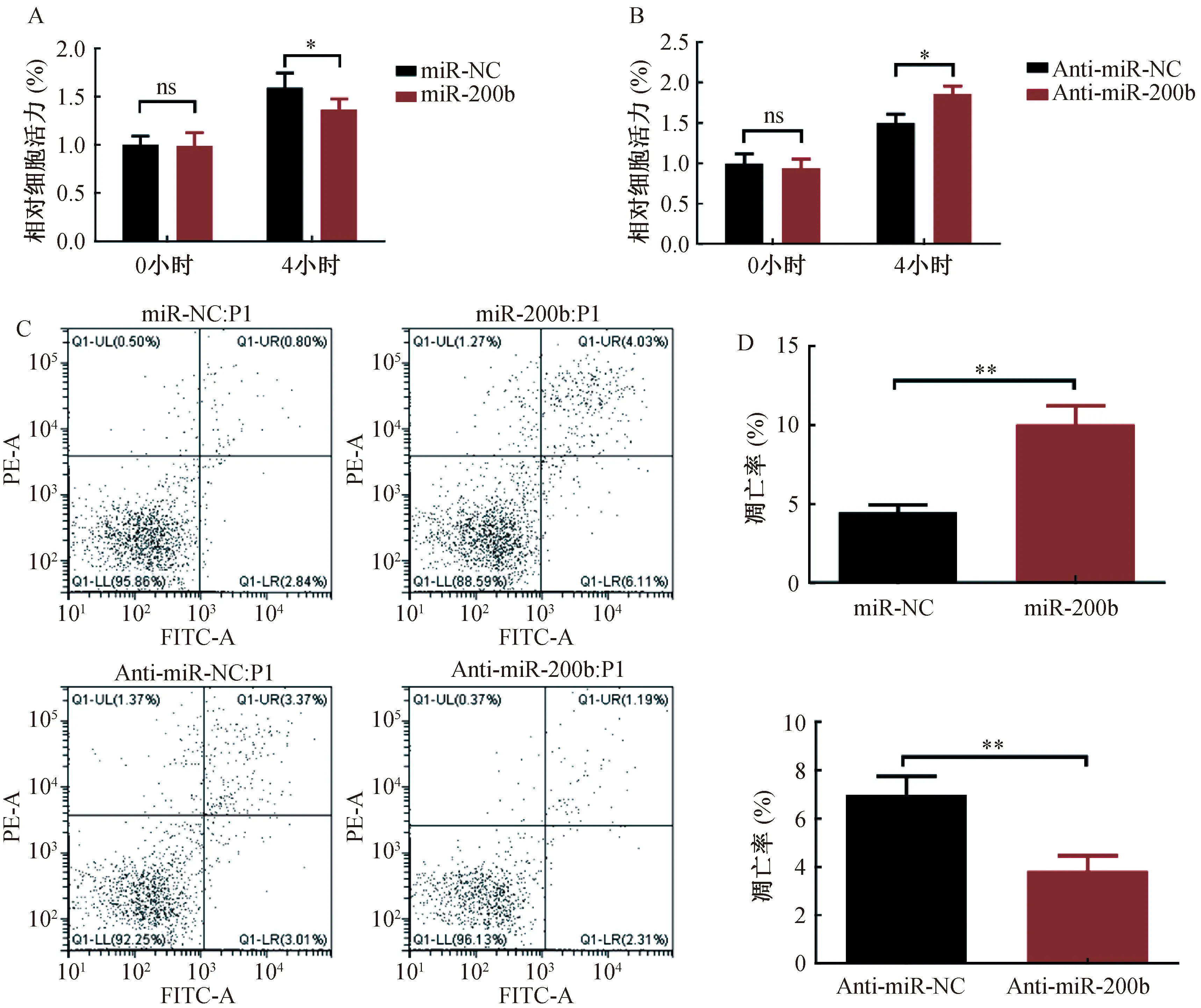
(A/B) CCK-8检测细胞活力,(C/D) 流式细胞仪检测细胞凋亡。
2.4 miR-200b潜在作用靶点的预测与验证
为了探讨miR-200b的潜在作用靶点,我们利用miRNA数据库TargetScan进行预测,发现TBK1的3’UTR序列能够与miR-200b序列互补配对,这提示TBK1可能是miR-200b的潜在作用靶点。随后通过突变TBK1的3′UTR结合位点(图4A),发现与无miRNAs组和阴性对照组相比,miR-200b使野生型TBK1 3′UTR组的荧光素酶活性显著降低,而对突变TBK1 3′UTR组的荧光素酶活性没有显著影响(图4B),这表明miR-200b可能以3’UTR依赖的方式靶向TBK1。

(A)通过miRNA数据库TargetScan分析miR-200b潜在靶点;(B)双荧光素酶报告分析系统。
2.5 RITL组织中TBK1与miR-200b表达水平的相关关系
为了进一步探讨miR-200b与TBK1的关系,我们通过流式细胞术检测9对RITL组织和正常胸腺组织单细胞悬液中TBK1的蛋白表达水平,并通过qRT -PCR检测这9对RITL组织和正常胸腺组织中miR-200b的表达水平。研究结果如图5所示,RITL组织内TBK1表达显著上调,TBK1蛋白表达水平与miR-200b表达呈负相关关系,这提示miR-200b通过抑制TBK1的mRNA翻译来靶向抑制TBK1,即miR-200b转录后负调控TBK1表达。

(A/B/C/D) 流式细胞术和QRT-PCR检测9例RITL组织和胸腺组织中TBK1和miR-200b的表达水平;(E) Spearman相关分析检测TBK1和miR-200b表达水平的相关性。
2.6 TBK1对miR-200b介导生物学作用的影响
为了进一步研究TBK1是否介导了miR-200b的作用,将miR-200b与TBK1共转染NIH/3T3细胞,结果如图6所示。流式细胞术结果显示,与对照组相比,miR-200b组TBK1蛋白表达降低,而miR-200b+TBK1组TBK1蛋白表达升高。与miR-200b组相比,miR-200b+TBK1组细胞显著增殖、凋亡率下降。这表明TBK1逆转了miR-200b促凋亡和抑制增殖的作用。
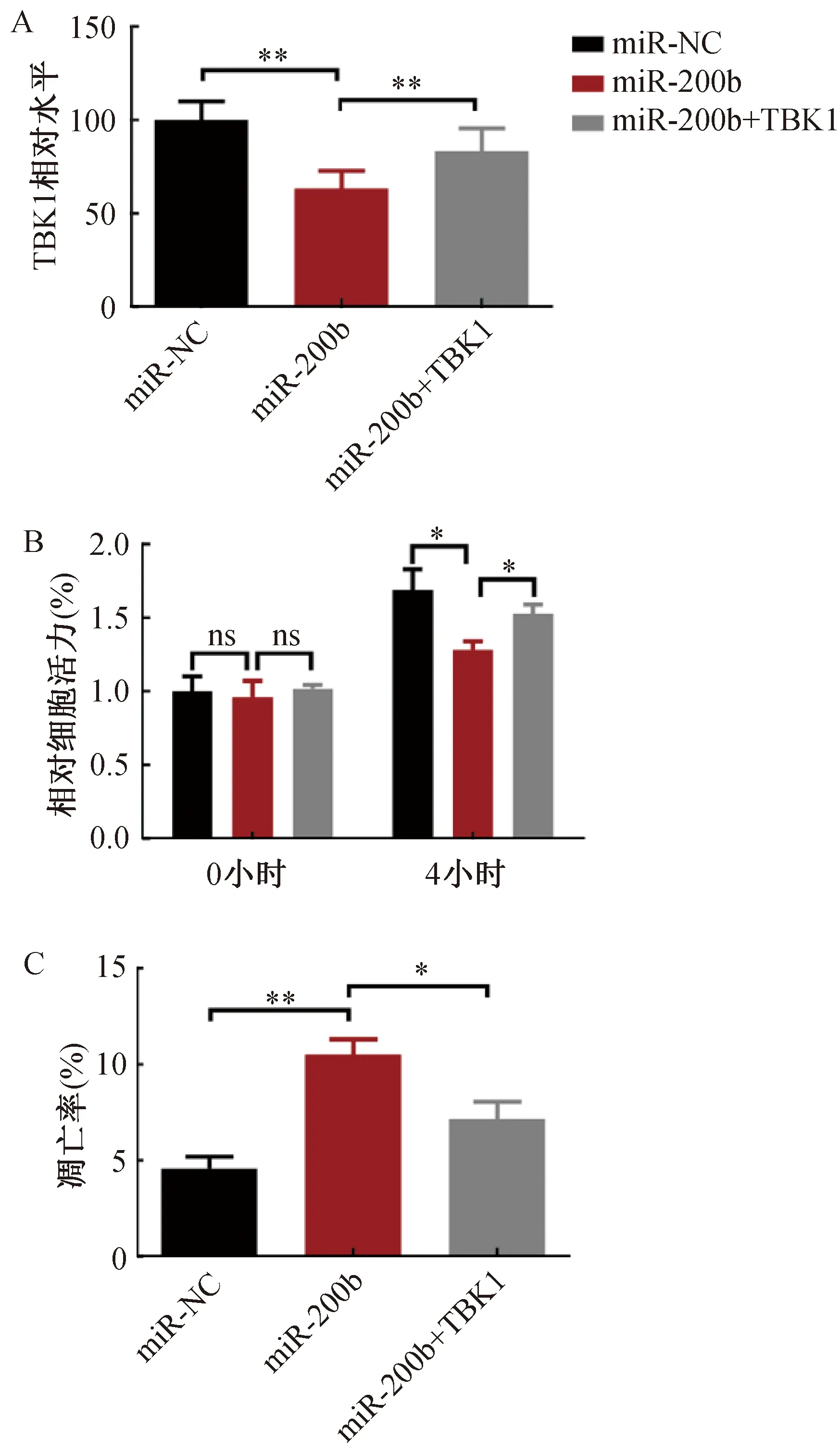
(A) 流式细胞仪检测TBK1相对表达水平;(B) CCK-8法检测细胞活力;(C) 流式细胞仪检测细胞凋亡。
3 讨论
辐射致癌是辐射暴露后严重的远后效应之一,越来越受到辐射相关专业人员和公众的关注。电离辐射作为一种强致癌因素,可诱发、促进肿瘤进展。对广岛和长崎原子弹爆炸幸存者进行的流行病学研究发现,高剂量和高剂量率电离辐射显著增加了患实体瘤和白血病的风险[14-16]。Kei Nakachi等对原子弹爆炸后幸存者中结直肠癌患者研究发现,辐射暴露可能通过微卫星不稳定性(MSI)促进结直肠癌的发生[15]。此外,长期受到较低剂量辐射照射的辐射工作者群体的随访结果也提示罹患肿瘤的风险增加[17-18]。尽管辐射可致肿瘤发生的风险增加这一事实已被公认,但辐射致癌的机制尚不清楚[19-20]。国内外围绕这一难点开展过不少研究,既往研究发现,电离辐射暴露会导致肿瘤微环境内的“炎症转换”,会激活促存活的肿瘤相关通路,通过影响HIF-1α调节肿瘤微环境中辐射诱导的缺氧与血管生成、通过调节金属基质蛋白酶重构细胞外基质等。其中NF-κB、HIF和STAT信号通路是调控辐射致癌进程中的关键信号通路,可通过调控多个下游基因介导辐射诱导的癌变[21]。
作为辐射致癌的一种,辐射诱导的胸腺淋巴瘤不仅是事故性暴露人群中常见的辐射远后效应之一,也是临床上胸部肿瘤患者放疗后急需关注的重要问题之一。目前关于辐射致癌的具体机制仍不清楚。miRNA作为一种非编码RNA小分子,已被证明在肿瘤发生、肿瘤进展等生物学进程中发挥关键作用,这使得识别癌症特异性或与相关miRNA及其靶点对于更好地理解肿瘤发生机制至关重要[22-23]。本课题组通过构建RITL模型,已发现多条在RITL的发生和发展中起重要作用的miRNAs,包括miR-21、miR-143、miR-486等[5,7]。在本研究中,我们发现与正常胸腺组织相比,miR-200b在RITL中显著下调,这提示miR-200b可能为抑癌miRNA。随后通过构建敲低与过表达细胞株,通过CCK-8与流式细胞术检测转染miRNAs的NIH/3T3细胞的增殖与凋亡情况,以确定miR-200b对体外细胞的影响。结果显示,过表达miR-200b可明显抑制细胞增殖,增加细胞凋亡,而下调miR-200b后可促进细胞增殖,抑制细胞凋亡。
TANK结合激酶1(TBK1)作为非经典IκB激酶(IKK),在核转录因子(NF-κB)信号通路中发挥着重大作用,且不同于经典IKK,TBK1能够磷酸化干扰素调节因子3(IRF3)和干扰素调节因子7(IRF7),调节Ⅰ型干扰素表达水平,在维持免疫系统稳态中发挥重大作用[24-26]。TBK1在肿瘤、免疫、自噬等发生发展过程中发挥关键作用[27-28],已经成为肿瘤免疫治疗的潜在治疗靶点[29-30]。本研究通过miRNA靶点预测和双荧光素酶报告基因的使用,确认TBK1为miR-200b的直接作用靶点,且TBK1蛋白表达量与miR-200b表达量呈负相关。随后通过功能回复实验发现TBK1可部分逆转miR-200b促进细胞凋亡和抑制细胞增殖的作用,证明miR-200b通过靶向TBK1发挥促进细胞凋亡和抑制细胞增殖的生物学效应,提示miR-200b可能通过抑制TBK1,从而发挥抗RITL的作用(见图7)。

图7 下调miR-200b通过靶向TBK1促进辐射诱导的胸腺淋巴瘤进展
综上所述,我们的结果表明,辐射诱导胸腺淋巴瘤组织中miR-200b表达下调,而其直接靶点TBK1表达上调,这提示靶向调控miR-200b/TBK1,可为防治辐射诱导胸腺淋巴瘤提供一种潜在的新途径。
