有机肥/秸秆替代化肥模式对设施菜田土壤氮循环功能基因丰度的影响
2021-12-05栾好安唐继伟李明悦黄绍文
马 龙,高 伟,栾好安,唐继伟*,李明悦,黄绍文*
(1 中国农业科学院农业资源与农业区划研究所/农业农村部植物营养与肥料重点实验室, 北京 100081;2 天津市农业资源与环境研究所, 天津 300192;3 河北农业大学林学院, 河北保定 071000)
目前,我国蔬菜体系分为设施蔬菜和露地蔬菜两类,设施蔬菜因其产值高、集约化程度高、不受季节因素干扰而得到迅速发展。然而,设施蔬菜生产过程中普遍存在肥料过量、施肥模式不合理等导致土壤速效养分(氮、磷等)大量富集、有机质含量下降、地下水硝酸盐含量严重超标等问题[1–2]。有报道称有机肥与无机肥配施能减轻硝酸盐污染,且施用高碳氮比有机物料可加快土壤硝态氮同化,进而将硝态氮转化为微生物量氮储存,减少氮损失[3]。针对上述问题,在合理施肥的基础上使用有机肥/秸秆替代化肥可使设施蔬菜化肥减施潜力达35%以上[4]。
土壤氮循环包括硝化、反硝化、氮素固定、厌氧氨氧化和硝酸盐还原过程。硝化与反硝化过程是氮素转化的主要过程[5]。硝化过程指土壤有机氮矿化或来自肥料的铵态氮在好氧微生物作用下转化为硝态氮的过程,反硝化过程则是利用土壤中的硝态氮经多种酶促反应转化为气态氮的过程[6]。微生物是驱动土壤氮循环的重要载体和介质,不同氮素循环过程均有起主导作用的功能基因,如在N2固定过程中的NifH、硝化过程的AmoAB及反硝化过程的NarG、NapA、NirKS及NosZ,硝酸盐异化还原过程的NirBD及NrfAH[7–10]。在农田生态系统中,除气温、降水外,施肥对土壤氮循环过程影响较大[11–12],不同施肥方式对功能性微生物结构和丰度的影响不同,尤其化肥配施有机肥模式的影响更大[9,13–14]。然而,必须意识到土壤氮循环各过程均是相互关联的,仅研究单一氮循环功能微生物可能无法综合评估施肥模式对其影响。近年来,随着宏基因组测序的发展,可以在一个生态系统中同步进行多个氮循环功能基因研究,即在深度测序的基础上通过与KEGG数据库进行比对,筛选出氮循环过程功能基因及其丰度,全面综合评估由施肥模式引起的氮循环功能基因丰度差异。设施菜田由于封闭性、可控性、缺少降雨淋洗等特点,施肥对土壤氮循环过程影响较大[11–12]。盛果期作为果菜生长发育的关键时期,对土壤养分的需求量较高,土壤微生物代谢活动剧烈[15–16]。因此,利用天津市西青区基地日光温室蔬菜有机肥/秸秆替代化肥定位试验,采用宏基因组测序方法,根据KEGG数据库KO00910氮循环通路(https://www.kegg.jp/pathway/map00910),研究分析了番茄盛果期不同施肥模式下土壤氮循环功能基因的主要种类和丰度,旨在分析硝化潜势(PNR)、N2O排放及相应的功能基因的相互关系,为设施菜田制定合理高效的施肥方案提供科学依据。
1 材料与方法
1.1 试验区概况
本定位试验位于天津市农业科学院农业资源与环境研究所西青区辛口镇第六埠村 (117°0′E,39°13′N),试验区属于暖温带半湿润大陆性气候,全年平均温度11.6℃,自然降水量586 mm,无霜期203天,日照总量2810 h。供试日光温室东西走向,长 80 m,宽 6.5 m (含 0.5 m 通道),温室前部有通风口,白天适时敞开通风,夜间或降雨时关闭。供试土壤类型为中壤质潮土。定位试验起始时间为2009年10月(定位试验开始时棚龄为7年),种植制度为春茬番茄–秋冬茬芹菜轮作。定位试验开始前0—20 cm 土层基本理化性质为:pH 7.9、有机质 25.4 g/kg、硝态氮 186.2 mg/kg、速效磷 144.6 mg/kg、速效钾404.0 mg/kg。供试芹菜 (Apium graveolens)品种为‘文图拉’,番茄(Lycopersicon esculentum)品种为‘朝研299’。
1.2 试验设计
选取定位试验来源于化肥(CF)、有机肥(M)和玉米秸秆(S)养分比例不同的等氮磷钾投入量的6个处理,分别为:4/4CF、3/4CF+1/4M、2/4CF+2/4M、1/4CF+3/4M、2/4CF+1/4M+1/4S、2/4CF+2/4S。番茄茬施用的N、P2O5和K2O总量分别为450、225和600 kg/hm2,芹菜茬施用的N、P2O5和K2O总量分别为450、300和600 kg/hm2。春茬番茄和秋冬茬芹菜各处理的具体氮和碳投入量见表1。试验为随机区组设计,每个处理 3 次重复,小区面积 14.4 m2(宽 2.4 m×长6.0 m)。番茄株、行距分别为0.3和0.6 m,种植密度为25000株/hm2;芹菜株、行距分别为0.20和0.15 m,种植密度为330570株/hm2。为防止小区间养分和水分的横向迁移,小区间埋设厚度为4 mm PVC 板 (高度 105 cm,其中 100 cm 埋于地下,5 cm露出地面)。
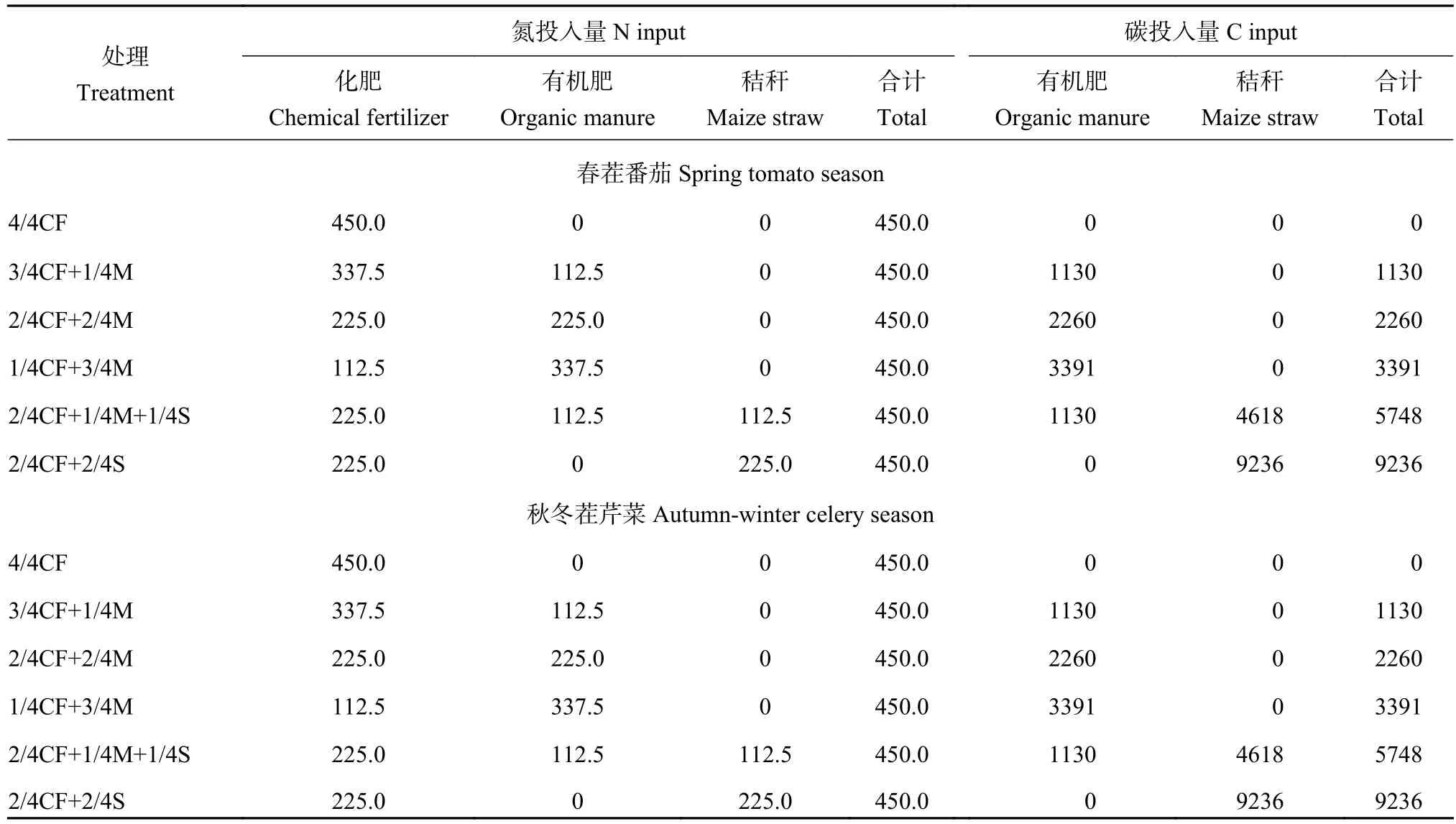
表1 春茬番茄和秋冬茬芹菜各施肥处理中氮、碳投入量(kg/hm2)Table 1 Nitrogen and carbon inputs in each fertilization treatment during spring tomato season and autumn-winter celery season
有机肥全部基施,化肥除部分基施外,其余部分作追肥施用。番茄季1~6处理所用化肥中20%氮肥、70%磷肥和20%钾肥基施,剩余氮肥和钾肥分4次追施(分别在番茄开花期、第一穗果膨大期、第二穗果膨大期和第三穗果膨大期),氮肥追施比例分别为30%、30%、10%和10%,钾肥追施比例分别为10%、30%、30%和10%,剩余磷肥在第一次和第二次追肥各施入15%。芹菜季1~6处理所用化肥中20%氮肥、70%磷肥和20%钾肥基施,剩余氮肥和钾肥在芹菜5~6叶期、8~9叶期和11~12叶期分3次追施,氮肥追施比例分别为35%、35%和10%,钾肥追施比例分别为10%、35%和35%,剩余磷肥在第一次追肥时全部施入。
定位试验所施用的化肥为尿素(N 46%)、过磷酸钙 (P2O512%)、磷酸二铵 (N 18%、P2O546%)、氯化钾 (K2O 60%)和磷酸二氢钾 (P2O552%、K2O 34%)。所用有机肥(商品猪粪) N、P2O5、K2O和C含量分别为 21.7、13.9、16.3 和 218.0 g/kg (干基),水分含量为28.9%;所用玉米秸秆N、P2O5、K2O和C含量分别为 10.4、3.2、16.9 和 426.9 g/kg (干基),水分含量为64.9%。
基施方式为肥料撒施后旋耕入地,追肥方式为肥料溶于水后随水冲施。各处理均是依据田间持水量进行灌溉,当田间持水量低于60%时进行灌溉。为保证灌水量的准确,每个小区均安装有单独的PVC进水管,并用水表记录灌水量。番茄季和芹菜季灌水总量分别为3889和3334 m3/hm2。
1.3 土壤样品采集及测定方法
1.3.1 土壤样品采集 2019年5月23日于定位试验第20茬设施蔬菜(春茬番茄盛果期,番茄定植后80天)采集土壤样品。土壤样品的取样方法是在每个小区内按“S”形布设10个点,采取0—20 cm土壤样品,剔除石砾、植物残根等杂物,混匀装袋,过2 mm筛备用。用四分法取10 g左右的鲜土送去测序公司,进行土壤功能微生物(宏基因组)分析测定;取一部分样品放入4℃冰箱内保存,用于土壤硝化潜势及土壤气体的测定;剩余土壤样品风干后,过1 mm筛和0.15 mm筛用于测定土壤基础理化指标。
1.3.2 土壤微生物宏基因组测定 使用美国Omega Bio-Tek 公司的 E.Z.N.A.®Soil DNA Kit (Omega Biotek, Norcross, GA, U.S.)试剂盒提取土壤中微生物总DNA。完成基因组DNA提取后,利用TBS-380检测DNA浓度,采用NanoDrop200检测DNA纯度,使用1%琼脂糖凝胶电泳检测DNA完整性。通过Covaris M220将 DNA 片段化,筛选约 300 bp的片段,利用 TruSeq™ DNA Sample Prep Kit试剂盒构建PE 文库;采用 HiSeq 3000/4000 PE Cluster Kit试剂进行桥式PCR分析;使用HiSeq 3000/4000 SBS Kits试剂进行lluminaHiseq测序。
使用MetaGene软件对拼接结果中的contigs进行ORF预测。选择核酸长度大于等于100 bp的基因,并将其翻译为氨基酸序列;应用CD-HIT软件对所有样品预测出来的基因序列进行聚类,每类取最长的基因作为代表序列,构建非冗余基因集;使用SOAPaligner软件,分别将每个样品的高质量reads与非冗余基因集进行比对,统计基因在对应样品中的丰度信息。使用BLASTP将非冗余基因集序列与KEGG数据库(GENES)进行比对,根据对比结果使用 KOBAS (KEGG Orthology Based Annotation System)进行功能注释,根据KO、 Pathway、EC、Module对应的基因丰度总和计算对应功能类别的丰度[17]。
1.3.3 土壤硝化潜势测定 采用匀浆法测定土壤硝化潜势 ( potential nitrification rate, PNR)。具体方法如下:将 15 g 新鲜土壤与 100 mL 缓存液 (含 1.0 mmol/L NH4+和 1mmol/L PO3−,pH = 7.2)充分混合,在 25℃下于摇床中以200 r/min转速连续避光震荡24 h。分别在第 2、4、12、22、24 h 吸取 10 mL 悬浆液,在8000g转速离心8 min,吸取上清液测定其NO3−-N含量。根据NO3−-N浓度和时间的线性回归斜率计算PNR [NO3−-N μg/(g∙h), 干土]。
1.3.4 土壤N2O气体样品采集测定 取50 g新鲜土样(过2 mm筛)于250 mL玻璃瓶(橡胶塞密封)内,在生物培养箱内25℃下避光培养28 天,每周定期补水(去离子水,保持初始土壤含水量)。分别在第1、3、7、14、28 天采集玻璃瓶内气体。采集方法为在玻璃瓶被封闭后0和4 h收集气体,用注射器从玻璃瓶中提取气体样本(22 mL),然后转移到真空的血清瓶(10 mL)。N2O的含量由Agilent-7890a气相色谱仪测定。
N2O排放量计算方法[18]为:

式中,C0与 C4为 0、4 h 的瓶内 N2O 浓度 (μL/L);44为N2O在标准状态下的密度(kg/m3);273.15为气态方程常数;T为生物培养箱内的温度(25℃);22.4为标准状态下N2O的摩尔体积;W为玻璃瓶内土壤质量 (0.05 kg)。
1.3.5 土壤基础理化指标测定 土壤硝态氮采用2 mol/L氯化钾溶液浸提,紫外分光光度法测定;铵态氮采用2 mol/L氯化钾浸提,靛酚蓝比色法测定;全氮采用凯氏法消煮半微量滴定法测定;土壤有机碳采用重铬酸钾–浓硫酸氧化(外加热法)测定;土壤pH采用2.5∶1水土比,酸度计测定;土壤水溶性盐总量 (电导率,electrical conductivity, EC)测定采用水土比5∶1土壤悬液电导法测定[19]。
1.4 数据处理
采用 Microsoft Excel 2016 进行数据处理,利用SPSS 16.0 (SPSS Inc. Chicago,IL)进行单因素 ANOVA方差分析、多重比较(Duncan),制图通过Origin 9.0(OriginLab Corporation, Northampton, MA)完成;运用R语言统计软件(RStudio)进行土壤功能微生物Circlize图及三角关系(Spearman)图制作,使用CANOCO 5 软件 (CANOCO, Microcomputer Power Inc., Ithaca, NY, USA)进行土壤功能微生物的冗余分析 (redundancy analysis, RDA)。
2 结果与分析
2.1 有机肥/秸秆替代化肥模式对设施春茬番茄盛果期土壤硝化潜势的影响
由表2可以看出,设施蔬菜有机肥/秸秆替代化肥模式土壤硝化潜势(PNR)均高于单施化肥模式,其中配施有机肥模式土壤PNR较高。有机肥/秸秆替代化肥模式(3/4CF+1/4M、2/4CF+2/4M、1/4CF+3/4M、2/4CF+1/4M+1/4S、2/4CF+2/4S)土壤PNR在NO3–-N 0.80~2.09 μg/(g∙h), DW,平均为NO3–-N 1.16 μg /(g∙h), DW,较单施化肥模式(4/4CF)平均增加72.9%,其中配施有机肥模式较单施化肥模式平均增加107.0%。
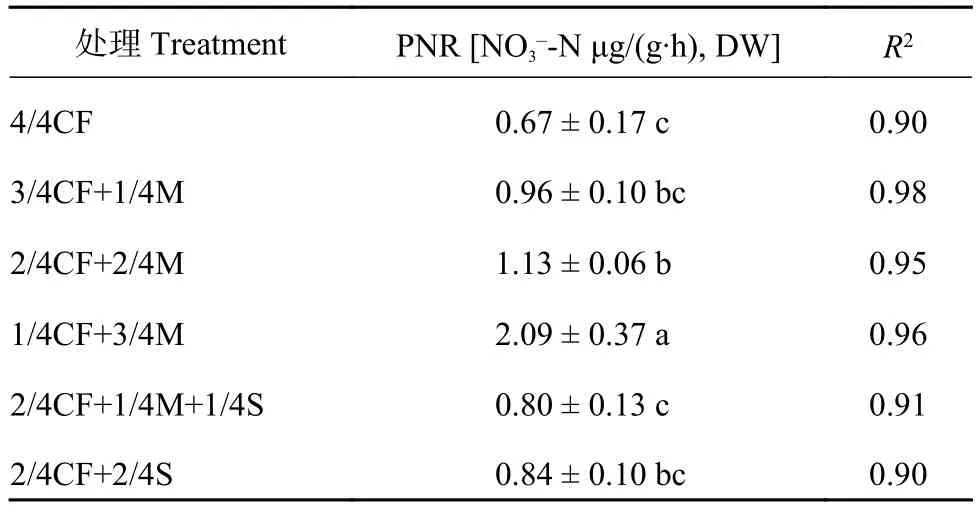
表2 有机肥/秸秆替代化肥模式下设施春茬番茄盛果期土壤硝化潜势Table 2 Soil potential nitrification rate (PNR) at the fullfruit stage of spring tomato in the greenhouse under partial substitution of chemical fertilizer with organic amendments
随有机肥用量的增加,土壤PNR呈增加的趋势。配施高量有机肥模式(1/4CF+3/4M)土壤PNR显著高于配施中量、低量有机肥模式(2/4CF+2/4M、3/4CF+1/4M),增幅为84.3%~116.9%,平均增加100.6%。
配施秸秆模式(2/4CF+1/4M+1/4S、2/4CF+2/4S)土壤PNR均低于配施有机肥模式(3/4CF+1/4M、2/4CF+2/4M、1/4CF+3/4M),降幅为12.5%~61.7%,平均降低34.4%。
2.2 有机无机肥配施处理对土壤氮循环功能微生物的影响
由图1可知,不同施肥处理对土壤氮循环过程主要微生物菌属相对丰度影响不同。有机肥/秸秆替代化肥模式土壤氨氧化古菌属Nitrososphaera和Nitrosopumilus相对丰度均低于4/4CF处理,降幅分别为14.3%~33.5%和0.7%~15.7%;氨氧化细菌属Nitrosospira和Nitrosococcus相对丰度均高于4/4CF处理,增幅分别为31.2%~82.9%和17.1%~53.6%;氨氧化细菌属Nitrosomonas相对丰度低于4/4CF处理,降幅为24.9%~54.3%;亚硝酸盐氧化细菌属Nitrobacter、Nitrospina、Nitrospirillum和Nitrospira相对丰度均高于4/4CF处理,增幅分别为21.6%~85.1%、5.6%~22.8%、41.5%~109.2%和8.9%~13.4%;厌氧氨氧化细菌属Candidatus Brocadia和Candidatus Kuenenia相对丰度均高于4/4CF处理,增幅分别为5.6%~27.5%和7.6%~27.9%。
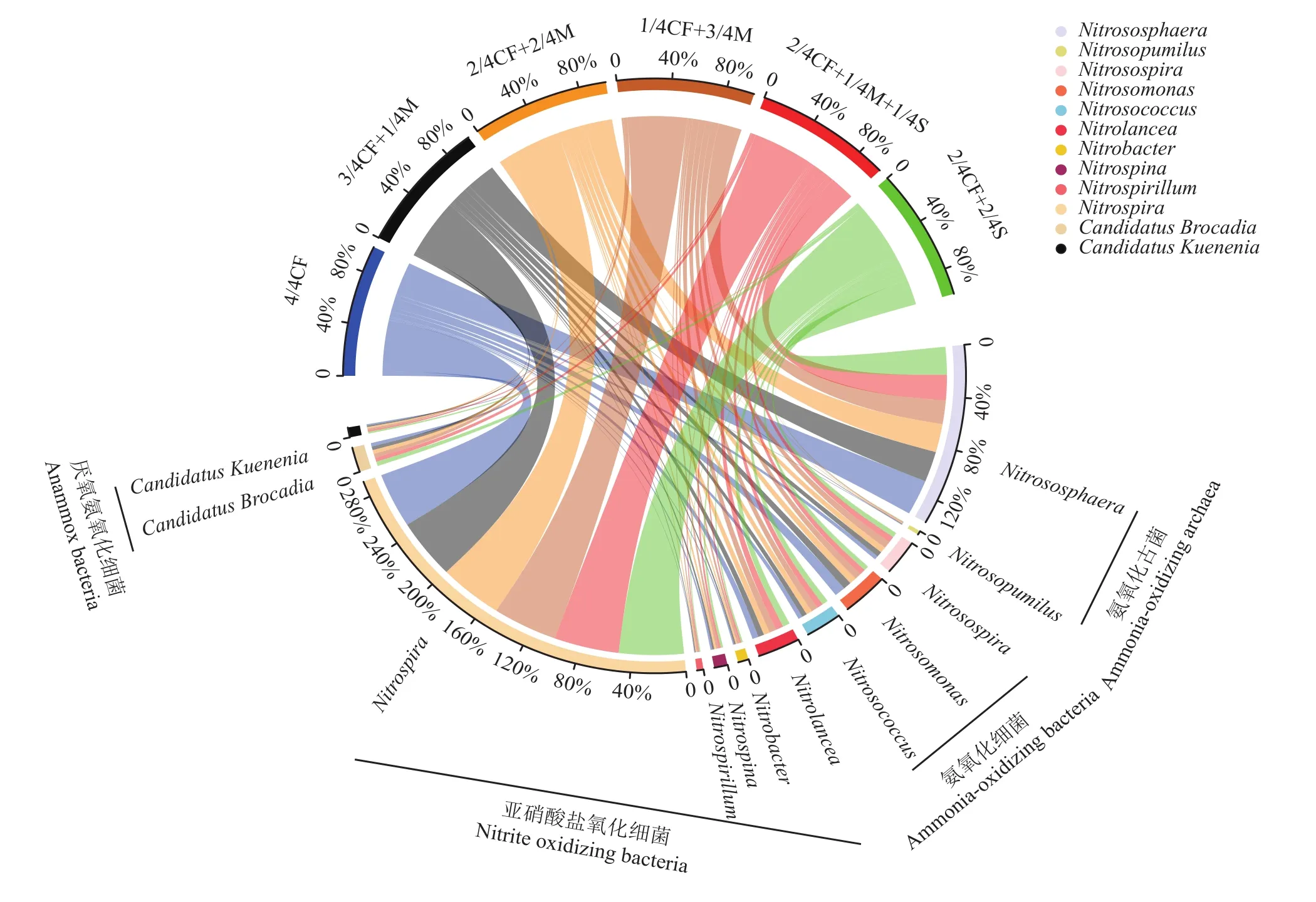
图1 有机肥/秸秆替代化肥模式下设施春茬番茄盛果期土壤氮循环功能微生物类群差异(属水平)Fig. 1 Fertilization affects the relative abundance of functional microbial community related to soil N cycling at the full-fruit stage of spring tomato in the greenhouse (genus level)
2.3 施肥模式对土壤氮循环功能基因的影响
2.3.1 硝化过程功能基因 由图2可以看出,与4/4CF处理相比,有机肥/秸秆替代化肥模式降低硝化过程AmoA、AmoB、AmoC和Hao丰度,降幅分别为8.2%~56.8%、19.0%~70.0%、20.0%~43.3%和51.3%~73.7%,平均分别降低37.9%、46.3%、33.8%、65.5%。其中高碳有机替代模式1/4CF+3/4M、2/4CF+1/4M+1/4S、2/4CF+2/4S处理的降幅显著,AmoA、AmoB、AmoC和Hao丰度平均分别降低了53.3%、56.9%、42.5%和71.1%。
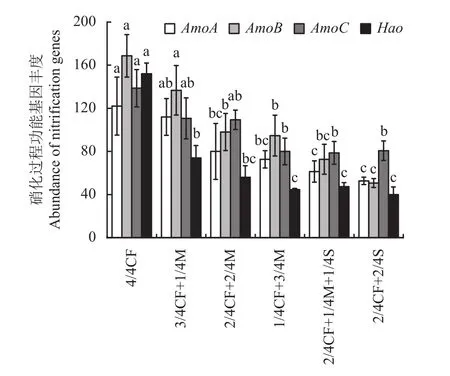
图2 不同施肥模式下设施春茬番茄盛果期土壤硝化过程功能基因丰度Fig. 2 The abundance of soil nitrification genes as affected by fertilization treatments at the full-fruit stage of spring tomato in the greenhouse
随有机肥施用比例的增加,土壤硝化过程AmoA、AmoB、AmoC和Hao丰度呈减少的趋势。与2/4CF+2/4M、3/4CF+1/4M处理相比,1/4CF+3/4M处理AmoA、AmoB、AmoC和Hao丰度降幅分别为9.2%~35.1%、3.4%~30.7%、26.8%~27.7%和20.2%~39.6%。
配施秸秆模式土壤硝化过程AmoA、AmoB和Hao丰度均低于配施有机肥模式,降幅分别为15.6%~53.0%、23.2%~93.4%和10.4%~45.9%。
2.3.2 土壤反硝化过程功能基因 有机肥/秸秆替代化肥模式对土壤反硝化过程各功能基因丰度的影响不一致(图3)。与4/4CF处理相比,1/4CF+3/4M及2/4CF+2/4S处理的土壤NarGHI丰度增幅为6.0%~9.2%,平均增加7.6%。高碳有机替代模式(1/4CF+3/4M、2/4CF+1/4M+1/4S、2/4CF+2/4S)NarGHI丰度高于低碳有机替代模式(3/4CF+1/4M、2/4CF+2/4M),增幅为4.8%~18.5%。
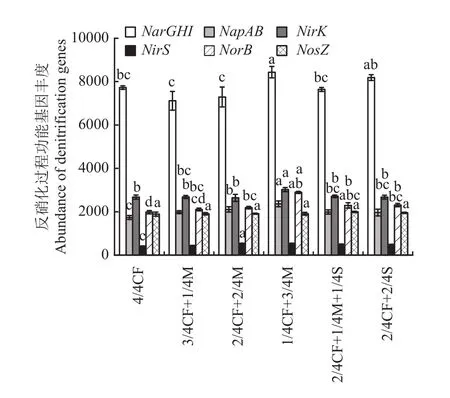
图3 不同施肥模式下设施春茬番茄盛果期土壤反硝化过程功能基因丰度Fig. 3 The abundance of soil denitrification genes as affected by fertilization modes at the full-fruit stage of spring tomato in the greenhouse
与4/4CF处理相比,有机肥/秸秆替代化肥模式NapAB、NirS、NorB和NosZ丰度增幅分别为13.2%~36.3%、6.9%~35.1%、6.4%~46.2%和0.8%~5.5%,平均分别增加19.9%、20.4%、19.1%和2.3%。
不同有机肥比例下土壤反硝化过程NapAB、NirK和NorB丰度增幅不同。1/4CF+3/4M处理NapAB、NirK和NorB丰度较2/4CF+2/4M、3/4CF+1/4M处理的增幅分别为12.2%~19.6%、12.7%~14.4%和32.2%~37.4%,平均分别增加15.9%、13.5%和34.8%。
配施秸秆模式土壤反硝化过程NosZ丰度均高于仅配施有机肥模式,增幅为2.0%~4.6%,平均增加3.3%。
2.3.3 硝酸盐异化还原成铵过程功能基因 从图4可以看出,有机肥/秸秆替代化肥模式增加土壤硝酸盐异化还原成铵过程NirB丰度,降低NrfH丰度。与4/4CF处理相比,有机肥/秸秆替代化肥模式NirB丰度增幅为12.0%~38.5%,平均增加25.9%;NrfH丰度降幅为5.6%~11.3%,平均降低8.8%。
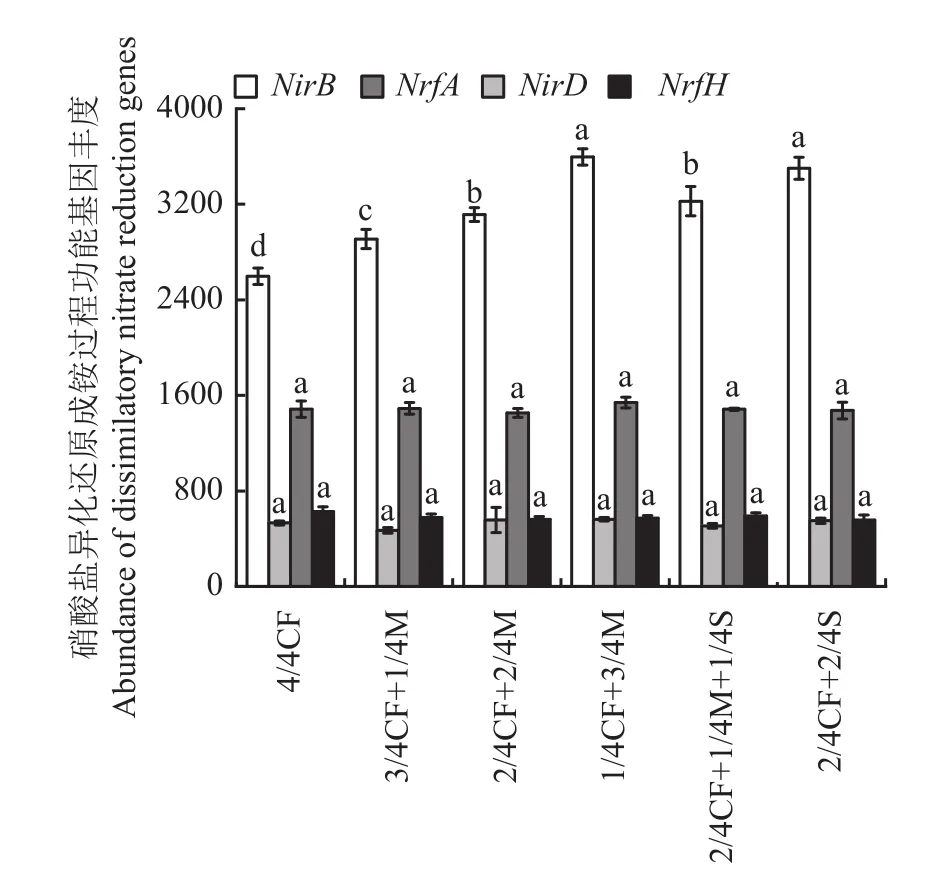
图4 不同施肥模式下设施春茬番茄盛果期土壤硝酸盐异化还原成铵过程功能基因丰度Fig. 4 The abundance of soil dissimilatory nitrate reduction genes as affected by fertilization modes at the full-fruit stage of spring tomato in greenhouse
随有机肥施用比例的增加,土壤硝酸盐异化还原成铵过程NirB、NirD和NrfA基因丰度均呈增加的趋势。与2/4CF+2/4M、3/4CF+1/4M处理相比,1/4CF+3/4M处理NirB、NirD和NrfA丰度增幅分别为15.5%~23.7%、1.0%~19.9%和3.3%~6.0%,平均分别增加19.6%、10.4%和4.6%。
2.4 有机肥/秸秆替代化肥模式对设施春茬番茄盛果期土壤N2O排放量的影响
如图5所示,设施春茬番茄盛果期各施肥模式土壤N2O排放量总体趋势基本一致,均表现出土壤N2O排放量随培养时间延长而呈现升高的趋势。在培养期间,有机肥/秸秆替代化肥模式土壤N2O排放量均高于4/4CF处理,培养1、3、7、14、28天的土壤N2O排放量增幅分别为113.8%~389.83%、6.6%~109.1%、11.2%~95.5%、44.9%~83.6%和29.7%~84.6%,平均分别增加237.3%、34.2%、51.4%、61.7%和62.0%,其中高碳有机替代模式(1/4CF+3/4M、2/4CF+1/4M+1/4S、2/4CF+2/4S)排放量更高,培养1、3、7、14、28天的土壤N2O排放量较4/4CF处理平均分别增加215.2%、50.1%、67.3%、71.6%和73.8%。
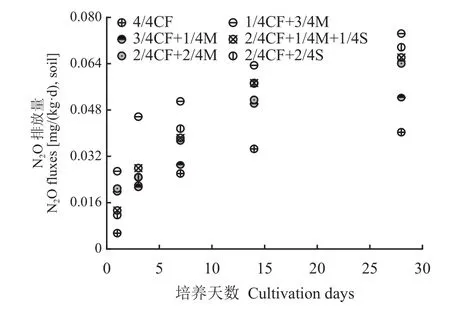
图5 不同施肥模式下设施春茬番茄盛果期土壤N2O排放量Fig. 5 Soil N2O emission fluxes as affected by fertilization modes at the full-fruit stage of spring tomato in the greenhouse
随有机肥用量的增加,土壤N2O排放量呈增加的趋势。与2/4CF+2/4M、3/4CF+1/4M处理相比,1/4CF+3/4M处理培养1、3、7、14、28天的土壤N2O排放量平均分别增加32.4%、90.0%、56.0%、24.9%和29.3%。
从培养第3天开始,高碳有机替代模式(1/4CF+3/4M、2/4CF+1/4M+1/4S、2/4CF+2/4S)土壤N2O排放量高于低碳有机替代模式(3/4CF+1/4M、2/4CF+2/4M),培养3、7、14、28天的土壤N2O排放量增幅平均分别为36.5%、33.5%、16.8%和21.7%。
经计算得出培养28 天的土壤N2O累计排放量(图6)。有机肥/秸秆替代化肥模式土壤N2O累计排放量均高于4/4CF处理,其中高碳有机替代模式效果明显。与单施化肥模式相比,有机肥/秸秆替代化肥模式土壤N2O累计排放量增幅为33.6%~90.9%,平均增加59.6%,其中高碳有机替代模式土壤N2O累计排放量较单施化肥模式增幅为59.9%~90.9%,平均增加71.3%。
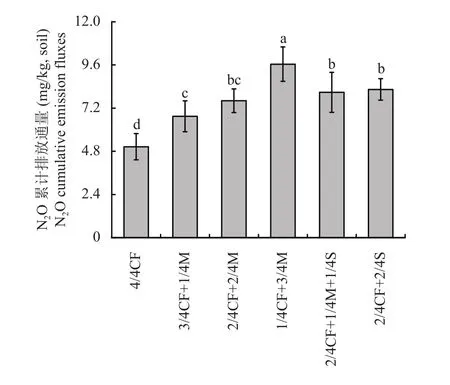
图6 不同施肥模式下设施春茬番茄盛果期土壤N2O累计排放量Fig. 6 Soil N2O cumulative emission fluxes as affected by fertilization modes at the full-fruit stage of spring tomato in the greenhouse
2.5 不同施肥模式下设施春茬番茄盛果期土壤氮循环过程与土壤理化性质的关系
如表3所示,有机肥/秸秆替代化肥模式较4/4CF处理可提高土壤全氮、有机碳、硝态氮和铵态氮含量,增幅分别为20.3%~72.9%、24.0%~67.1%、10.8%~76.9%和107.4%~188.9%。冗余分析(RDA)结果表明,土壤理化性质对土壤氮循环功能微生物影响较大(图7)。在5个理化指标(全氮、有机碳、硝态氮、铵态氮和pH)中,硝态氮(P=0.01)、铵态氮 (P= 0.03)和有机碳 (P= 0.05)对土壤氮循环功能微生物影响显著,分别解释其群落结构变异的34.0%、13.3%和11.3%。
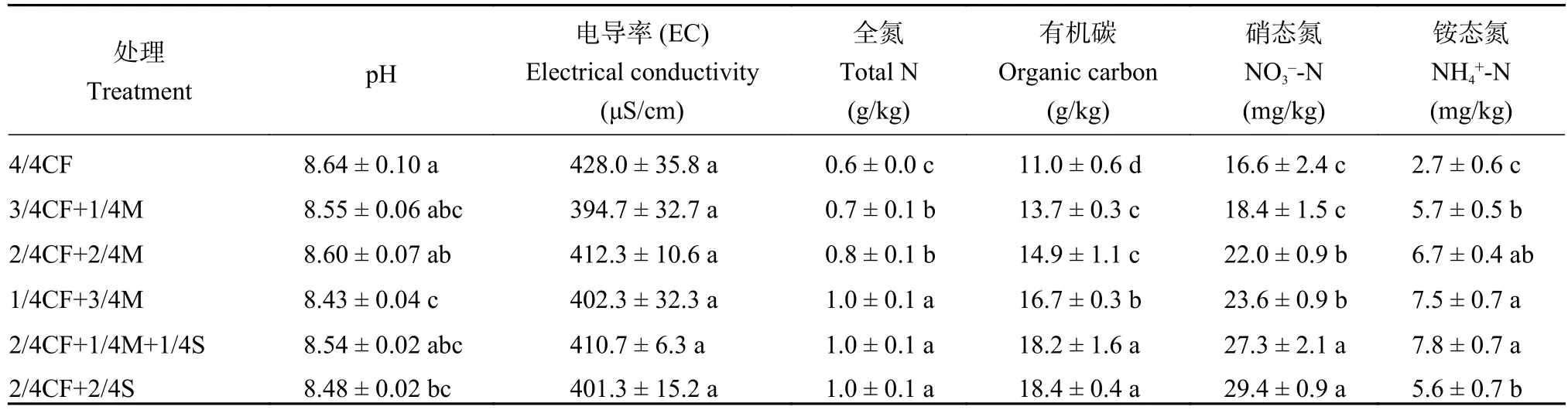
表3 不同施肥模式下设施春茬番茄盛果期土壤基本理化性质Table 3 Soil physicochemical properties as affected by fertilization modes at the full-fruit stage of spring tomato in the greenhouse

图7 土壤氮循环功能微生物与土壤理化性状关系冗余分析Fig. 7 Redundancy analysis (RDA) of soil N cycling functional microorganisms and soil physicochemical properties
此外,通过Spearman相关性分析(图8)表明,土壤 PNR 与土壤有机碳 (r= 0.37)、铵态氮 (r=0.47)、土壤N2O累计排放量(r= 0.56)以及反硝化过程功能基因 [NapAB(r= 0.78)、NirK(r= 0.21)和NorB(r= 0.53)]呈显著正相关关系,与土壤 pH (r=–0.40)呈显著负相关关系;土壤N2O累计排放量与土壤有机碳 (r= 0.90)、全氮 (r= 0.83)、硝态氮 (r=0.83)、铵态氮 (r= 0.64),及反硝化过程功能基因[NapAB(r= 0.67)、NirK(r= 0.49)、NirS(r= 0.36)和NorB(r= 0.88)]呈显著正相关关系,与土壤 pH (r=–0.52)和硝化过程功能基因 [AmoA(r= –0.62)、AmoB(r= –0.64)、AmoC(r= –0.71)和Hao(r=–0.77)]呈显著负相关关系。
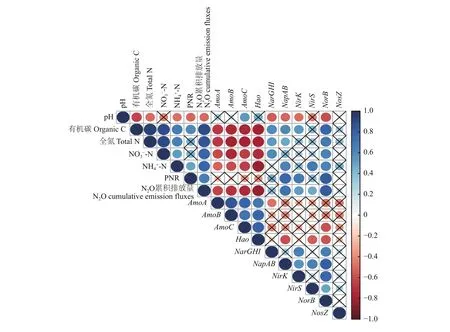
图8 土壤基础理化性质、硝化潜势 (PNR)、N2O累计排放量及氮循环功能基因关系图Fig. 8 Triangle diagram illustrating relationships among soil properties, potential nitrification rate (PNR), N2O cumulative emission fluxes, and N-cycle functional genes according to Spearman’s correlation coefficient
3 讨论
土壤氮循环过程中硝化与反硝化过程是极其重要的环节,硝化过程是将土壤有机氮矿化产生硝态氮以及肥料中的铵态氮转化为硝态氮的过程,其产生的硝态氮易受到反硝化过程及淋洗损失,对生态环境产生消极影响[20–21]。土壤硝化过程通常分为氨氧化和亚硝酸盐氧化过程,氨氧化被认为是第一步骤(限速步骤),也是全球氮循环的中心环节[22]。本研究发现,秸秆替代部分化肥模式的土壤PNR均高于单施化肥模式(表2);单施化肥模式氨氧化古菌属(AOA)、氨氧化细菌属(AOB)丰度及硝化过程AmoA、AmoB、AmoC及Hao功能基因丰度均高于有机肥/秸秆替代化肥模式。功能基因丰度高低可以在一定程度上反映其介导的物质循环过程发生的潜力[23]。秸秆的C/N较高,可增加微生物对无机氮的固持作用,使其转化为微生物量氮储存,进而降低土壤有机氮的矿化作用[20,24],即配施秸秆模式土壤PNR低于仅配施有机肥模式;设施蔬菜具有特殊的生长环境(高温、高湿及高肥),且取样时期为番茄盛果期,此时作物对土壤养分需求量大,造成本研究土壤PNR较高且有机肥/秸秆配施化肥模式增幅较高。AOA富含脲酶基因,对尿素的响应较高,AOB的硝化活性受无机氮肥的影响较大[25–26],本研究施用的化肥N为尿素,单施化肥模式较有机肥/秸秆替代化肥模式更有利于AOA和AOB生长繁殖,故单施化肥模式AOA和AOB丰度较高,进而导致硝化过程功能基因丰度增加。Spearman相关性分析结果(图7)表明,Amo功能基因丰度均与硝态氮、铵态氮及有机碳含量呈显著负相关,故有机肥/秸秆替代化肥模式可能通过影响土壤硝态氮、铵态氮及有机碳含量,进而影响硝化过程Amo功能基因的表达。目前对编码羟胺氧化酶Hao基因研究集中在纯菌株的基因表达结果和功能蛋白[26],对复杂土壤生态环境中Hao变化还无法解释。设施蔬菜生产氮损失主要途径为硝酸盐淋溶,本研究中有机肥/秸秆替代化肥模式降低硝化过程功能基因丰度,从微生物丰度角度看是减弱硝酸盐淋溶损失。
土壤反硝化过程是NO3−还原成N2O或N2的一系列反应,主要包括NO3−→NO2−→NO→N2O→N2过程[27],参与该过程的功能基因有NarGHI、NapAB、NirK、NirS、NorB和NosZ。本试验结果显示,设施蔬菜有机肥/秸秆替代化肥模式较单施化肥模式可提高NapAB、NirK、NorB和NosZ丰度。目前的研究表明参与N2O还原成N2过程仅为NosZ基因编码的氧化亚氮还原酶,且NosZ基因存在于细菌和古菌中,真菌缺少该基因,故真菌无法完全参与反硝化作用将N2O还原成N2[28–30];反硝化过程中 (NirK+NirS)/NosZ值可预测N2O排放,通过提高NosZ基因丰度,降低该比值使N2O还原大于产生,进而减少N2O产生潜力[25,31]。本研究表明有机肥/秸秆替代化肥模式可增加NosZ基因丰度,且仅2/4CF+1/4M+1/4S模式(NirK+NirS)/NosZ值低于单施化肥模式,可降低N2O产生潜力,进而减小反硝化过程对环境污染。Spearman相关性分析结果(图8)表明土壤硝态氮和有机碳对N2O的排放产生显著影响,这很好的解释了N2O排放对氮源和碳源的响应,且反硝化过程功能基因(NapAB、NirK、NirS、NorB)丰度均与N2O的排放呈显著正相关,尤其是NorB(NO→N2O)功能基因对N2O的排放影响最大,因此推断功能基因丰度越高此过程发生的程度越大,该结果可为后续研究提供启示;土壤PNR与反硝化过程功能基因(NapAB、NirK和NorB)呈显著正相关,此结果说明硝化过程增加土壤硝态氮的积累,进而促进反硝化过程的发生。
此外,硝态氮还可通过硝酸盐异化还原成铵过程(DNRA)转化为铵态氮供作物吸收利用,进而增加土壤对氮素的固持[7]。影响该过程的因素有以下几点:DNRA途径主要是通过有机质发酵,故土壤中有机质含量是影响该过程的重要因素,有机肥/秸秆等外源碳的添加能刺激DNRA发生;在土壤环境中,一定范围内C/N越高,DNRA过程越容易发生[32]。本研究结果显示,有机肥/秸秆替代化肥模式土壤DNRA过程功能基因丰度高于单施化肥模式。究其原因为:在土壤中施用有机肥或秸秆后,为土壤带来新鲜的有机质,刺激DNRA的发生,进而将硝态氮转化为铵态氮,保护土壤中的氮素。
综合本试验结果及10年定位试验产量数据(2/4CF+1/4M+1/4S模式产量最高)[33],表明化肥―有机肥―秸秆配施模式(2/4CF+1/4M+1/4S)为设施菜田可持续健康发展的模式。
4 结论
有机肥/秸秆替代部分化肥降低土壤硝化基因丰度,增加土壤反硝化、硝酸盐异化还原成铵过程功能基因丰度。因而,在养分需求关键时期,可以提高氮素的循环和对作物的供肥强度,减少硝态氮的淋洗风险。综合考虑设施蔬菜产量和土壤氮循环功能基因指标以及实际可操作性,化肥―有机肥―秸秆配施模式(2/4CF+1/4M+1/4S)为设施菜田可持续发展的健康、高产施肥模式。
