槲皮素及其衍生物防治肝损伤作用及机制的研究进展
2021-12-04毛文静白庆云
张 娟,毛文静,白庆云
槲皮素及其衍生物防治肝损伤作用及机制的研究进展
张 娟,毛文静,白庆云*
宜春学院化学与生物工程学院 江西省天然药物活性成分研究重点实验室,江西 宜春 336000
槲皮素是一种多羟基黄酮类化合物,广泛存在于多种药用植物中,具有抗氧化、抗病毒、抗菌、抗炎和抗肿瘤等多种药理作用。分析了近10年国内外有关槲皮素及衍生物防治肝损伤方面的文献,发现其对各种急、慢性肝损伤均具有良好的防治作用,其作用机制主要涉及抗氧化、抗炎、调节脂质代谢、抗凋亡及自噬、抗病毒等。主要对槲皮素及其衍生物防治不同类型肝损伤的作用及机制进行综述,以期为槲皮素保肝作用的深入研究提供较为全面的文献信息支持。
槲皮素;槲皮素衍生物;保肝作用;保肝机制;肝损伤
槲皮素,化学名称为3,3,4,5,7-五羟基黄酮,别名栎精、槲皮黄素,是一种多羟基黄酮类化合物,一般与糖类结合,以苷的形式存在。槲皮素具有清除自由基、抗氧化、抗病毒、抗菌、抗炎以及抗肿瘤等多种生物活性[1]。大量的体内外实验证明槲皮素可以通过抗氧化应激、抗炎等对神经系统和肝肾起保护作用[2]。
肝损伤是由多种原因导致的肝脏细胞受到破坏,进而影响肝脏正常的功能。引起肝损伤的常见因素有化学物质、肝毒性药物、病毒、细菌、寄生虫、自身免疫等[3]。肝损伤一直是人类健康的威胁,因此,对肝损伤的预防和治疗仍是一个全球性的严峻课题。通过查阅文献发现槲皮素在急慢性肝损伤的防治方面有较多研究成果,本文主要总结了槲皮素对不同类型肝损伤防治作用及机制的研究进展。
1 药物性肝损伤
药物性肝损伤是指由药物本身或其代谢物引起的肝脏损伤。如对乙酰氨基酚(acetaminophen,APAP)是临床上常用的解热镇痛药,在过量用药的情况下,APAP代谢生成的反应性代谢产物-乙酰基-对-苯并醌亚胺增加,耗竭谷胱甘肽,从而引起氧化应激和肝细胞损伤[4]。在注射APAP(300 mg/kg)之前,先给小鼠ig异槲皮苷10、20或50 mg/kg 3 d,APAP注射后24 h,通过检测相关指标发现异槲皮苷通过抑制氧化应激、亚硝化应激和炎症因子以及调节APAP代谢,保护肝脏免受APAP的损害。除此之外,异槲皮苷还可以阻断丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、抑制核因子-κB(nuclear factor-kappa B,NF-κB)通路,改善诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、白细胞介素(interleukin,IL)-6、IL-1β和肿瘤坏死因子(tumor necrosis factor,TNF)-α引起的炎症反应,从而发挥保肝作用[5]。-乙酰半胱氨酸(-acetylcysteine,NAC)是临床上常用的治疗APAP肝毒性的药物,Yousef等[6]用NAC对比评价槲皮素对APAP肝损伤的作用。结果发现槲皮素可降低硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS),同时升高谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、谷胱甘肽S-转移酶(glutathione S-transferase,GST)、超氧化物歧化酶(superoxide dismutase,SOD)和乳糖酶。说明槲皮素对APAP诱导的肝损伤有很好的疗效。Carrasco-Pozo等[7]在注射APAP(300 mg/kg)之前,给小鼠ig槲皮素的代谢产物3,4-二羟基苯基乙酸(10、20、50 mg/kg)3 d。结果发现,3,4-二羟基苯基乙酸可激活核因子NF-E2相关因子(nuclear factor erythroid 2-related factor,Nrf2),发挥抗氧化作用,从而拮抗APAP诱导的肝损害。
抗结核药异烟肼、利福平、吡嗪酰胺均有潜在的肝毒性,其临床表现为丙氨酸转氨酶(alanine aminotransferase,ALT)升高,甚至会发生暴发性肝细胞坏死。Shabbir等[8]研究证明了美登红叶甲醇提取物(含有槲皮素成分)对抗结核药组合(包括利福平、异烟肼、吡嗪酰胺和乙胺丁醇等)诱导的小鼠肝毒性有拮抗作用。使用诱导药物后血清乳酸脱氢酶(lactate dehydrogenase,LDH)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、ALT增加,美登红叶甲醇提取物可使上述指标降低,且显著改善低密度脂蛋白(low density lipoprotein,LDL)、胆固醇、GST、γ-谷氨酰胺(glutamine,GT)、谷胱甘肽还原酶(glutathione reductase,GR)、高密度脂蛋白(high-density lipoprotein,HDL)和三酰甘油的含量,从而减轻肝脏的损伤。推测槲皮素的存在可能是美登红叶甲醇提取物对肝脏提供保护的原因,因为在先前的研究中已证实槲皮素对肝损伤具有确切的治疗作用。
环丙沙星为广谱抗菌剂,肝脏损害是其不良反应之一。Taslidere等[9]用组织化学和生化方法研究了由环丙沙星引起的大鼠肝组织变化以及槲皮素对这些变化的影响。对大鼠肝脏样品进行光学显微镜检查和生化检测,并进行组织病理学损伤评分。环丙沙星组可见炎性细胞浸润和细胞内空泡形成,槲皮素组的肝脏组织损伤减轻,与环丙沙星组比较有显著差异。说明槲皮素可减轻由环丙沙星引起的肝损伤。
槲皮素及其衍生物抗药物性肝损伤的作用机制见表1。
2 免疫性肝损伤
免疫性肝损伤可由生物素引起,如刀豆蛋白A(concanavalin A,Con A)通过促进T细胞分泌细胞因子诱导肝损伤,反复使用Con A可导致慢性免疫性肝损伤。在注射Con A 25 mg/kg前5 d,给予小鼠槲皮素100、200 mg/kg,然后检测Con A注射后不同时间段内肝酶和炎性细胞因子的水平。通过对照发现槲皮素可以提高小鼠的存活率,降低血清转氨酶水平,改善Con A导致的肝脏损伤以及组织病理学的变化,并抑制炎性细胞因子TNF-α、IL-6和IL-1β的释放,同时减少肿瘤坏死因子受体相关因子(tumor necrosis factor receptor-associated factor,TRAF)和磷酸化氨基末端蛋白激酶(phosphorylated c-Jun-terminal kinase,p-JNK)的蛋白表达。说明槲皮素是通过抑制TRAF-6/c-Jun氨基末端激酶(c-Jun-terminal kinase,JNK)通路来减轻Con A诱导的免疫性肝损伤[10]。另有研究表明,槲皮素降低了Con A诱导的免疫性肝损伤小鼠血清中ALT、AST、LDH活性和细胞因子TNF-α、IL-1β和IL-6水平,所以槲皮素对自身免疫性肝损伤有一定保护作用[11]。
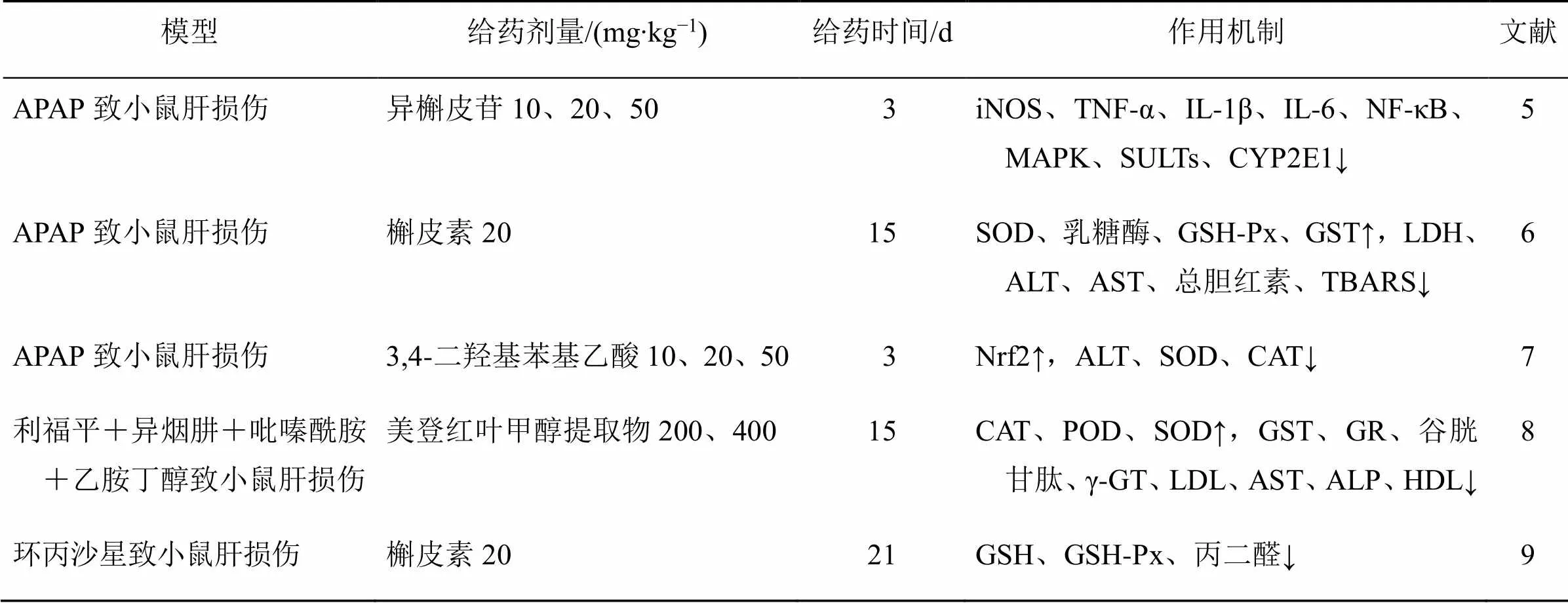
表1 槲皮素及其衍生物抗药物性肝损伤的作用机制
↑表示上升 ↓表示下降 SULTs-硫酸转移酶 CYP2E1-细胞色素P4502E1 CAT-过氧化氢酶 POD-过氧化物酶,下表同
↑ means rising ↓ means falling SULTs-sulfate transferase CYP2E1-cytochrome P450 2E1 CAT-catalase POD-peroxidase, same as the following tables
二氢槲皮素是槲皮素的一种还原形式。Zhao等[12]研究表明二氢槲皮素通过降低血清AST和ALT水平、预防组织病理学损伤和减少肝组织的炎性细胞因子mRNA的表达,从而改善Con A引起的小鼠肝损伤。研究者进一步将小鼠单核巨噬细胞暴露在Con A中,结果显示二氢槲皮素可显著抑制、、、γ干扰素(interferon-γ,)和的mRNA表达水平。此外,二氢槲皮素还增加了Nrf2核的转移和红素加氧酶1(heme oxygenase 1,HO-1)的表达,此作用与剂量和时间具有相关性。另有研究发现,二氢槲皮素的免疫抑制作用是通过减少肝脏组织的炎性介质的表达以及CD4+和CD8+T细胞的浸润而减轻Con A诱导的肝损伤[13]。
雷公藤甲素具有抗炎及免疫抑制等多种作用,可导致免疫性肝损伤[14]。研究者用C57BL/6小鼠建立雷公藤甲素肝损伤模型,分别在胃肠道内给予槲皮素20、50、80 mg/kg。发现经过槲皮素治疗后小鼠的肝组织损伤和炎性细胞浸润减轻,血清中ALT、AST、丙二醛、IL-6和IL-17活性水平均降低,Toll-样受体4(Toll-like receptor 4,TLR-4)的表达下调。说明槲皮素可以通过减轻氧化损伤,从而增强抗氧化作用和调节细胞因子的分泌来减轻雷公藤甲素所引起的肝损伤,并通过T淋巴细胞免疫球蛋白黏蛋白3(T cell immunoglobulin domain and mucin domain-3,Tim-3)和TLR4-MyD88-NF-κB途径恢复Th17/ Treg平衡来治疗雷公藤甲素引起的免疫性肝损伤[15]。另有研究显示槲皮素可降低雷公藤甲素引起的小鼠血清ALT、AST水平以及肝脏中丙二醛含量,谷胱甘肽和SOD水平显著升高,且Th17/Treg平衡也参与其中[16]。
槲皮素及其衍生物抗免疫性肝损伤的作用机制见表2。

表2 槲皮素及其衍生物抗免疫性肝损伤的作用机制
3 酒精性肝损伤
酒精性肝病是因长期过量饮酒导致的肝细胞结构异常和(或)功能障碍性疾病。其发病机制与乙醇在肝脏代谢过程中产生的大量氧自由基有关。这些氧自由基除直接损伤肝细胞,还可增加细胞膜对脂质过氧化的敏感性,导致细胞膜破坏,细胞死亡[17]。Liu等[18]对乙醇中毒的大鼠原代肝细胞分别用槲皮素中毒后处理(2 h)、同时处理或预处理(2 h),发现用槲皮素预处理可降低血清ALT、AST和三酰甘油的活性,同时SOD和CAT活性增加。表明槲皮素预处理可防止乙醇诱导的肝细胞氧化应激,故槲皮素可作为防治酒精性肝病的新型天然药物。长期饮酒还会引起肝组织中NF-κB的激活,从而促进炎性细胞因子的转录,进一步加重肝细胞炎症、坏死、凋亡和纤维化。此外,NF-κB的激活还与肝脏中酒精代谢产生的活性氧有关,活性氧会增加血清内毒素的水平,并导致炎症介质的释放从而加重肝脏损害[19]。Liu等[20]通过数据库分析和血清测量结果表明槲皮素可以提高Nrf2/HO-1的表达,减轻乙醇引起的急性肝损伤。用槲皮素治疗后血清ALT、AST、三酰甘油、IL-1β和IL-6活性均降低,并且槲皮素可通过上调IL-10和HO-1的表达从而抑制炎症小体的激活和炎性因子的分泌,达到治疗酒精性肝损伤的作用。另有研究显示槲皮素预处理后可降低酒精性肝病小鼠血清中ALT、AST水平,且槲皮素预处理后小鼠肝脏切片脂质空泡化和炎性细胞浸润显著减少。说明槲皮素可有效预防乙醇引起的酒精性肝病[21]。
除此之外,槲皮素糖苷衍生物可降低肝癌HepG2细胞中的氨基转移酶活性和炎症反应因子而拮抗乙醇诱导的肝毒性,且Lee等[22]发现槲皮素糖苷配体与其糖基化形式相比,糖苷配体对酒精诱导的肝损伤具有更好的保护作用。
槲皮素抗酒精性肝损伤的作用机制见表3。
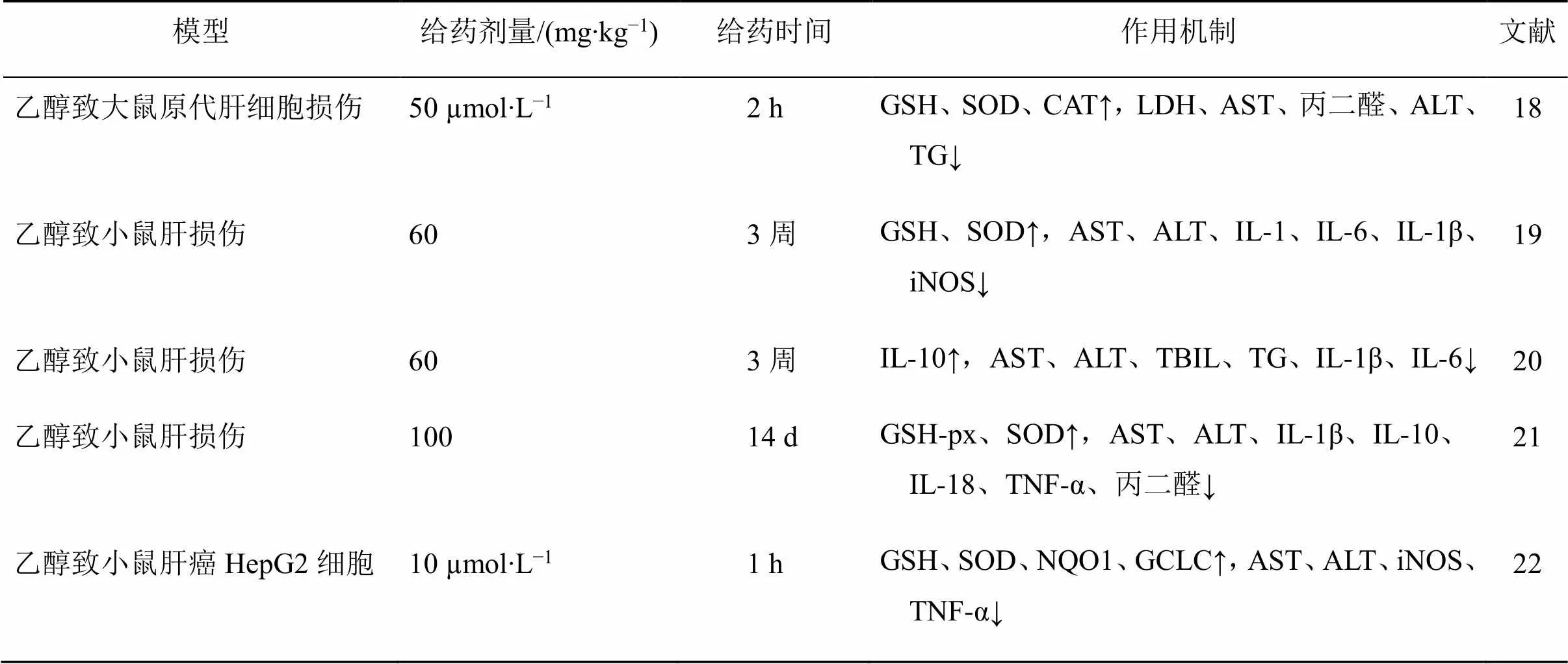
表3 槲皮素抗酒精性肝损伤的作用机制
GCLC-谷氨酸半胱氨酸连接酶催化亚基 NQO1-醌氧化还原酶
GCLC-glutamate cysteine ligase catalytic subunits NQO1-quinone oxidoreductase
4 非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)
非酒精性脂肪肝病是一种除酒精和其他明确的致病因素外形成的大泡性脂肪病变。这是一种常见的慢性肝病,包括非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)、肝硬化和肝纤维化等,甚至可以演变成肝癌[23]。Surapaneni等[24]实验表明槲皮素可以降低由NASH引起的血清ALT、AST、谷氨酰基转移酶(glutamine-glutamyl transferase,GGT)和LDH的增高。Marcolin等[25]实验发现NASH可导致肝脏组织中DNA损伤,而使用槲皮素后肝脏组织的DNA损伤明显减轻,大泡性脂肪变性和炎症减轻,且ALT、AST的水平降低,CAT和SOD的活性升高。此外,Surapaneni等[26]研究发现槲皮素可通过降低CYP2E1的活性,从而减少APAP的代谢产物引起的氧化应激,为肝脏提供抗NASH的保护作用。
导致NAFLD的主要原因是脂质蓄积,所以经常通过高脂饮食饲养小鼠来建造NASH模型。氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)是NASH的一种致病因子,通过抑制LDL的积累可以为NASH防治提供新的方向[27]。Liu等[28]发现用高脂饮食饲养的小鼠有明显的肝脂肪浸润症状,而给予槲皮素不仅可显著缓解此症状,而且能降低肝总胆固醇、肝Ox-LDL的过度沉积、血小板反应蛋白受体(thrombospondin receptor,CD36)和自噬底物P62蛋白,并且增加自噬相关蛋白微管轻链蛋白3(microtubule-associated protein light chain 3 II,LC3 II)的相关表达,从而减轻NASH症状。
除此之外,槲皮素的糖苷衍生物异槲皮素对NAFLD也具有良好的治疗作用。Qin等[29]利用高脂饮食诱导雄性Sprague-Dawley(SD)大鼠肝损伤,发现异槲皮素通过激活AMP蛋白激酶(AMP-activated protein kinase,AMPK)通路和过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARs)参与脂质调节。同时,异槲皮素还可以通过抑制转化生长因子-β(transforming growth factor-β,TGF-β)信号传导来减轻NAFLD,从而改善脂质的积累,减少炎症和氧化应激。Xu等[30]利用代谢组学研究膳食槲皮素对高脂饮食诱导的NAFLD大鼠模型的作用,发现膳食槲皮素通过调节与脂肪酸、炎症、氧化应激等相关代谢产物(肾上腺酸、花生四烯酸、2-羟基丁酸和柠檬酸等)改善NAFLD症状,而且膳食槲皮素对高脂饮食诱导30 d的NAFLD大鼠比50 d的改善作用更好,说明膳食槲皮素可能对早期NAFLD有较好的治疗作用。
槲皮素及其衍生物抗NAFLD的作用机制见表4。

表4 槲皮素及其衍生物抗NAFLD的作用机制
MCD-蛋氨酸胆碱缺乏饮食 LPS-脂多糖 FFA-游离脂肪酸
MCD-methionine-choline-deficient diet LPS-lipopolysaccharide FFA-free fatty acid
5 病毒性肝炎
病毒性肝炎是肝炎病毒感染人体并进入肝脏后导致的一系列传染性疾病,如甲型、乙型和丙型等肝炎[31]。Pisonero-Vaquero等[32]利用体外模型发现槲皮素与干扰素α合用时,在含复制子的细胞中显示出明显的抗丙型肝炎病毒(hepatitis C virus,HCV)活性,并且能减少复制细胞中HCV诱导的活性氧和氮物质的产生以及脂质过氧化,降低FFA,并且对肝X受体(liver X receptors,LXR)α过表达和HCV复制能力具有抑制作用。这种作用与槲皮素抑制磷脂酰肌醇3-激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B/Akt)途径有关。Rojas等[33]发现槲皮素通过改变HCV的生命周期来抑制HCV基因组的复制,降低HCV的特异性感染力,并影响病毒体的完整性。还发现HCV感染的关键宿主因子二酰甘油O酰基转移酶同源物(diacylglycerol O-acyltransferase homolog,DGAT)是槲皮素的靶标之一,槲皮素可以通过上调脂肪酸合酶(fatty acid synthase,FASN)、LDL受体(LDL receptor,LDL-r)、乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)和甾醇调节元件转录因子1(sterol regulatory element-binding protein-1,SREBP1c)的表达,并通过抑制HCV的NS3丝氨酸蛋白酶活性来减少由HCV产生的活性物质。Bachmetov等[34]也发现槲皮素抑制HCV是通过抑制NS3蛋白酶的活性介导。通过体外催化实验发现槲皮素以一种剂量相关的方式直接抑制HCV的NS3蛋白酶活性。进一步研究表明,槲皮素在使用基因型为2a型的HCV病毒株感染克隆时,还能抑制HCV亚基因组RNA的复制,几乎完全阻断了HCV病毒的产生。Gonzalez等[35]发现槲皮素可通过抑制病毒蛋白的产生而达到治疗HCV的效果。将含有复制子的细胞以低密度(30%)接种,用槲皮素处理72 h后,HCV非结构蛋白5A(nonstructural protein 5A,NS5A)水平下降,表明内在核糖体进入位点(internal ribosome enter site,IRES)翻译受到抑制。研究还发现,槲皮素通过减少热休克蛋白(heat shock protein,HSP)40和HSP70抑制HCV的产生。
通过文献检索发现槲皮素对HCV病毒性肝炎作用的研究较多,对其他类型病毒性肝炎作用的研究却很少。Cheng等[36]探究了槲皮素对乙型肝炎病毒(hepatitis B virus,HBV)的作用,通过将槲皮素与转染HBV质粒的Huh-7细胞和HepG2.2.15细胞孵育。发现槲皮素可以降低2种细胞乙肝表面抗原(hepatitis B surface antigen,HBsAg)和乙肝e抗原(hepatitis B virus e antigen,HBeAg)的分泌,并降低HBV基因组DNA水平。进一步探究发现槲皮素对HBV的复制也有抑制作用。
槲皮素及其衍生物抗病毒性肝炎的作用机制见表5。
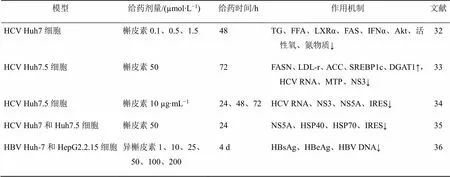
表5 槲皮素及其衍生物抗病毒性肝炎的作用机制
6 病理性肝损伤
病理性肝损伤是由某些疾病引起的继发性肝损伤,如糖尿病因葡萄糖和脂质代谢异常,从而对肝脏造成损害。Iskender等[37]利用链脲佐菌素(streptozotocin,STZ)诱导大鼠糖尿病,然后给予槲皮素100 mg/kg,共15 d。槲皮素组大鼠的葡萄糖、沉默信息协调因子1(sirtuin,SIRT1)、SOD和CAT水平升高,NF-κB和丙二醛的水平降低。Dias等[38]发现大鼠ip STZ 70 mg/kg会引起肝中TBARS浓度增加、SOD和CAT的活性显著增加,而槲皮素可以抑制这种变化。在注射STZ的大鼠中还发现了活化的NF-κB,iNOS蛋白水平增加,而给予槲皮素后可使之降低。在此项研究中,槲皮素对血糖水平并没有实质性的影响,但可以抑制糖尿病大鼠的氧化应激和NF-κB的活化,从而抑制继发性肝损伤。Peng等[39]发现在链霉素诱导的糖尿病大鼠中Akt、三酰甘油、总胆固醇、LDL-C和HDL-C都显著增高。槲皮素治疗后上述指标得到改善,且肝脏组织损伤得到缓解、肝糖原含量增加、肝SIRT1的表达和活性增强、葡萄糖激酶(recombinant glucokinase,GCK)蛋白表达上调,并通过磷酸化和脱乙酰化激活Akt信号通路。说明槲皮素可有效减轻链霉素造成糖尿病性肝损伤,这与SIRT1的活性和蛋白水平上调及其对Akt信号通路的影响有关。CYP2E1在糖尿病肝脏的应激性病理过程中起关键作用,CYP2E1活性增加可能是链霉素所致糖尿病性肝损伤的主要原因。Maksymchuk等[40]发现在链霉素诱导的糖尿病大鼠中CYP2E1的活性显著增加,而槲皮素可抑制其活性,并使氧化平衡稳态化,改善了肝细胞的超微结构,降低了ALT、AST、GGT的水平。说明槲皮素可以通过抑制CYP2E1预防糖尿病导致的肝脏氧化损伤。
缺血再灌注(ischemia-reperfusion,IR)损伤是缺血一段时间后又突然恢复供血(即再灌注)时出现的损伤。肝脏缺血再灌注损伤(ischemia-reperfusion injury,IRI)是肝切除、肝移植等疾病共有的病理过程。研究表明槲皮素可通过减少脂质过氧化作用和增强抗氧化系统,从而增强肝脏抵抗IRI的作用[41]。HO-1是血红素降解途径中的限速酶,对细胞的保护具有关键作用。Atef等[42]采用Wister大鼠建立IRI模型,结果显示槲皮素可增加HO-1的表达而减轻氧化应激和肝细胞变性,并降低了炎性细胞因子(IL-1β、IL-6)的表达,增加了抑制调亡标记物Bcl-2的表达。此实验结果证实了槲皮素可通过诱导HO-1而改善IRI。另有研究表明,在大鼠IR手术前分别给予槲皮素25、50、100 mg/kg,发现在槲皮素组中,大鼠的血清AST、ALT、丙二醛水平和组织丙二醛浓度随槲皮素剂量的升高而下降。且在槲皮素50 mg/kg组的大鼠中观察到最明显的组织学改善,说明使用合适剂量的槲皮素可有效预防肝脏IRI[43]。
槲皮素及其衍生物抗病理性肝损伤的作用机制见表6。
7 其他化学性肝损伤
化学性肝损伤是由化学肝毒性物质引起的,其发病机制与化学物质的毒性代谢产物所产生的氧化应激有关。当过多的毒性物质侵害机体,使机体的防御系统不堪重负时,化学物质的毒性代谢产物便会导致细胞信号传导失控和生物分子功能障碍,致使靶细胞的细胞器衰竭并最终引起肝细胞的死亡[44]。
在化学性肝损伤的研究中以四氯化碳(CCl4)诱导的肝损伤居多。三氯甲基自由基是CCl4的活性代谢产物,其经过肝微粒体CYP450活化而成,再与蛋白质结合之后形成共价键,从而损害线粒体,引起肝细胞死亡。Zhang等[45]发现槲皮素可以降低CCl4引起的肝脏丙二醛的增高,并增加GSH的含量,降低血清中ALT和AST的活性。槲皮素通过减轻CCl4中毒后引起的氧化应激从而减缓了CCl4诱导的急性肝损伤,这种保护效果可能和槲皮素所具有的抗氧化功能有关。Ma等[46]为探索槲皮素的防治机制,用小鼠进行了体内实验。结果表明槲皮素对于CCl4诱导的肝损伤有较为显著的抑制作用,这种抑制作用可能与其抗氧化活性及其调节TLR2、4和MAPK、NF-κB信号通路的能力有关。
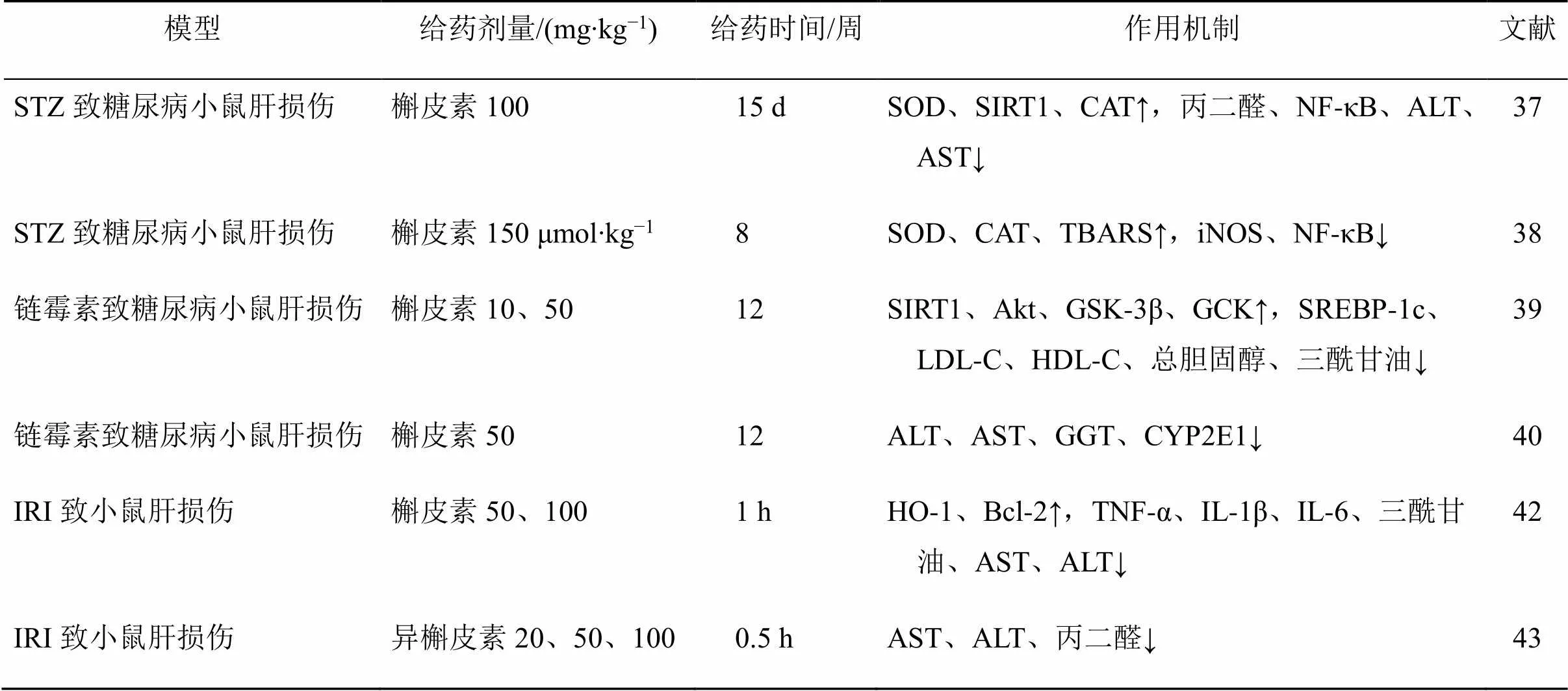
表6 槲皮素及其衍生物抗病理性肝损伤的作用机制
GSK-3β-糖原合成酶激酶-3β
GSK-3β-glycogen synthase kinase-3β
在研究化学性肝损伤时,除了用CCl4诱导肝损伤外,还可利用LPS和-半乳糖胺(-galactosamine,-GalN)联合制备的急性肝损伤模型。Kemelo等[47]在雄性Wistar大鼠ip-Gal N 400 mg/kg和LPS 10 mg/kg诱发肝损伤,其中一部分动物用ip槲皮素50 mg/kg进行预处理。通过生化实验和蛋白质印迹评估表明-Gal N/LPS处理可上调HO-1的表达,下调SIRT1的表达,降低AST/ALT的比值,并显著增加胆红素、CAT水平,而用槲皮素预处理可使-Gal N/LPS诱导的肝损伤大鼠的AST、ALT、胆红素等标志物水平恢复正常,说明槲皮素通过下调HO-1和上调SIRT1发挥抗-Gal N/LPS肝毒性的作用。此外,Peng等[48]研究发现槲皮素预处理可提高LPS诱导的小鼠的存活率并显著降低小鼠肝组织的病理学变化,减轻肝损伤。槲皮素可明显减少炎症细胞因子的产生,包括IL-6、IL-1β和TNF-α,并抑制NF-κB和MAPK信号通路的激活和下调凋亡相关蛋白的表达。
除以上常见化学物质诱导的肝损伤之外,金属镉也能引起肝损伤。Vicente-Sánchez等[49]探究了槲皮素对镉诱导的肝毒性作用,并探究了槲皮素的可能保护机制。结果发现,虽然槲皮素加金属镉组中的大鼠在氧化应激方面有改善,并增加了金属硫蛋白(metallothionein,MT)和内皮型一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)的表达,但槲皮素并不能阻止镉引起的肝损伤。因此,推测镉诱导的肝损伤除氧化应激外还有其他机制的参与。Liu等[50]利用代谢组学技术研究槲皮素对镉肝毒性的拮抗作用,结果发现与对照组相比,金属镉处理组的大鼠尿液中的代谢物与能量和脂质代谢相关的牛磺酸、磷酸肌酸、左旋肉碱和尿酸的含量显著降低,与抗氧化应激相关的胍基琥珀酸(guanidino succinic acid,GA)、多巴胺、尿囊酸的含量显著增加,而且高剂量(50 mg/kg)槲皮素可恢复上述代谢物含量的异常变化,说明槲皮素是通过调节能量和脂质代谢、增强抗氧化防御系统,从而达到拮抗镉肝毒性的作用。
此外,Huang等[51]还使用H2O2诱导的肝损伤模型对槲皮素7-鼠李糖苷(Q7R)进行了体内外实验研究,评价了Q7R的抗氧化能力。结果表明,Q7R对H2O2处理的正常肝细胞具有细胞保护和抗氧化作用。而且Q7R剂量相关性地降低了ALT、AST、LDH和三酰甘油的含量。Q7R还减少了丙二醛的生产,并增加了肝内GSH含量,提高了CAT的活性。这表明Q7R具有强大的抗氧化能力,有望用来治疗肝损伤。
鱼藤酮是一种异黄酮类的植物杀虫剂,误服会中毒,引起肝肾损害。给予雄性Wistar大鼠鱼藤酮10 d,可诱导大鼠发生肝损害。槲皮素5、10、20 mg/kg进行后处理,给药3 d可明显减弱鱼藤酮中毒引起的肝脏损害。具体表现在降低了氧化应激标记物活性,如SOD和GSH,还降低了髓过氧化物酶(myeloperoxidase,MPO)、黄嘌呤氧化酶(xanthione oxidase,XOD)等与炎症有关酶的活性水平,并降低了转氨酶、谷氨酰转肽酶、胆红素和LDH的水平,表明槲皮素在鱼藤酮引起的肝损伤方面具有一定的研究价值[52]。
槲皮素及其衍生物抗其他化学性肝损伤的作用见表7。

表7 槲皮素及其衍生物抗其他化学性肝损伤的作用
8 结语与展望
肝脏是人体的重要器官,是合成、代谢和解毒的主要场所,所以如何有效地防治肝损伤是国内外一直在探讨的重要问题。本文对天然黄酮类化合物槲皮素防治各种实验性肝损伤的研究进展进行了综述。通过对文献的梳理,发现槲皮素对多种实验性肝损伤均具有防治作用,其中对化学性肝损伤、病理性和药物性肝损伤防治的研究较多,对病毒性肝损伤的研究也较多,但主要涉及丙型肝炎;而在防治免疫性肝损伤及其他病毒性肝损伤研究文献较少。其防治肝损伤的机制涉及多个方面,如减轻氧化应激和炎症反应、影响脂质代谢、抗病毒和调节免疫等。涉及的信号通路及关键靶点有NF-κB信号通路的TLR、IκB等,MAPK信号通路的ERK、p38和JNK,Akt信号通路的GSK3β、mTOR等,Nrf2信号通路的HO-1、NQO1和Keap1,STAT信号通路的JAK、IFN等。
虽然槲皮素防治实验性肝损伤的研究较多,但槲皮素在临床上用于防治肝脏疾病的研究却比较少见。Lu等[53]对槲皮素进行了第1阶段剂量研究,评估了槲皮素对30例未经治疗的慢性HCV感染患者的安全性,并初步确定槲皮素在抑制病毒载量和肝损伤方面的潜力。研究表明,槲皮素与某些药物联合应用可提高抗肝脏肿瘤的疗效,与黄酮类化合物联用后对肝脏肿瘤细胞增殖的抑制作用增强[54]。
综上所述,本文主要对槲皮素及其衍生物防治肝损伤作用及其机制的研究进展进行了整理,希望可为槲皮素进一步开展临床试验研究提供参考,为以槲皮素为主要成分的制剂进入临床治疗奠定基础,并挖掘出槲皮素在各种不同类型的肝损伤防治方面可能具有的潜在临床价值,同时槲皮素防治不同类型肝损伤的作用靶点将为开发防治肝病的药物提供借鉴。
利益冲突 所有作者均声明不存在利益冲突
[1] 辛秀, 袁琳, 王兴, 等. 槲皮素对肝脏的药理作用研究进展 [J]. 中国中医药信息杂志, 2008, 15(S1): 102-104.
[2] 马纳, 李亚静, 范吉平. 槲皮素药理作用研究进展 [J]. 辽宁中医药大学学报, 2018, 20(8): 221-224.
[3] Schaefer T J, John S.[M]. Treasure Island: StatPearls Publishing, 2020.
[4] Nguyen N U, Stamper B D. Polyphenols reported to shift APAP-induced changes in MAPK signaling and toxicity outcomes [J]., 2017, 277: 129-136.
[5] Xie W, Wang M, Chen C,. Hepatoprotective effect of isoquercitrin against acetaminophen-induced liver injury [J]., 2016, 152: 180-189.
[6] Yousef M I, Omar S A, El-Guendi M I,. Potential protective effects of quercetin and curcumin on paracetamol-induced histological changes, oxidative stress, impaired liver and kidney functions and haematotoxicity in rat [J]., 2010, 48(11): 3246-3261.
[7] Carrasco-Pozo C, Gotteland M, Castillo R L,. 3,4-Dihydroxyphenylacetic acid, a microbiota-derived metaboliteof quercetin, protects against pancreatic β-cells dysfunction induced by high cholesterol [J]., 2015, 334(2): 270-282.
[8] Shabbir M, Afsar T, Razak S,. Phytochemical analysis and Evaluation of hepatoprotective effect ofroyleanus leaves extract against anti-tuberculosis drug induced liver injury in mice [J]., 2020, 19(1): 46.
[9] Taslidere E, Dogan Z, Elbe H,. Quercetin protection against ciprofloxacin induced liver damage in rats [J]., 2016, 91(2): 116-121.
[10] Wu L, Wang C, Li J,. Hepatoprotective effect of quercetin via TRAF6/JNK pathway in acute hepatitis [J]., 2017, 96: 1137-1146.
[11] 秦佩, 雷志明, 吴双, 等. 槲皮素对Con A诱导自身免疫性肝损伤作用 [J]. 中国公共卫生, 2015, 31(6): 757-759.
[12] Zhao M, Chen J, Zhu P,. Dihydroquercetin (DHQ) ameliorated concanavalin A-induced mouse experimental fulminant hepatitis and enhanced HO-1 expression through MAPK/Nrf2 antioxidant pathway in RAW cells [J]., 2015, 28(2): 938-944.
[13] Chen J, Sun X, Xia T,. Pretreatment with dihydroquercetin, a dietary flavonoid, protected against concanavalin A-induced immunological hepatic injury in mice and TNF-α/ActD-induced apoptosis in HepG2 cells [J]., 2018, 9(4): 2341-2352.
[14] Wang J M, Miao M S, Zhang Y Y,. Quercetin ameliorates liver injury induced withglycosides by reducing oxidative stress and inflammation [J]., 2015, 93(6): 427-433.
[15] Wei C B, Tao K, Jiang R,. Quercetin protects mouse liver against triptolide-induced hepatic injury by restoring Th17/Treg balance through Tim-3 and TLR4-MyD88-NF-κB pathway [J]., 2017, 53: 73-82.
[16] 魏彩冰. 基于Th17/Treg细胞平衡探讨槲皮素治疗免疫性肝损伤的作用机制 [D]. 重庆: 重庆医科大学, 2017.
[17] Hoek J B, Pastorino J G. Ethanol, oxidative stress, and cytokine-induced liver cell injury [J]., 2002, 27(1): 63-68.
[18] Liu S, Hou W, Yao P,. Quercetin protects against ethanol-induced oxidative damage in rat primary hepatocytes [J]., 2010, 24(2): 516-522.
[19] Zhu M, Zhou X, Zhao J. Quercetin prevents alcohol-induced liver injury through targeting of PI3K/Akt/nuclear factor-κB and STAT3 signaling pathway [J]., 2017, 14(6): 6169-6175.
[20] Liu S, Tian L, Chai G,. Targeting heme oxygenase-1 by quercetin ameliorates alcohol-induced acute liver injury via inhibiting NLRP3 inflammasome activation [J]., 2018, 9(8): 4184-4193.
[21] 刘姝. 急性酒精性肝损伤中槲皮素抗氧化应激及抗炎作用交互影响的机制研究 [D]. 沈阳: 中国医科大学, 2018.
[22] Lee S, Lee J, Lee H,. Relative protective activities of quercetin, quercetin-3-glucoside, and rutin in alcohol-induced liver injury [J]., 2019, 43(11): e13002.
[23] Bae M, Park Y K, Lee J Y. Food components with antifibrotic activity and implications in prevention of liver disease [J]., 2018, 55: 1-11.
[24] Surapaneni K M, Jainu M. Pioglitazone, quercetin and hydroxy citric acid effect on hepatic biomarkers in non alcoholic steatohepatitis [J]., 2014, 6(2): 153-162.
[25] Marcolin E, Forgiarini L F, Rodrigues G,. Quercetin decreases liver damage in mice with non-alcoholic steatohepatitis [J]., 2013, 112(6): 385-391.
[26] Surapaneni K M, Priya V V, Mallika J. Pioglitazone, quercetin and hydroxy citric acid effect on cytochrome P450 2E1 (CYP2E1) enzyme levels in experimentally induced non alcoholic steatohepatitis (NASH) [J]., 2014, 18(18): 2736-2741.
[27] Bieghs V, Walenbergh S M, Hendrikx T,. Trapping of oxidized LDL in lysosomes of Kupffer cells is a trigger for hepatic inflammation [J]., 2013, 33(7): 1056-1061.
[28] Liu L, Gao C, Yao P,. Quercetin alleviates high-fat diet-induced oxidized low-density lipoprotein accumulation in the liver: Implication for autophagy regulation [J]., 2015, 2015: 607531.
[29] Qin G H, Ma J, Huang Q S,. Isoquercetin improves hepatic lipid accumulation by activating AMPK pathway and suppressing TGF-β signaling on an HFD-induced nonalcoholic fatty liver disease rat model [J]., 2018, 19(12): 4126.
[30] Xu Y, Han J C, Dong J J,. Metabolomics characterizes the effects and mechanisms of quercetin in nonalcoholic fatty liver disease development [J]., 2019, 20(5): 1220.
[31] Miltonprabu S, Tomczyk M, Skalicka-Woźniak K,. Hepatoprotective effect of quercetin: From chemistry to medicine [J]., 2017, 108(Pt B): 365-374.
[32] Pisonero-Vaquero S, García-Mediavilla M V, Jorquera F,. Modulation of PI3K-LXRα-dependent lipogenesis mediated by oxidative/nitrosative stress contributes to inhibition of HCV replication by quercetin [J]., 2014, 94(3): 262-274.
[33] Rojas Á, Del Campo J A, Clement S,. Effect of quercetin on hepatitis C virus life cycle: From viral to host targets [J]., 2016, 6: 31777.
[34] Bachmetov L, Gal-Tanamy M, Shapira A,. Suppression of hepatitis C virus by the flavonoid quercetin is mediated by inhibition of NS3 protease activity [J]., 2012, 19(2): e81-e88.
[35] Gonzalez O, Fontanes V, Raychaudhuri S,. The heat shock protein inhibitor Quercetin attenuates hepatitis C virus production [J]., 2009, 50(6): 1756-1764.
[36] Cheng Z, Sun G, Guo W,. Inhibition of hepatitis B virus replication by quercetin in human hepatoma cell lines [J]., 2015, 30(4): 261-268.
[37] Iskender H, Dokumacioglu E, Sen T M,. The effect of hesperidin and quercetin on oxidative stress, NF-κB and SIRT1 levels in a STZ-induced experimental diabetes model [J]., 2017, 90: 500-508.
[38] Dias A S, Porawski M, Alonso M,. Quercetin decreases oxidative stress, NF-κB activation, and iNOS overexpression in liver of streptozotocin-induced diabetic rats [J]., 2005, 135(10): 2299-2304.
[39] Peng J, Li Q, Li K,. Quercetin improves glucose and lipid metabolism of diabetic rats: Involvement of Akt signaling and SIRT1 [J]., 2017, 2017: 3417306.
[40] Maksymchuk O, Shysh A, Rosohatska I,. Quercetin prevents type 1 diabetic liver damage through inhibition of CYP2E1 [J]., 2017, 69(6): 1386-1392.
[41] Gholampour F, Sadidi Z. Hepatorenal protection during renal ischemia by quercetin and remote ischemic perconditioning [J]., 2018, 231: 224-233.
[42] Atef Y, El-Fayoumi H M, Abdel-Mottaleb Y,. Quercetin and tin protoporphyrin attenuate hepatic ischemia reperfusion injury: Role of HO-1 [J]., 2017, 390(9): 871-881.
[43] Uylaş M U, Şahin A, Şahintürk V,. Quercetin dose affects the fate of hepatic ischemia and reperfusion injury in rats: An experimental research [J]., 2018, 53: 117-121.
[44] Nakagawa H, Maeda S. Molecular mechanisms of liver injury and hepatocarcinogenesis: Focusing on the role of stress-activated MAPK [J]., 2012, 2012: 172894.
[45] Zhang J Q, Shi L, Xu X N,. Therapeutic detoxification of quercetin against carbon tetrachloride-induced acute liver injury in mice and its mechanism [J]., 2014, 15(12): 1039-1047.
[46] Ma J Q, Li Z, Xie W R,. Quercetin protects mouse liver against CCl4-induced inflammation by the TLR2/4 and MAPK/NF-κB pathway [J]., 2015, 28(1): 531-539.
[47] Kemelo M K, Kutinová Canová N, Horinek A,. Sirtuin-activating compounds (STACs) alleviate-galactosamine/lipopolysaccharide-induced hepatotoxicity in rats: Involvement of sirtuin 1 and heme oxygenase 1 [J]., 2017, 66(3): 497-505.
[48] Peng Z, Gong X, Yang Y,. Hepatoprotective effect of quercetin against LPS/d-GalN induced acute liver injury in mice by inhibiting the IKK/NF-κB and MAPK signal pathways [J]., 2017, 52: 281-289.
[49] Vicente-Sánchez C, Egido J, Sánchez-González P D,. Effect of the flavonoid quercetin on cadmium-induced hepatotoxicity [J]., 2008, 46(6): 2279-2287.
[50] Liu Y, Zhang X, Guan T,. Effects of quercetin on cadmium-induced toxicity in rat urine using metabonomics techniques [J]., 2020, 39(4): 524-536.
[51] Huang Z Q, Chen P, Su W W,. Antioxidant activity and hepatoprotective potential of quercetin 7-rhamnosideand[J]., 2018, 23(5): 1188.
[52] Akinmoladun A C, Oladejo C O, Josiah S S,. Catechin, quercetin and taxifolin improve redox and biochemical imbalances in rotenone-induced hepatocellular dysfunction: Relevance for therapy in pesticide-induced liver toxicity? [J]., 2018, 25(4): 365-371.
[53] Lu N T, Crespi C M, Liu N M,. A phase I dose escalation study demonstrates quercetin safety and explores potential for bioflavonoid antivirals in patients with chronic hepatitis C [J]., 2016, 30(1): 160-168.
[54] Fernández-Palanca P, Fondevila F, Méndez-Blanco C,. Antitumor effects of quercetin in hepatocarcinomaandmodels: A systematic review [J]., 2019, 11(12): 2875.
Research progress on quercetin and its derivatives in prevention and treatment of liver injury
ZHANG Juan, MAO Wen-jing, BAI Qing-yun
Jiangxi Key Laboratory of Active Ingredients Research of Natural Drug, College of Chemistry and Bioengineering, Yichun University, Yichun 336000, China
Quercetin is a kind of polyhydroxylated flavone compounds, which is widely found in a variety of medicinal plants. It has multiple biological functions, such as antioxidant, antiviral, antibacterial, anti-inflammatory and anti-tumor activities, etcBy searching the literatures about quercetin and its derivatives on prevention and treatment of liver injury in the past ten years, quercetin and its derivatives were found that they were good remedy for various acute and chronic liver injuries, and their mechanism of action mainly involved anti-oxidation, anti-inflammation, regulation of lipid metabolism, anti-apoptosis, autophagy and anti-virus, etc. Research progress on quercetin and its derivatives in prevention and treatment of different types of liver injury were reviewed in this paper, so as to provide comprehensive literature information support for in-depth study on hepatoprotective effect of quercetin.
quercetin; quercetin derivatives; liver protection; hepatoprotective mechanism; liver injury
R282.710.5
A
0253 - 2670(2021)23 - 7348 - 10
10.7501/j.issn.0253-2670.2021.23.030
2021-05-25
国家自然科学基金资助项目(81960748)
张 娟,硕士研究生,研究方向为临床药学。E-mail: 2103840739@qq.com
白庆云,副教授,研究方向为药物性肝损伤及中药的保肝活性。E-mail: baiqingyun@163.com
[责任编辑 崔艳丽]
