根皮苷对食管癌细胞系表达谱的影响
2021-12-04杨照环胡文倩贾祯贤谢俞宁龙月红邢朝斌张雪梅
杨照环,胡文倩,贾祯贤,谢俞宁,张 志*,龙月红,邢朝斌,张雪梅, *
根皮苷对食管癌细胞系表达谱的影响
杨照环1,胡文倩2,贾祯贤2,谢俞宁2,张 志1*,龙月红3,邢朝斌3,张雪梅2, 3*
1.华北理工大学附属唐山市工人医院,河北 唐山 063000 2.华北理工大学公共卫生学院,河北 唐山 063210 3. 华北理工大学生命科学学院,河北 唐山 063210
研究根皮苷对食管癌细胞系表达谱的影响,探索根皮苷作用于食管癌细胞系的信号通路及其潜在功能。使用根皮苷处理人食管癌KYSE450细胞,提取总RNA并建立测序文库,进行转录组测序;使用DESeq2程序鉴定差异表达基因,对差异表达基因进行基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析;使用MCODE进行差异基因核心模块筛选,使用GEPIA数据库分析核心模块中的基因对食管癌生存的影响;使用TIMER在线分析根皮苷对食管癌组织免疫细胞浸润的影响。转录组测序结果显示,根皮苷处理后的食管癌细胞具有4602个差异表达基因,其中2407个为上调基因,2195个为下调基因。通路富集分析显示,根皮苷对蛋白质加工、胰岛素抵抗、基因复制和细胞周期等信号通路产生影响。在差异表达基因核心模块中,E3泛素蛋白连接酶2(E3 ubiquitin ligase mind bomb 2,)高表达可降低食管癌患者的总体生存率;环指蛋白19B(ring finger protein 19B,)、三重基序蛋白69(tripartite motif-containing protein 69,)、泛素连接酶(ubiquitin conjugating enzyme,)和克隆E3泛素连接酶(homologous to the E6-associated protein carboxyl terminus domain containing 2,)的表达水平可影响食管癌癌组织的纯度以及免疫细胞浸润的类型。根皮苷可影响食管癌细胞的转录谱,其差异表达基因主要集中在细胞生长相关的信号通路。
根皮苷;食管癌;转录组测序;免疫浸润;E3泛素蛋白连接酶2;环指蛋白19B;三重基序蛋白69;泛素连接酶;克隆E3泛素连接酶
当前癌症仍是重要的公共卫生问题,在我国食管癌发病人数居于第6位,死亡人数居于第4位,给人民健康带来巨大负担[1]。食管癌致病因素复杂,抽烟[2]、酗酒[3]、胃食管反流[4]和遗传因素[5-7]均是食管癌发病的重要原因。食管癌是全世界最致命的恶性肿瘤之一,新辅助放化疗已被广泛用于食管癌治疗并取得了良好的效果[8]。但是,依然有60%的患者对新辅助放化疗不敏感[9-10],这无疑降低了手术的成功率,提示食管癌的治疗离不开药物的配合。
多穗石柯(Wall.) Rehd.在中国民间俗称“甜茶”,根皮苷是甜茶的主要成分,是二氢查耳酮家族的重要成员,也是苹果属植物中的主要酚类葡萄糖苷,具有抗氧化、抗高血压、抗糖尿病和抗肿瘤等作用。早在1993年,Nelson等[11]便发现了根皮苷具有抑制肿瘤细胞生长的作用;Chen等[12]发现三乙酰根皮苷能够抑制肿瘤细胞系HepG2的增殖活性;根皮苷能够通过抑制氧化应激和炎症反应来抑制顺铂对小鼠的肾毒性[13],提示根皮苷具有抑制肿瘤和作为肿瘤治疗辅助药物的潜质。本课题组前期研究发现,根皮苷可显著抑制食管癌细胞的增殖、侵袭和迁移[14]。为了进一步探索根皮苷影响食管癌进展的作用机制,本研究使用高通量测序技术,考察经根皮苷处理的食管癌细胞的转录组变化,以揭示根皮苷作用于食管癌细胞的信号通路和生物学功能,为根皮苷应用于食管癌治疗提供转录组层面的证据。
1 材料
1.1 细胞株
人食管癌KYSE450细胞由日本兵库医学院的Y. Shimada博士馈赠。
1.2 药材
多穗石柯甜茶叶采自中国广西巴马县,经华北理工大学邢朝斌教授鉴定为壳斗科植物多穗石柯(Wall.) Rehd.的叶。
1.3 药品与试剂
胎牛血清、RPMI 1640完全培养基购自美国Thermo Fisher Scientific公司;二甲基亚砜(DMSO)购自美国Sigma公司;TRIzol试剂购自美国Invitrogen公司;Qubit RNA检测试剂盒购自美国Life Technologies公司;NEBNext Ultra RNA库制备试剂盒购自美国New England Biolabs公司。
1.4 仪器
细胞培养箱(中国力康生物医疗科技有限公司);Acquity超高效液相色谱仪(美国Waters公司);分光光度计(美国Implen公司);2100 Bioanalyzer系统(美国Agilent公司)。
2 方法
2.1 根皮苷的提取
将新鲜的甜茶叶干燥、过筛并浸入乙醇溶液中,超声提取20 min,真空滤过,提取物浓缩去除乙醇,冷冻干燥得到粗产物。随后,将5 g粗产物于水中溶解,并上样于处理过的大孔树脂柱中30 min。用去离子水洗涤大孔树脂柱以除去杂质,并用75%乙醇洗涤根皮苷,将洗脱液浓缩,从乙醇中分离,于0 ℃重结晶。结晶产物滤过,得到根皮苷单体。使用超高效液相色谱仪测定根皮苷单体的质量分数≥95%。
2.2 细胞培养
KYSE450细胞用含10%胎牛血清的RPMI 1640完全培养基,于37 ℃、5% CO2的培养箱培养。
2.3 细胞RNA提取及测序
取处于对数生长期的KYSE450细胞接种于6孔板中,2×105/孔,培养12 h。根皮苷溶于DMSO,由预实验可知根皮苷半数抑制浓度(half inhibitory concentration,IC50)为0.6 mmol/L,故使用略小于IC50的0.5 mmol/L根皮苷进行后续实验。设置对照组和3个根皮苷(0.5 mmol/L)组,给药组加入药物,对照组加入不含药物的培养基,培养48 h。
按照试剂盒说明书提取细胞总RNA,使用分光光度计和Qubit 2.0 Flurometer中的Qubit RNA检测试剂盒测定RNA纯度和浓度;使用2100 Bioanalyzer系统评估RNA的完整性;使用NEBNext Ultra RNA库制备试剂盒构建RNA测序文库。使用Illumina Hiseq 4000测序平台对构建好的文库进行测序,测序完成后进行数据收集和处理,以上测序服务由北京百奥生物科技有限公司完成。
2.4 数据处理和差异分析
FASTQ格式的原始数据首先进行处理获得clean data,使用TopHat软件进行比对,使用Cufflinks软件获得各个基因的数值用于后续分析。使用R包“DESeq2”进行差异分析,将|Log2fold change|>1和校正后<0.05作为筛选差异基因的阈值,进行差异表达基因(differential expression genes,DEGs)的筛选;使用R包“ggplot2”“ggtree”进行热图绘制、聚类和各种可视化。
2.5 通路注释和功能富集分析
对于DEGs,使用R包“clusterProfiler”和“enrichplot”进行基因本体(gene ontology,GO)功能富集分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,<0.05认为差异具有统计学意义。
2.6 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建与关键DEGs的筛选
使用STRING数据库(http://string-db.org/)进行网络构建,使用Cytoscape软件进行后续分析。使用Cytoscape内插件MCODE选择包含做多节点数的基因集,根据MCODE分析结果,对各个module进行排序,排序最前的即为关键module,并使用Cytoscape软件内置ClueGo插件对关键module内所含基因进行GO功能富集和KEGG通路分析。
2.7 DEGs的数据库验证与预后的关系
GEPIA包括了TCGA数据库的测序数据,本研究使用GEPIA对DEGs在人群中的状况进行验证,并使用GEPIA中的预后分析模块验证基因表达对食管癌预后的影响,<0.05认为差异具有统计学意义。
2.8 关键DEGs与免疫细胞之间的相关性
TIMER数据库可用于计算6个浸润免疫细胞(CD4+T细胞、CD8+T细胞、B细胞、嗜中性粒细胞、巨噬细胞和树突状细胞)与DEGs表达的相关性,对于与预后相关的DEGs,使用TIMER数据库进行Spearman相关性计算,依次确认所研究基因与免疫细胞之间的相关性;相关系数值<0.3表示相关可忽略,相关系数绝对值≥0.3表示具有正/负相关性,<0.05认为差异具有统计学意义。
3 结果
3.1 根皮苷影响KYSE450细胞表达谱
通过测序和比对,除去表达过低的转录本,共得到15 339个基因。进行表达量差异分析,结果显示共计4602个DEGs,可见约30%的基因表达发生了改变;其中2407个呈上调状态,2195个呈下调状态;DEGs中表达上调基因略多于表达下调基因(图1-A)。基因表达聚类热图显示,经过根皮苷处理后,3个重复的根皮苷处理组KYSE450细胞表达谱能够聚类,且与对照组差异明显(图1-B),提示根皮苷处理组表达谱与对照组表达谱具有异质性。上述结果显示,根皮苷能够改变KYSE450细胞的表达谱。
3.2 DEGs的KEGG通路分析
将差异基因分为表达上调组和表达下调组,分别使用R包“clusterProfiler”进行KEGG通路分析,上调组和下调组通路富集<0.05的结果见图2,表达上调的DEGs主要影响了内质网中的蛋白质加工、胰岛素抵抗、动物线粒体、ErbB信号通路和溶酶体等途径;表达下调的DEGs主要影响了基因复制、细胞周期、同源重组、范可尼贫血途径和Hippo信号通路。上述结果显示,使用根皮苷进行处理后,KYSE450细胞的基因复制和细胞周期相关基因下调,而溶酶体通路、ErbB信号通路相关基因上调,这些基因与细胞的增殖和凋亡密切相关,提示根皮苷可能通过影响这些通路改变了KYSE450细胞的增殖水平,发挥了抑制食管癌细胞生长的作用。
3.3 DEGs的GO功能富集分析
使用R包“clusterProfiler”进行基因本体分析,GO功能富集结果<0.05认为具有统计学意义,按照值进行排序,各取前5进行展示(表1、2)。对表达上调的DEGs分析结果显示,这些基因在分子功能(molecular function,MF)层面影响了GTP酶结合等,细胞组分(cellular component,CC)层面影响了内质网-高尔基体中间区等,生物过程(biological process,BP)层面影响了细胞对未折叠蛋白的作用等;对于表达下调的DEGs分析结果显示,在MF层面影响了单链DNA结合等,CC层面影响了染色体区域等,BP层面影响了基因复制等。
3.4 PPI网络构建和关键模块筛选
使用STRING数据库构建了DEGs的PPI网络,导入Cytoscape软件进行分析,使用MCODE软件确定PPI网络中的核心模块,前3个模块见图3,将排序第1的模块为核心模块,核心模块1包含36个节点和630条边,所含基因包括泛素结合酶E2H(ubiquitin conjugating enzyme E2H,)、环指蛋白41(ring finger protein 41,)和细胞因子信号抑制因子3(suppressor of cytokine signaling 3,)等。

A-DEGs火山图 B-DEGs热图
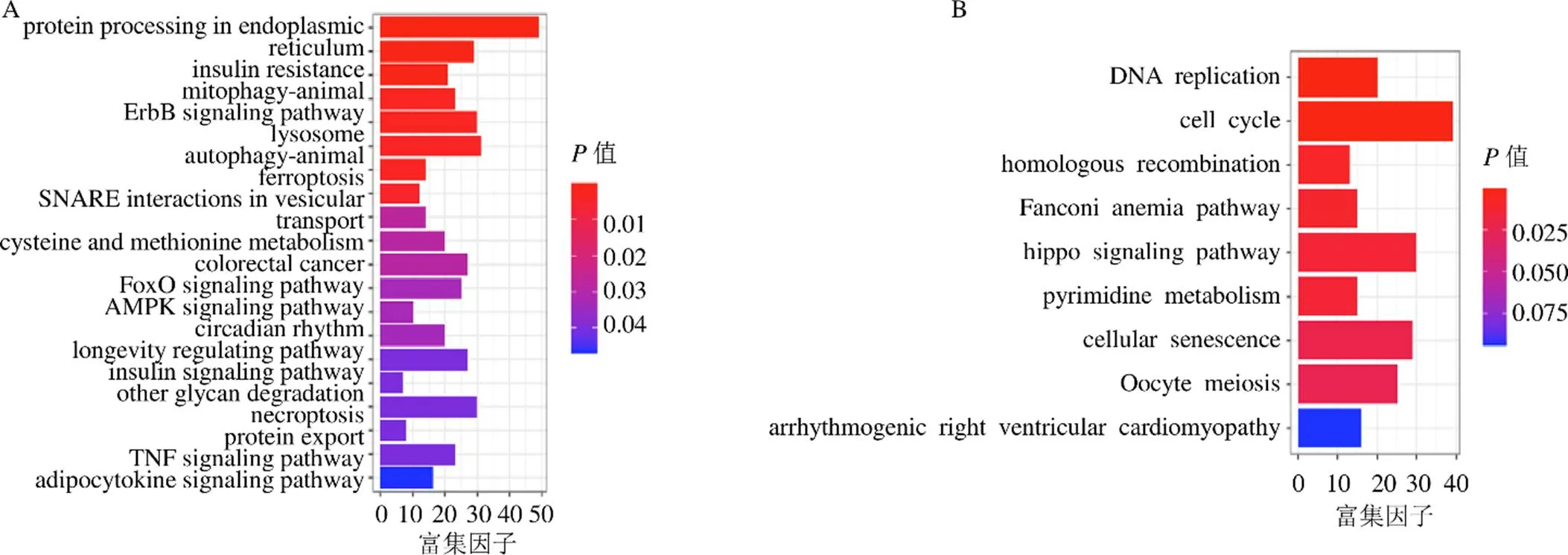
A-上调DEGs的KEGG通路分析 B-下调DEGs的KEGG通路分析

表1 上调DEGs的GO功能富集分析

表2 下调DEGs的GO功能富集分析
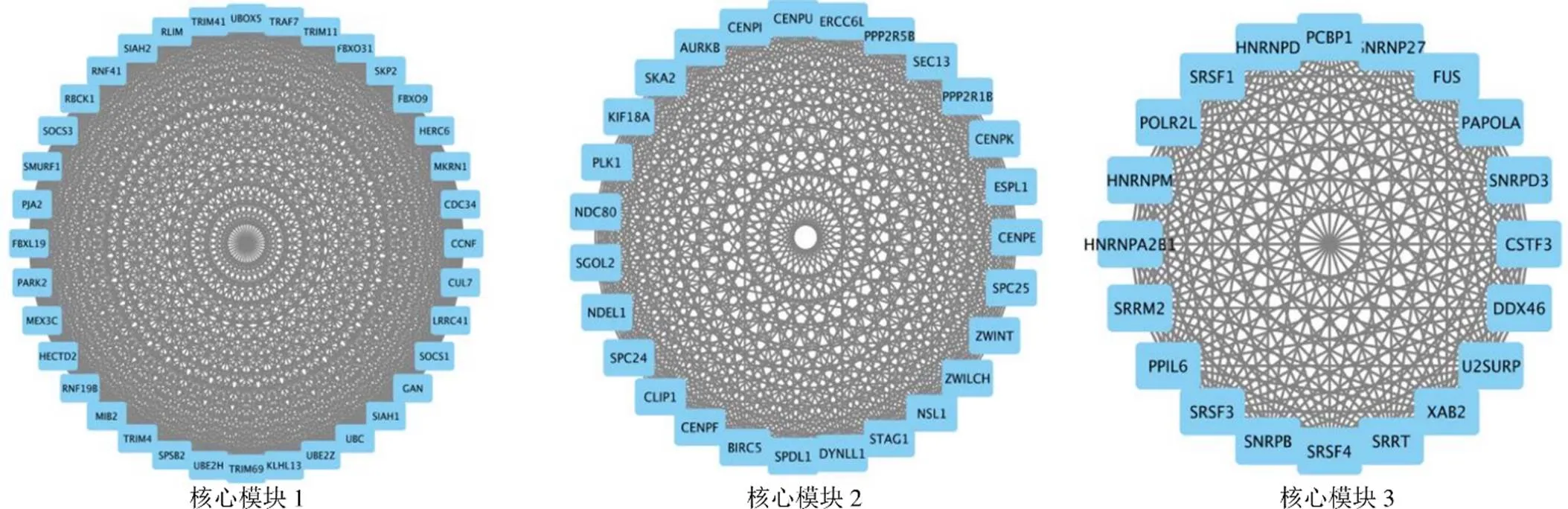
图3 PPI网络分析
将核心模块1中的所有基因纳入KEGG和GO分析,可见核心模块1所含基因影响了热量生成和蛋白质消化吸收相关信号通路(图4-A),影响了细胞外基质强度结构成分、金属羧肽酶活性和细胞色素C氧化酶活性及相关功能(图4-B)。
3.5 关键模块中预后和免疫细胞浸润基因的鉴定
使用GEPIA数据库研究核心模块1中基因对食管癌预后的关系,发现在TCGA数据库中,E3泛素蛋白连接酶2(E3 ubiquitin ligase mind bomb 2,)基因呈高表达,且高表达是食管癌不良预后因素(图5)。为了确定免疫细胞的肿瘤浸润与免疫相关基因表达之间是否存在相关性,通过TIMER 2.0分析多个免疫细胞的肿瘤浸润的情况,结果发现,表达与树突状细胞浸润水平呈正相关,三重基序蛋白69(tripartite motif-containing protein 69,)表达与食管癌细胞纯度呈负相关,泛素连接酶(ubiquitin conjugating enzyme,)表达与树突状细胞浸润水平呈正相关,克隆E3泛素连接酶(homologous to the E6-associated protein carboxyl terminus domain containing 2,)与巨噬细胞浸润水平呈正相关(图6)。

图4 模块1中基因的KEGG通路(A) 和GO功能(B) 富集分析
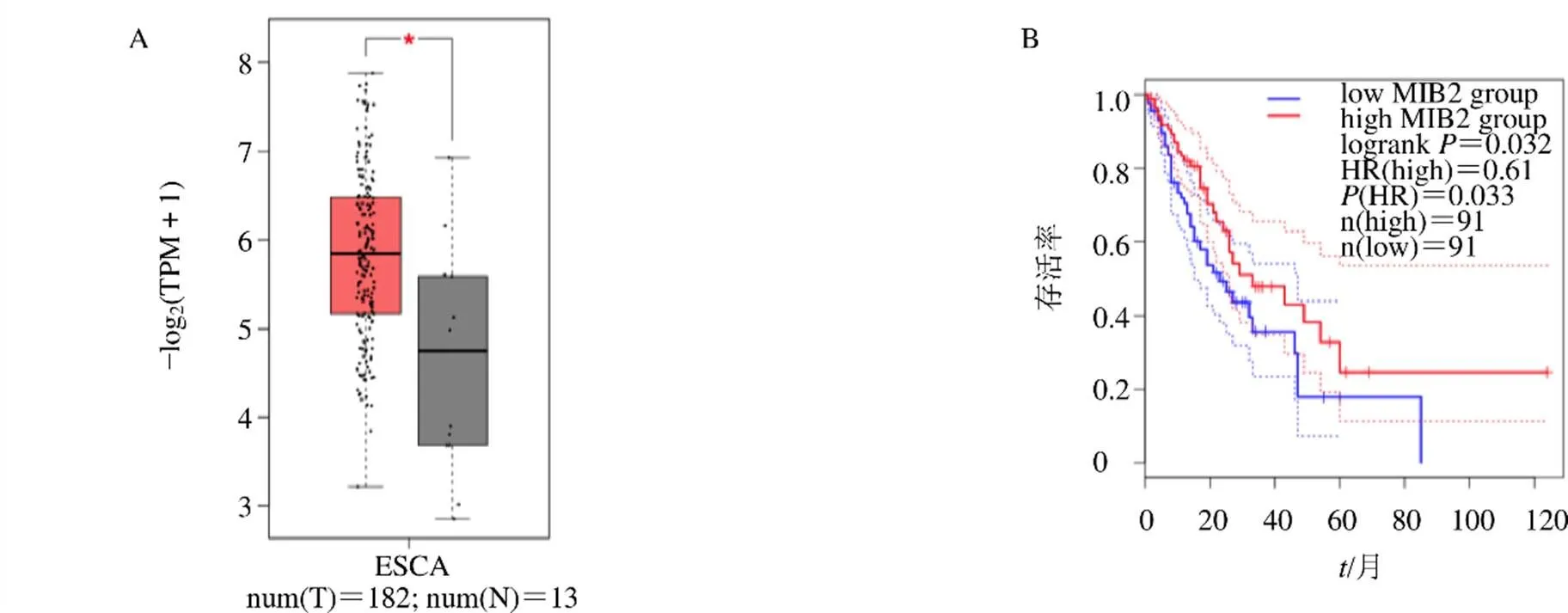
A-MIB2基因在食管癌组织中的表达情况箱线图 B-MIB2基因表达对食管癌预后的影响
4 讨论
转录组测序是重要的生物信息学方法,在癌症患者筛查中得到广泛应用[15]。本研究使用转录组测序技术研究根皮苷对食管癌细胞系表达谱的影响。结果显示,根皮苷能够改变KYSE450细胞的表达谱,其中2407个基因上调,2195个基因下调。对DEGs进行KEGG和GO分析,确定了这些差异基因影响了内质网中的蛋白质加工、胰岛素抵抗、基因复制、细胞周期、GTP酶结合和单链DNA结合等功能。基因复制和细胞周期相关基因下调,提示根皮苷可能影响KYSE450细胞的复制过程,具有抑制食管癌细胞生长的潜力。既往研究也发现根皮苷能够抑制皮肤癌细胞[16]、肝癌细胞[17]、乳腺癌细胞[18-19]等的增殖和凋亡。

图6 关键模块内基因表达与免疫浸润水平的相关性
同时,本研究还构建了PPI网络研究DEGs的互作用情况,核心模块1中,高表达是食管癌不良预后因素,可介导Notch信号通路中蛋白的泛素化,并且能够作为黑色素瘤侵袭的抑制剂[20]。Sahar等[21]研究发现,在子宫平滑肌瘤中表达上调,提示能够作为子宫平滑肌瘤治疗的潜在靶标,在食管癌中研究甚少,需要进一步探索。对核心模块1内部的基因进行功能挖掘,发现细胞外基质强度结构成分、金属羧肽酶活性和细胞色素C氧化酶活性等功能受到了影响;细胞色素C氧化酶作用失调被认为是癌症、糖尿病等的致病和进展因素之一[22],细胞色素C氧化酶相关基因在结直肠癌[23]、肺腺癌[24]和黑色素瘤[25]中具有差异表达,并具有一定的潜在治疗价值,提示细胞色素C氧化酶相关功能的活性可能是食管癌进展的潜在生物标志物。
核心模块1中的基因能够影响食管癌的免疫微环境。本研究发现、、和对食管癌肿瘤组织浸润的细胞类型和肿瘤纯度均有影响。树突状细胞(DC细胞)是抗原呈递细胞,包含多种亚型,可以驻留在器官中或在淋巴器官和非淋巴器官之间迁移。Sadeghzadeh等[26]认为DC细胞是刺激抗肿瘤免疫中的最关键的部分;大量研究显示,DC细胞及其衍生物能够应用于抗癌治疗[27-30]。这些结果表明,根皮苷治疗可能改变食管癌所处的免疫微环境,进而影响食管癌的发展进程。
综上所述,本研究发现根皮苷能够改变KYSE450细胞的表达谱,影响KYSE450细胞的复制、细胞色素C氧化酶活性等与癌症进展关联密切的功能,并影响食管癌免疫微环境。
利益冲突 所有作者均声明不存在利益冲突
[1] Cao W, Chen H D, Yu Y W,. Changing profiles of cancer burden worldwide and in China: A secondary analysis of the global cancer statistics 2020 [J].: Engl, 2021, 134(7): 783-791.
[2] Cook M B, Kamangar F, Whiteman D C,. Cigarette smoking and adenocarcinomas of the esophagus and esophagogastric junction: A pooled analysis from the international BEACON consortium [J]., 2010, 102(17): 1344-1353.
[3] Pandeya N, Williams G, Green A C,. Alcohol consumption and the risks of adenocarcinoma and squamous cell carcinoma of the esophagus [J]., 2009, 136(4): 1215-1224.
[4] Cook M B, Corley D A, Murray L J,. Gastroesophageal reflux in relation to adenocarcinomas of the esophagus: A pooled analysis from the Barrett’s and Esophageal Adenocarcinoma Consortium (BEACON) [J]., 2014, 9(7): e103508.
[5] Song Y M, Li L, Ou Y W,. Identification of genomic alterations in oesophageal squamous cell cancer [J]., 2014, 509(7498): 91-95.
[6] Lin D C, Hao J J, Nagata Y,. Genomic and molecular characterization of esophageal squamous cell carcinoma [J]., 2014, 46(5): 467-473.
[7] Gao Y B, Chen Z L, Li J G,. Genetic landscape of esophageal squamous cell carcinoma [J]., 2014, 46(10): 1097-1102.
[8] McNamara M J, Rybicki L A, Sohal D,. The relationship between pathologic nodal disease and residual tumor viability after induction chemotherapy in patients with locally advanced esophageal adenocarcinoma receiving a tri-modality regimen [J]., 2016, 7(2): 196-205.
[9] Allum W H, Stenning S P, Bancewicz J,. Long-term results of a randomized trial of surgery with or without preoperative chemotherapy in esophageal cancer [J]., 2009, 27(30): 5062-5067.
[10] Skinner H D, Lee J H, Bhutani M S,. A validated miRNA profile predicts response to therapy in esophageal adenocarcinoma [J]., 2014, 120(23): 3635-3641.
[11] Nelson J A, Falk R E. The efficacy of phloridzin and phloretin on tumor cell growth [J]., 1993, 13(6A): 2287-2292.
[12] Chen Y, Liu J, Geng S,. Lipase-catalyzed synthesis mechanism of tri-acetylated phloridzin and its antiproliferative activity against HepG2 cancer cells [J]., 2019, 277: 186-194.
[13] Un H, Ugan R A, Gurbuz M A,. Phloretin and phloridzin guard against cisplatin-induced nephrotoxicity in mice through inhibiting oxidative stress and inflammation [J]., 2021, 266: 118869.
[14] Jia Z X, Xie Y N, Wu H J,. Phlorizin from sweet tea inhibits the progress of esophageal cancer by antagonizing the JAK2/STAT3 signaling pathway [J]., 2021, 46: 137.
[15] Koeppel F, Bobard A, Lefebvre C,. Added value of whole-exome and transcriptome sequencing for clinical molecular screenings of advanced cancer patients with solid tumors [J]., 2018, 24(4): 153-162.
[16] Mantso T, Trafalis D, Botaitis S,. Novel docosahexaenoic acid ester of phloridzin inhibits proliferation and triggers apoptosis in anmodel of skin cancer [J]., 2018, 7(12): 188.
[17] Nair S V, Ziaullah, Rupasinghe H P. Fatty acid esters of phloridzin induce apoptosis of human liver cancer cells through altered gene expression [J]., 2014, 9(9): e107149.
[18] Fernando W, Coyle K, Marcato P,. Phloridzin docosahexaenoate, a novel fatty acid ester of a plant polyphenol, inhibits mammary carcinoma cell metastasis [J]., 2019, 465: 68-81.
[19] Fernando W, Coombs M R P, Hoskin D W,. Docosahexaenoic acid-acylated phloridzin, a novel polyphenol fatty acid ester derivative, is cytotoxic to breast cancer cells [J]., 2016, 37(10): 1004-1013.
[20] Takeuchi T, Adachi Y, Sonobe H,. A ubiquitin ligase, skeletrophin, is a negative regulator of melanoma invasion [J]., 2006, 25(53): 7059-7069.
[21] Sahar T, Nigam A, Anjum S,. Interactome analysis of the differentially expressed proteins in uterine leiomyoma [J]., 2019, 19(10): 1293-1312.
[22] Arnold S. The power of life—Cytochrome c oxidase takes center stage in metabolic control, cell signalling and survival [J]., 2012, 12(1): 46-56.
[23] Hewedi I H, Farid R M, Sidhom K F,. Differential expression of cytochrome C oxidase subunit I along the colorectal adenoma: Carcinoma progression [J]., 2018, 26(9): 689-696.
[24] Mishra N, Timilsina U, Ghimire D,. Downregulation of cytochrome c oxidase subunit 7A1 expression is important in enhancing cell proliferation in adenocarcinoma cells [J]., 2017, 482(4): 713-719.
[25] Gandhirajan R K, Rödder K, Bodnar Y,. Cytochrome C oxidase inhibition and cold plasma-derived oxidants synergize in melanoma cell death induction [J]., 2018, 8(1): 12734.
[26] Sadeghzadeh M, Bornehdeli S, Mohahammadrezakhani H,. Dendritic cell therapy in cancer treatment; the state-of-the-art [J]., 2020, 254: 117580.
[27] Pitt J M, André F, Amigorena S,. Dendritic cell-derived exosomes for cancer therapy [J]., 2016, 126(4): 1224-1232.
[28] Saxena M, Bhardwaj N. Re-emergence of dendritic cell vaccines for cancer treatment [J]., 2018, 4(2): 119-137.
[29] Giovanelli P, Sandoval T A, Cubillos-Ruiz J R. Dendritic cell metabolism and function in tumors [J]., 2019, 40(8): 699-718.
[30] Li W, Song X, Yu H,. Dendritic cell-based cancer immunotherapy for pancreatic cancer [J]., 2018, 19(1): 1-6.
Effect of phlorizin on expression profile of esophageal cancer cell lines
YANG Zhao-huan1, HU Wen-qian2, JIA Zhen-xian2, XIE Yu-ning2, ZHANG Zhi1, LONG Yue-hong3, XING Zhao-bin3, ZHANG Xue-mei2, 3
1. Affiliated Tangshan Gongren Hospital, North China University of Science and Technology, Tangshan 063000, China 2. College of Life Sciences, North China University of Science and Technology, Tangshan 063210, China 3. School of Public Health, North China University of Science and Technology, Tangshan 063210, China
To evaluate the effect of phlorizin on expression profile of esophageal cancer cells and further to reveal the signal pathways and potential functions that phlorizin involved in.KYSE450 esophageal cancer cells were treated with phlorizin. Total RNA was extracted and RNA sequencing library was established to perform transcriptome sequencing. Differentially expressed genes were identified using DESeq2 package. Gene ontology (GO) and Kyoto encyclopedia of genes and genomes (KEGG) pathway analysis of differentially expressed genes were performed. Moreover, hub model was evaluated using MCODE and survival analysis was performed using GEPIA. TIMER was used to online analyze effect of phlorizin on immune cell infiltration in esophageal cancer tissue.Total 4602 differentially expressed genes were identified of which 2407 were up-regulated and 2195 were down-regulated. Pathway enrichment analysis showed that phlorizin had impact on protein processing, insulin resistance, DNA replication and cell cycle signaling pathways. In the hub module, high expression of E3 ubiquitin ligase mind bomb 2 () could reduce the overall survival rate of patients with esophageal cancer; Ring finger protein 19B (), tripartite motif-containing protein 69 (), ubiquitin conjugating enzyme () and homologous to the E6-associated protein carboxyl terminus domain containing 2 () expression levels could affect the purity of esophageal cancer tissue and type of immune cell infiltration.Phlorizin could affect the transcription profile of esophageal cancer cells, of which differentially expressed genes were mainly involved in signal pathways related to cell growth.
phlorizin; esophageal cancer; RNA-Seq; immune infiltration; MIB2; RNF19B; TRIM69; UBC; HECTD2
R285.5
A
0253 - 2670(2021)23 - 7236 - 08
10.7501/j.issn.0253-2670.2021.23.018
2021-06-08
国家自然科学基金资助项目(81272613)
杨照环(1975—),女,硕士,副主任医师,主要研究领域为肿瘤内科的综合治疗。Tel: 13831553045 E-mail: 244107878@qq.com
张雪梅,博士生导师,主要从事肿瘤病因学与肿瘤流行病学研究。E-mail: jyxuemei@gmail.com
张 志,硕士生导师,主要从事肿瘤内科的综合治疗研究。E-mail: zhi1969@163.com
[责任编辑 李亚楠]
