高乌甲素及其水解产物刺乌宁抗心律失常作用的比较研究
2021-12-04王毓杰
陶 培,王毓杰
高乌甲素及其水解产物刺乌宁抗心律失常作用的比较研究
陶 培,王毓杰*
成都中医药大学,四川 成都 611137
比较高乌甲素及其水解产物的心脏毒性及抗心律失常活性,明确C-4位芳香取代基对其活性和毒性的影响。采用碱水解、硅胶柱色谱以及波谱法对高乌甲素水解产物进行分离鉴定;采用心脏毒性实验和乌头碱诱发心律失常模型,比较高乌甲素及其水解产物的毒性和活性。分离并鉴定出高乌甲素水解产物为刺乌宁;股iv 2.40 mg/kg高乌甲素可引起大鼠出现室性早搏(ventricular premature beat,VPB)、室性心动过速(ventricular tachycardia,VT)等心律失常现象,刺乌宁在相同剂量下未出现心律失常现象;在抗心律失常活性研究中,高乌甲素、刺乌宁在各自的剂量范围内,随着剂量的增大,VPB潜伏期延长,VT发生率降低,心律失常完全抑制率逐渐升高,呈剂量相关性,表明两者均有一定的抗心律失常作用,高乌甲素的作用强于刺乌宁。与高乌甲素相比,随着C-4位芳香取代基的水解,水解产物刺乌宁的心脏毒性降低,抗心律失常活性明显减弱,表明C-4位芳香取代基是高乌甲素产生心脏毒性、发挥药效的关键基团。
高乌甲素;刺乌宁;抗心律失常;心脏毒性;C-4位芳香取代基
高乌甲素又名刺乌头碱、拉巴乌头碱,是从乌头属植物高乌头Nakai中分离得到的一种C-18型二萜生物碱[1],具有较强的镇痛作用,且无成瘾性,已被开发为非成瘾性镇痛药,用于多种原因引起的疼痛[2-4]。在俄罗斯等国家,氢溴酸高乌甲素也作为临床一线药物治疗室性早搏、心房颤动、室上性和室性心动过速等心律失常[4-6]。
二萜生物碱具有较强的神经毒性和心脏毒性,如乌头碱可与神经细胞、心肌细胞膜上的电压敏感型Na+通道特异性结合,促进Na+大量内流,细胞膜电位失衡,引起细胞功能紊乱,进而影响机体功能,出现四肢麻木、心律失常等中毒现象[7-8]。因此,乌头类药物需要炮制后使用。在水煮或蒸制过程中,乌头碱的C-8位、C-14位依次通过水解反应生成苯甲酰乌头原碱和乌头原碱,随着酯键的水解,2种水解产物的毒性和活性依次降低[9],表明C-14位的苯甲酰基、C-8位的乙酰基对于乌头碱的毒性和活性具有重要作用。与乌头碱相比,高乌甲素在C-14位没有芳环取代基,但在C-4位连接有1个邻乙酰氨基苯甲酰取代基,上述结构上的差异对高乌甲素毒性和抗心律失常活性的作用尚不清楚。
因此,本研究在碱性条件下水解高乌甲素C-4位的芳香环,采用色谱和波谱法对水解产物进行分离鉴定;采用心脏毒性实验比较高乌甲素与水解产物的毒性差异;采用乌头碱建立心律失常模型,比较高乌甲素与水解产物的抗心律失常活性,明确C-4位芳香取代基对高乌甲素心脏毒性及抗心律失常活性的影响,为乌头类药物的炮制原理、炮制品的质量控制及二萜生物碱类抗心律失常药物的研发提供思路。
1 材料
1.1 动物
SPF级SD大鼠,雌雄兼用,7~8周龄,体质量180~220 g,由成都达硕实验动物有限公司提供,动物许可证号SCXK(川)-2020-030。实验前适应性喂养2 d,自由进食饮水,室温维持在20~25 ℃,昼夜光照及通风环境自然调节,实验前禁食12 h。动物实验经成都中医药大学实验动物伦理委员会批准(伦理备案号2020-15)。
1.2 药品与试剂
高乌甲素(批号LRQ180116-1,质量分数>98%)购自西安绿如泉生物科技有限公司;乌头碱(批号WTZ10013,质量分数99%)购自陕西昊辰生物科技有限公司;刺乌宁(质量分数>95%)为本课题组自制;盐酸普罗帕酮(批号101190-201702,质量分数为99.8%)、盐酸利多卡因(批号100341-201403,质量分数为93.4%)购自中国食品药品检定研究院;乌拉坦(批号2020041701)购自成都市科隆化学品有限公司;0.9%氯化钠溶液(批号L219101908)购自四川科伦药业股份有限公司;色谱用石油醚(沸点60~90 ℃)购自成都市科隆化学品有限公司;显色剂为改良碘化铋钾试剂。
1.3 仪器
BL-420F型多功能生理记录仪(成都泰盟软件有限公司);CPA2250型电子分析天平(德国Sartorius公司);HH-SJ型集热式磁力搅拌器(油浴用,金坛市城东新瑞仪器厂);MicrO-TOF-Q-IImass spectrometer质谱仪、Avance 600 spectrometer核磁共振仪(瑞士Bruker公司);RE-3000B型旋转蒸发仪(上海亚荣生化仪器厂);薄层色谱硅胶G和柱色谱硅胶(200~300目,青岛海洋化工厂)。
2 方法
2.1 高乌甲素C-4位水解产物的制备与分离
取高乌甲素1.61 g,置500 mL圆底烧瓶中,加四氢呋喃130 mL使溶解,继续加入2 mol/L NaOH 190 mL,115 ℃油浴回流6 h,取出,放凉,转移至分液漏斗中,取四氢呋喃层,挥干溶剂,得1 g样品,供柱色谱用。
将上述样品用四氢呋喃溶解,拌样,进行硅胶柱色谱(200~300目,80 g)分离,依次用3.3 L石油醚-丙酮-三乙胺(6∶1∶0.01)、1.4 L石油醚-丙酮-三乙胺(5∶1∶0.01)、1.5 L石油醚-丙酮-三乙胺(3∶1∶0.01)梯度洗脱,得到43个组分,薄层色谱检视,合并组分34~40,重结晶,得到化合物1(450 mg)。
2.2 高乌甲素及水解产物的心脏毒性比较
取SD大鼠20只,随机分为高乌甲素组和化合物1组,每组10只。大鼠ip 20%乌拉坦(1.2 g/kg)麻醉[10],仰位固定,将针形电极插入四肢皮下,使用多功能生理记录仪观察大鼠II导联心电图20 min后,经股iv给药,观察给药后30 min内心电图变化。
通过前期预实验,发现高乌甲素2.40 mg/kg可引起大鼠出现室性早搏(ventricular premature beat,VPB)、室性心动过速(ventricular tachycardia,VT)、室颤(ventricular fibrillation,VF)等心律失常现象。通过观察高乌甲素和化合物1等剂量给药后心电图的变化,可直观反映出C-4位芳香取代基对高乌甲素心脏毒性的影响[11-12]。
2.3 高乌甲素及水解产物的抗心律失常活性比较
取SD大鼠149只,随机分为11组,见表1。取4 mL 1%盐酸乙醇,0.9%氯化钠溶液稀释,用5% NaOH调pH至7,加0.9%氯化钠溶液定容至100 mL,作为空白溶剂;各受试药物均采用空白溶剂的配制方法进行配制。

表1 动物分组
大鼠ip 20%乌拉坦(1.2 g/kg)麻醉,仰位固定,将针形电极插入四肢皮下,记录大鼠正常II导联心电图20 min后,暴露股静脉,从股静脉分别快速注射相应受试药物,对照组和模型组给予空白溶剂。除对照组外,10 min后再从股静脉快速注射乌头碱(0.03 mg/kg)建立心律失常模型[15-19],记录30 min内各组大鼠心律失常的发生率、第1次出现VPB的时间以及是否出现心动过速[20-21]。
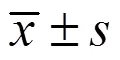
3 结果
3.1 化合物1的结构鉴定
化合物1:白色粉末,C23H37NO6。ESI-MS: 424.27 [M+H]+;1H-NMR (600 MHz, CDCl3):1.06 (3H, t,= 7.32 Hz,-CH2-C3), 3.26 (3H, s, OCH3), 3.28 (3H, s, OCH3), 3.38 (3H, s, OCH3), 3.13 (1H, m, H-1), 3.39 (1H, d,= 4.8 Hz, H-14β), 2.91 (1H, s, H-17);13C-NMR (150 MHz, CDCl3): 85.1 (d, C-1), 26.5 (t, C-2), 37.3 (t, C-3), 71.0 (s, C-4), 50.8 (d, C-5), 26.9 (t, C-6), 47.7 (d, C-7), 75.7 (s, C-8), 78.6 (s, C-9), 49.7 (d, C-10), 50.9 (s, C-11), 23.6 (t, C-12), 36.3 (s, C-13), 90.2 (d, C-14), 44.8 (t, C-15), 83.0 (d, C-16), 61.7 (d, C-17), 57.9 (t, C-19), 49.0 (t,-H2-CH3), 13.5 (q,-CH2-H3), 56.1 (q, 1-OCH3), 57.9 (q, 14-OCH3), 56.5 (q, 16-OCH3)。以上数据与文献报道一致[22],故鉴定化合物1为刺乌宁(图1)。
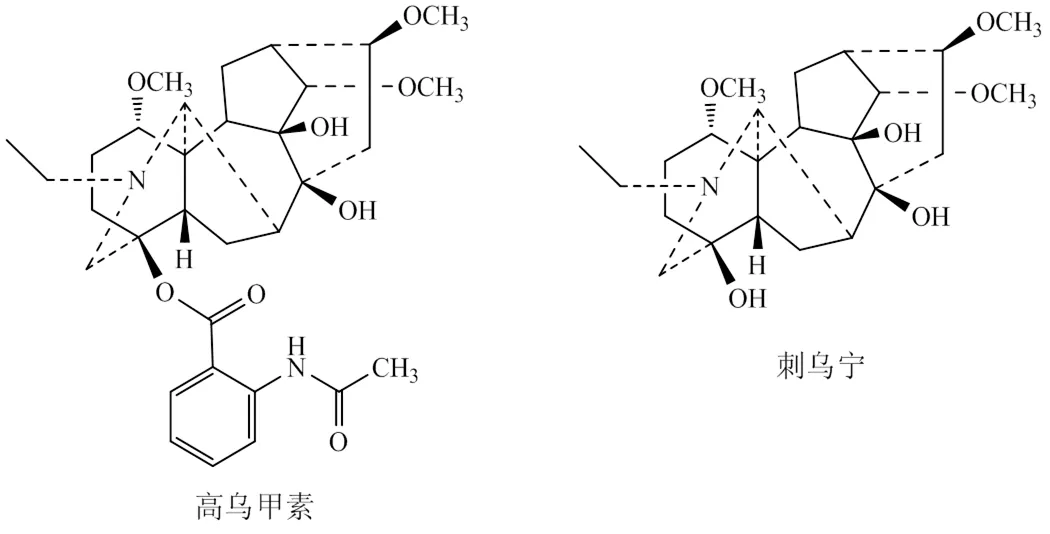
图1 高乌甲素及刺乌宁的化学结构
3.2 高乌甲素及水解产物的心脏毒性比较
2.40 mg/kg高乌甲素可引起正常大鼠出现VPB、VT和VF等心律失常现象,高乌甲素致心律失常潜伏期为(131.2±56.1)s。在观察期间内,高乌甲素组大鼠虽然未出现死亡的情况,但是均发生了VT、VF等致死性室性心律失常。而相同剂量下高乌甲素的水解产物刺乌宁组大鼠均未出现心律失常现象。与高乌甲素相比,刺乌宁的心脏毒性明显降低,表明C-4位邻乙酰氨基苯甲酰取代基是导致高乌甲素产生心脏毒性的重要基团,醇胺型比单酯型二萜生物碱的心脏毒性更小,安全性更高。
3.3 高乌甲素及水解产物对乌头碱诱发大鼠VPB潜伏期的影响
乌头碱致心律失常模型大鼠的心电图表现为:首先出现VPB,逐渐发展为二联律或者三联律,再进一步发展为阵发性和连续性室性心动过速等[13]。其中,VPB是心律失常模型大鼠的初期表现,心电图特征为:QRS波群提前出现,形态宽大畸形,T波方向与QRS主波方向相反,并且P波消失[23]。VPB潜伏期是指注射完乌头碱后到第1次出现VPB的时间,VPB潜伏期越长,表明受试药物的抗心律失常作用越好。
对照组大鼠iv空白溶剂后,在整个观察期间内,心电图未发生变化。模型组大鼠经股iv乌头碱后出现典型的VPB、VT,甚至有一部分大鼠出现VF,并且持续30 min以上,表明心律失常模型建立成功。如图2所示,模型组大鼠VPB潜伏期为(116.5±36.4)s,利多卡因组大鼠VPB潜伏期为(280.3±128.7)s,普罗帕酮组大鼠VPB潜伏期为(193.3±39.9)s;与模型组相比,2个阳性对照药物组均有显著差异(<0.05)。此外,利多卡因可以保护42.9%的大鼠不出现心律失常。
高乌甲素(0.01、0.05 mg/kg)组大鼠VPB潜伏期分别为(190.8±69.1)、(201.4±70.1)s,与模型组相比,无显著差异。高乌甲素(0.15、0.20 mg/kg)组大鼠VPB潜伏期分别为(354.4±147.2)、(606.4±313.7)s,与模型组相比,均有显著性差异(<0.05);与普罗帕酮组相比,高乌甲素(0.20 mg/kg)组大鼠VPB潜伏期有显著性差异(<0.05)。以上结果表明,在0.20 mg/kg剂量下,高乌甲素的抗心律失常作用明显优于阳性对照药物普罗帕酮。

与模型组比较:*P<0.05;与普罗帕酮比较:#P<0.05
刺乌宁(10、20 mg/kg)组大鼠VPB潜伏期分别为(164.5±59.7)、(234.4±106.9)s,与模型组相比,无显著性差异。刺乌宁(40 mg/kg)组大鼠VPB潜伏期为(427.9±203.4)s,与模型组相比,有显著性差异(<0.05)。
通过对比高乌甲素和刺乌宁的剂量范围可以发现,高乌甲素在0.15 mg/kg剂量下,可以有效延长VPB潜伏期;而刺乌宁在40 mg/kg剂量下才能显著延长VPB潜伏期。刺乌宁发挥抗心律失常作用的剂量明显高于高乌甲素,提示高乌甲素水解脱去C-4位芳香取代基后,抗心律失常作用降低。
3.4 高乌甲素及刺乌宁对乌头碱诱发大鼠VT发生率的影响
VT是VPB进一步发展的结果,VT的心电图特征为:连续出现3次或3次以上的VPB,QRS波群宽大畸形,无恒定的P波[24]。VT发生率可以评价受试药物是否能够阻止VPB的进一步发展,VT发生率越低,抗心律失常作用越好。
按照2检验的数据要求,需要将VT发生率相近的剂量组进行合并后,再分析各受试药物不同剂量组对大鼠VT发生率的影响。因此,将高乌甲素(0.05、0.15 mg/kg)组合并为0.05~0.15 mg/kg剂量组;将刺乌宁(10、20 mg/kg)组合并为10~20 mg/kg剂量组。
高乌甲素最终分组为:0.01 mg/kg、0.05~0.15 mg/kg和0.20 mg/kg组。如表2所示,3个剂量组的VT发生率有差异(2=11.481、=0.003)。如图3-A所示,与高乌甲素(0.01 mg/kg)组相比,高乌甲素(0.05~0.15、0.20 mg/kg)组大鼠VT发生率均显著降低(2=6.296、=0.012;2=7.736、=0.005),分别为45.0%和30.0%。
刺乌宁最终分组为:10~20 mg/kg和40 mg/kg组。如表2所示,模型组和刺乌宁2个剂量组之间的VT发生率有差异(2=10.974、=0.004)。如图3-B所示,与模型组相比,刺乌宁(40 mg/kg)组大鼠VT发生率显著降低(2=5.952、=0.015)。
上述结果表明,高乌甲素和刺乌宁在各自的剂量范围内,能够降低VT发生率,阻止VPB的进一步发展。
3.5 高乌甲素及刺乌宁对乌头碱诱发大鼠心律失常完全抑制率的影响
心律失常发生率[18]是指大鼠预先iv受试药物,再用乌头碱建立心律失常模型后,30 min内出现心律失常的大鼠比例(出现VPB、VT或VF中的任何一种心电图变化,均算作出现心律失常)。心律失常完全抑制率即30 min内未出现心律失常的比例,可以评价受试药物是否能够完全抑制乌头碱引起的心律失常,是最直观反映受试药物抗心律失常作用强弱的指标,心律失常完全抑制率越高,药效越好。

表2 高乌甲素及刺乌宁VT发生率χ2分析
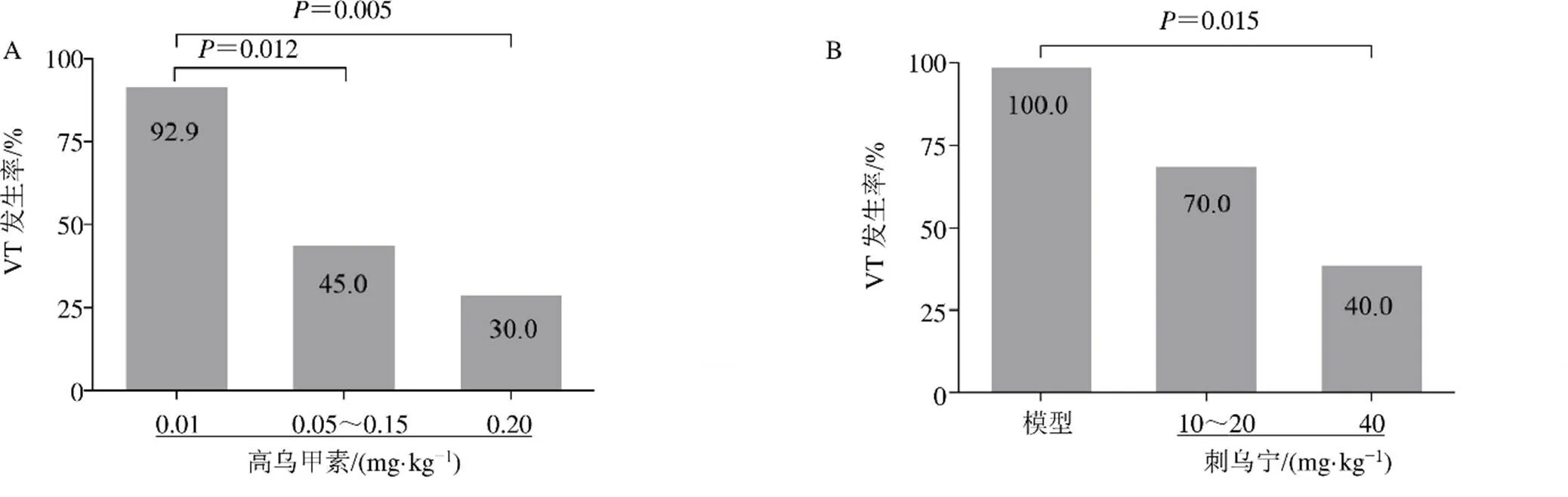
图3 高乌甲素(A) 及刺乌宁(B) 对乌头碱诱发大鼠VT发生率的影响
根据2检验的数据要求,将高乌甲素的0.05 mg/kg和0.15 mg/kg组、刺乌宁的10 mg/kg和20 mg/kg剂量组合并。
高乌甲素(0.01、0.05~0.15、0.20 mg/kg)组及利多卡因组的心律失常完全抑制率经2检验,结果见表3,4个组的心律失常完全抑制率有差异(2=10.437、=0.015)。如图4-A所示,与高乌甲素(0.01、0.05~0.15 mg/kg)组相比,高乌甲素(0.20 mg/kg)组心律失常完全抑制率显著升高(2=7.038、=0.008;2=6.049、=0.014),表明随着剂量增大,高乌甲素的抗心律失常作用增强;在0.20 mg/kg剂量下,高乌甲素的心律失常完全抑制率为54.5%,高于利多卡因的42.9%,显示出更强的抗心律失常作用。
如表3所示,刺乌宁(10~20、40 mg/kg)组及利多卡因组的心律失常完全抑制率也有显著差异(2=6.567、=0.038)。如图4-B所示,与刺乌宁(10~20 mg/kg)组相比,利多卡因的心律失常完全抑制率显著升高(2=6.435、=0.011)。

表3 高乌甲素和刺乌宁心律失常完全抑制率χ2分析
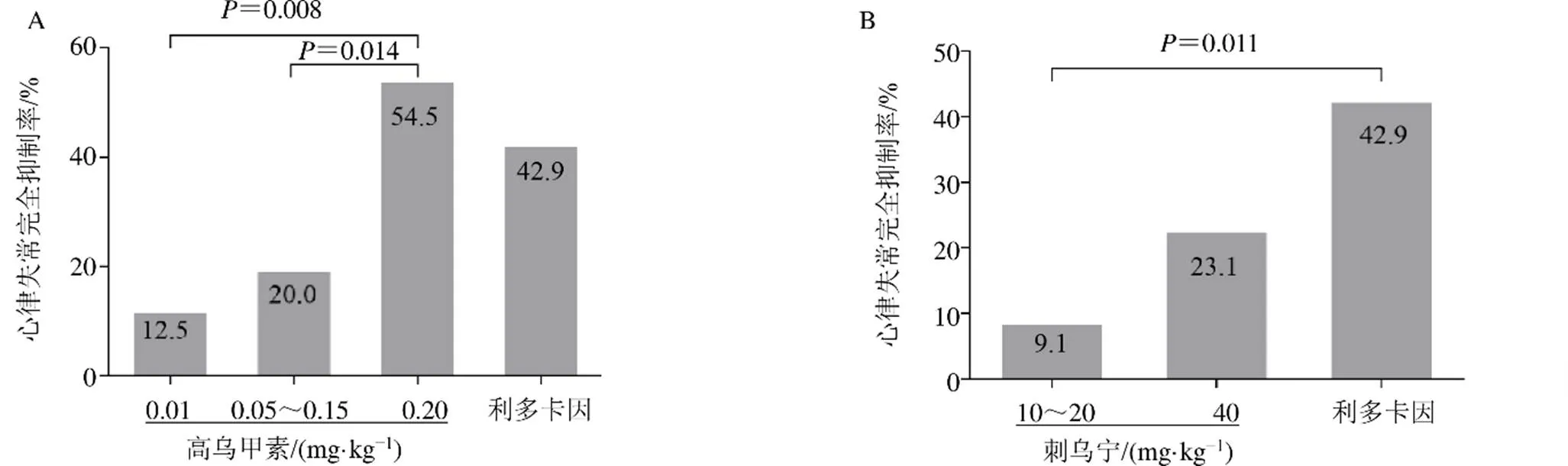
图4 高乌甲素(A) 及刺乌宁(B) 对乌头碱诱发大鼠心律失常完全抑制率的影响
通过以上结果可以看出,高乌甲素和刺乌宁均能够延长VPB潜伏期、降低VT发生率、提高心律失常完全抑制率,表现出一定的抗心律失常活性,且呈剂量相关性。若以各自的最优剂量表示受试药物的抗心律失常活性强弱,则高乌甲素在0.20 mg/kg剂量下,VPB潜伏期为(606.4±313.7)s,VT发生率为30%,可以保护54.5%的大鼠不出现心律失常;刺乌宁在40 mg/kg剂量下,VPB潜伏期为(427.9±203.4)s,VT发生率为40%,仅可以保护23.1%的大鼠不出现心律失常。由此可见,刺乌宁的抗心律失常药效弱于高乌甲素。
4 讨论
本研究采用碱水解法、硅胶柱色谱以及波谱法分离鉴定出高乌甲素的水解产物刺乌宁。为了明确C-4位芳香取代基对高乌甲素心脏毒性及抗心律失常活性强弱的影响,进一步采用了心脏毒性实验及抗心律失常整体动物实验对比两者的毒性及活性。
心脏毒性实验结果表明,2.40 mg/kg高乌甲素可引起大鼠出现室性早搏、室性心动过速和室颤;而相同剂量的刺乌宁组大鼠未出现任何心律失常现象。高乌甲素是单酯型二萜生物碱,水解脱去C-4位邻乙酰氨基苯甲酰基后变为醇胺型二萜生物碱,心脏毒性随着结构的变化明显降低。
乌头碱诱发心律失常的机制为促进Na+通道开放,加速Na+内流,促使细胞膜去极化,加速起搏点自律性,缩短不应期[8,13];而高乌甲素对心肌Na+通道的作用与乌头碱相反,能够可逆性地阻断Na+通道的开放,从而产生抗心律失常的作用[5-6]。因此,本研究选择了乌头碱致心律失常模型研究高乌甲素及刺乌宁的抗心律失常活性。由于高乌甲素的抗心律失常作用机制与Na+通道阻滞有关,其电生理特征接近于Ic类抗心律失常药物[5],因此,选择了2种I类钠通道阻滞药(Ib类利多卡因和Ic类普罗帕酮)作为阳性对照药物。
抗心律失常活性实验结果表明,高乌甲素和刺乌宁均具有一定的抗心律失常作用。通过VPB潜伏期数据可以看出,高乌甲素的起效剂量(0.15 mg/kg)约是刺乌宁(40 mg/kg)的1/250。并且,高乌甲素在0.05~0.15 mg/kg剂量下,心律失常完全抑制率即可达到20.0%;而刺乌宁在40 mg/kg剂量下,心律失常完全抑制率为23.1%。也就是说,如果需要发挥同等的抗心律失常药效,刺乌宁的所需剂量为高乌甲素的上百倍,表明C-4位芳香取代基是高乌甲素发挥抗心律失常作用的关键基团。
王培德等[18,25]发现sc小剂量(0.25~1.00 mg/kg)高乌甲素能够延长VPB潜伏期,甚至可以保护大多数动物不出现心律失常;当静脉恒速注射高乌甲素的累积量达(2.54±0.06)mg/kg时,会导致大鼠心率减慢,P-R间期延长;累积量继续增至4.12~8.19 mg/kg时,可引起大鼠出现VPB、VT、VF等心律失常现象,甚至死亡。本研究也发现,iv低剂量高乌甲素可出现较强的抗心律失常作用;当一次性快速注射2.40 mg/kg高乌甲素时,可引起VPB、VT、VF等心律失常现象,而同等剂量下,缺少C-4位取代基的刺乌宁则未出现上述现象。Dzhakhangirov等[26]发现单芳香胺型二萜生物碱的抗心律失常作用优于醇胺型,醇胺型二萜生物碱C-4位芳香化后,抗心律失常作用明显增强,与本研究结果一致,即C-4位取代基是高乌甲素产生心脏毒性和发挥药效的关键基团。此外,本研究在抗心律失常实验中发现,随着给药剂量的增大,大鼠VPB潜伏期呈逐渐上升的趋势,并且剂量越大,VPB潜伏期数据也更加分散,进而导致SD值较大。基于此,查阅一些以VPB潜伏期为指标的抗心律失常活性实验,均发现了VPB潜伏期数据的SD值偏大的情况[19,25,27-28]。
本研究通过类比高乌甲素和乌头碱的化学结构特点,推测C-4位邻乙酰氨基苯甲酰基可能与高乌甲素的抗心律失常活性有密切关系,并采用多种方法分离制备出高乌甲素的水解产物刺乌宁。通过心脏毒性和抗心律失常活性实验,证实了C-4位芳香取代基是高乌甲素产生心脏毒性和发挥抗心律失常作用的关键基团,上述结果能够为阐明含高乌甲素的乌头类药材的炮制原理、炮制品质控成分及二萜生物碱类抗心律失常药物的研发提供思路。
利益冲突 所有作者均声明不存在利益冲突
[1] Pang L, Liu C Y, Gong G H,. Synthesis,andbiological evaluation of novel lappaconitine derivatives as potential anti-inflammatory agents [J]., 2020, 10(4): 628-645.
[2] 中华人民共和国卫生部药品标准 (第5册) [S]. 二部. 1996: 51-53.
[3] 张琴, 徐斌, 贾琦, 等. C18型二萜生物碱化学成分及药理活性研究进展 [J]. 中成药, 2016, 38(5): 1109-1114.
[4] 王锋鹏. 从草乌化学研究开发的新药思考中药现代化的方法 [J]. 化学进展, 2009, 21(1): 63-65.
[5] Vakhitova Y V, Farafontova E I, Khisamutdinova R Y,. A study of the mechanism of the antiarrhythmic action of allapinin [J]., 2013, 39(1): 92-101.
[6] Yunusov M S. Antiarrhythmic agents based on diterpenoid alkaloids [J]., 2011, 60(4): 633-638.
[7] Ameri A. The effects ofalkaloids on the central nervous system [J]., 1998, 56(2): 211-235.
[8] Chan T Y K. Aconite poisoning [J]., 2009, 47(4): 279-285.
[9] 龚千锋. 中药炮制学 [M]. 第3版. 北京: 中国中医药出版社, 2012: 355-357.
[10] Bealer S L, Metcalf C S, Little J G. Methods for ECG evaluation of indicators of cardiac risk, and susceptibility to aconitine-induced arrhythmias in rats following status epilepticus [J]., 2011(50): 2726.
[11] 王艳, 陶培, 王毓杰, 等. 油浴模拟砂炒过程中印乌碱的结构转化途径及转化产物毒性研究 [J]. 中草药, 2020, 51(5): 1205-1213.
[12] 葛帅, 汪溪洁, 李华, 等. 中药心脏毒性评价方法的研究进展 [A] // 第六届全国药物毒理学年会论文集[C]. 重庆: 中国毒理学会, 2016: 564-565.
[13] Hong B H, He J L, Le Q Q,. Combination formulation of tetrodotoxin and lidocaine as a potential therapy for severe arrhythmias [J]., 2019, 17(12): 685.
[14] 李红, 牛欣, 李国彰,等. 调脉饮注射液抗心律失常的实验研究 [J]. 中国中药杂志, 2006, 31(9): 759-762.
[15] 徐叔云, 卞如濂, 陈修. 药理学试验方法 [M]. 第2版. 北京: 人民卫生出版社, 2002: 1173-1174.
[16] Winslow E. Evaluation of antagonism of aconitine- induced dysrhythmias in mice as a method of detecting and assessing antidysrhythmic activity [J]., 1980, 71(2): 615-622.
[17] 张红雨, 徐长庆, 李宏霞, 等. 白藜芦醇抗心律失常和抗心肌缺血作用研究 [J]. 中国药理学通报, 2006, 22(3): 383-384.
[18] Bartosová L, Novák F, Frydrych M,. Effect of a new ultrashort betalytic agent on aconitine-induced arrhythmia [J]., 2005, 149(2): 339-343.
[19] Bartosova L, Novak F, Bebarova M,. Antiarrhythmic effect of newly synthesized compound 44Bu on model of aconitine-induced arrhythmia: Compared to lidocaine [J]., 2007, 575(1/2/3): 127-133.
[20] 王培德, 张慧灵, 杨玉梅, 等. 两种二萜类生物碱对乌头碱诱发大鼠心律失常的作用比较 [J]. 包头医学院学报, 1997, 13(2): 3.
[21] Qiu M, Dong Y H, Han F,. Influence of total flavonoids derived fromfolium on aconitine-induced antiarrhythmic action and hemodynamics in Wistar rats [J]., 2016, 79(19): 878-883.
[22] Pelletier S W, Mody N V, Sawhney R S.13C nuclear magnetic resonance spectra of some C19-diterpenoid alkaloids and their derivatives [J]., 1979, 57(13): 1652-1655.
[23] El Hajjaji I, Becker G, Kus T,. Novel criterion for the differential diagnosis of wide QRS complexes and wide complex tachycardia using the initial activation of QRS on leads V1 and V2: Differential diagnosis of wide QRS based on V1-V2 [J]., 2018, 51(4): 700-706.
[24] Brady W J, Mattu A, Tabas J,. The differential diagnosis of wide QRS complex tachycardia [J]., 2017, 35(10): 1525-1529.
[25] 王培德, 马学民, 张慧灵, 等. 刺乌头碱对麻醉大鼠心电图的影响及其抗实验性心律失常作用 [J]. 中国药理学通报, 1997, 13(3): 3.
[26] Dzhakhangirov F N, Sultankhodzhaev M N, Tashkhodzhaev B,. Diterpenoid alkaloids as a new class of antiarrhythmic agents. Structure-activity relationship [J]., 1997, 33(2): 190- 202.
[27] 巫志峰, 袁小红. 莲子心微囊抗心律失常作用研究 [J]. 中国药房, 2006, 17(23): 1770-1771.
[28] 林静, 李萍, 阎维维, 等. 牛磺酸镁抗心律失常的实验研究 [J]. 天津医药, 1997, 25(10): 614-616.
Comparative study on antiarrhythmic effect of lappaconitine and its hydrolysis product lappaconine
TAO Pei, WANG Yu-jie
Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
To compare the cardiotoxicity and antiarrhythmic activity of lappaconitine and its hydrolysate, and clarify the effect of aromatic substituent at C-4 position on activity and toxicity.The hydrolysis product of lappaconitine was separated and identified by alkaline hydrolysis, silica gel column chromatography and spectroscopic method. Furthermore, cardiotoxicity assay and aconitine-induced arrhythmia model were used to compare the toxicity and activity of lappaconitine and its hydrolysate.Lappaconine, the hydrolysate of lappaconitine, was isolated and identified. Intravenous injection of 2.40 mg/kg lappaconitine induced ventricular premature beat (VPB) and ventricular tachycardia (VT) in normal rats, but no arrhythmias were observed when administration of the same dose of lappaconine. In the study of antiarrhythmic activity, in the respective dose range of lappaconitine and lappaconine, they could dose-dependently delay the onset time of VPB, reduce the incidence of VT, combined with the increasing arrhythmia inhibition rate and exhibiting antiarrhythmic activities. Meanwhile, lappaconitine had a better antiarrhythmic effect than lappaconine.Compared with lappaconitine, with the hydrolysis of aromatic substituent group at C-4 position, the cardiotoxicity of hydrolysate lappaconine is reduced, and antiarrhythmic activity is obviously diminished, which demonstrates that the aromatic substituent at C-4 position is a key group for cardiotoxicity and antiarrhythmic effect.
lappaconitine; lappaconine; antiarrhythmic; cardiotoxicity; aromatic substituent at C-4 position
R285.5
A
0253 - 2670(2021)23 - 7214 - 07
10.7501/j.issn.0253-2670.2021.23.015
2021-06-01
国家自然科学基金资助项目(81403104);四川省科技厅省级科技计划项目(2020YJ0131);成都中医药大学“杏林学者”学科人才科研提升计划(QNXZ2018042)
陶 培(1995—),女,硕士研究生,研究方向为中药新制剂、新剂型、新技术。Tel: 18223365150 E-mail: 1134119207@qq.com
王毓杰(1980—),男,副研究员,硕士生导师,研究方向为中药及民族药炮制原理。Tel: 18980923679 E-mail: superwangyj@126.com
[责任编辑 李亚楠]
