一株苍山地区产尿酸氧化酶菌株的筛选、鉴定及其酶学性质研究
2021-12-04刘红艳尹以瑞杨力权杨润芬
刘红艳,尹以瑞,杨力权,杨润芬,桑 鹏
(大理大学农学与生物科学学院,云南 大理 671003)
尿酸氧化酶(urate oxidase,Uox)是一类主要存在于大多数脊椎动物的肝脏、肾脏中,参与嘌呤代谢的氧化还原酶[1-2].尿酸由生物体嘌呤代谢产生,以尿酸盐为其主要存在形式,溶解度低(0.5 mmol/L,37℃)[3],在组织、关节等处易形成结晶[4].尿酸氧化酶可与氧分子结合,介导尿酸降解的酶促反应[5],将尿酸氧化为5-羟基异尿酸(5-HIU),5-HIU不稳定,转化为尿囊素,尿囊素的溶解度是尿酸的5~10倍,溶于尿液经肾脏排出[6-7].
1905年,Schittenhelm在牛肾中首次发现了尿酸氧化酶[8],之后人们研究了源于猪、斑马鱼、产朊假丝酵母等许多物种的尿酸氧化酶,发现尿酸氧化酶在医学诊断、疾病治疗等方面具有重要作用[9].人以及部分高等灵长类动物(如猿类)的体内没有具有活性的尿酸氧化酶或不含完整的尿酸氧化酶基因[10-12],尿酸在人体积累可引发多种尿酸代谢疾病.目前,尿酸氧化酶药物的专利和技术大多被其他国家所掌握,国内对尿酸氧化酶的研究较少,且临床所用的重组尿酸氧化酶药物普遍具有半衰期短、免疫原性高、价格高等缺陷,并且在人体内环境条件下活性丧失严重,比活性一般小于60%[10-13].因此,广泛研究不同生物来源尿酸氧化酶,寻找新的高产尿酸氧化酶菌株对研发新型尿酸氧化酶药物意义重大.
本研究以云南大理苍山地区土样为材料,筛选出高产尿酸氧化酶菌株,对其16S rRNA基因序列及其酶学性质进行探究,旨在为医药领域新备选产尿酸氧化酶菌株的开发应用提供资源,为进一步开发利用该菌株提供基础,也为进一步获得产尿酸氧化酶基因的研究奠定基础.
1 材料与方法
1.1 实验材料
1.1.1 土样大理苍山地区(海拔约2 214 m,东经100.1°,北纬25.6°),采集深度5~10 cm处土样.
1.1.2 培养基及试剂尿酸基础培养基(g/L):MgSO4∙7H2O 0.5,NaCl 0.1,K2HPO4∙3H2O 0.5,KH2PO40.5,蛋白胨1,酵母提取物1,尿酸2,pH=7.0~8.0;固体菌株分离筛选培养基添加2%的琼脂.
产尿酸氧化酶发酵培养基(g/L):蛋白胨10,蔗糖20,NaCl 0.5,MgSO4∙7H2O 1,KH2PO41,FeSO40.01,尿酸1.5,pH =7.0.
试剂:PBS( pH=7.6),0.6 mmol/L硼酸-尿酸储备液( pH=8.5)。为保证实验精度,避免加强酸强碱对酶的影响,试验中所用到的pH缓冲液均没有使用酸碱pH试剂调pH,严格按照缓冲液配方配制缓冲液,经pH计检测准确后使用。磷酸氢二钠-柠檬酸缓冲液配制范围为pH=3.0~8.0,氢氧化钠-甘氨酸氢氧化钠缓冲液配制范围为pH=8.0~10.0。
1.1.3 实验仪器设备艾柯超纯水生成仪、电子分析天平、高压蒸汽灭菌锅(上海博迅医疗生物仪器股份有限公司)、超净工作台、Haier冰箱、紫外可见光分光光度计(上海菁华仪器公司)、高速冷冻离心机(上海安亭科学仪器公司)、SPX-250B-D型恒温振荡培养箱(上海一恒科学仪器有限公司)、Eppendorf PCR仪、BIO-RAD电泳仪(北京六一生物科技有限公司).
1.2 方法
1.2.1 菌株富集取苍山土样10 g于250 mL的无菌蒸馏水中,120 r/min振荡12 h. 在无菌条件下,用移液枪吸取5 mL悬液于50 mL的尿酸基础培养基中,置于37℃,转速为180 r/min的恒温震荡培养箱中震荡培养3~5 d,再静置培养30 d.
1.2.2 菌株初筛将富集好的菌液摇匀后稀释10-1、10-2、10-3、10-4和10-5,用移液枪分别吸取稀释的菌液150μL接种在分离筛选培养基平板上,涂布均匀,于37℃,倒置培养24~48 h.观察菌落生长情况,筛选单菌落.
1.2.3 菌株复筛将初筛得到的菌株单菌落再接种于分离筛选培养基平板上,采用四区划线分离法,于37℃倒置培养2 d进行复筛,获得纯培养.将复筛获得纯培养单菌落接种于200 mL液体发酵培养基中,37℃,180 r/min恒温震荡培养箱中震荡培养,每10 h取菌液做后续测试.
1.2.4 菌株生长、尿酸降解量及胞内外粗酶活检测产酶发酵过程中每10 h取样检测菌体生长和尿酸降解量.菌体生长通过检测发酵液OD600吸光值确定,尿酸降解量通过检测发酵液上清OD290吸收值确定.菌株产尿酸氧化酶活性通过以发酵液或胞内裂解液作为粗酶液,以尿酸为底物,检测反应前(OD对照)和反应后(OD测试)290 nm下吸光值,以单位时间的尿酸减少量来确定酶活.将1 min 内催化1μmol尿酸生成尿囊素所需要的酶量定义为尿酸氧化酶活力单位.具体公式如下:
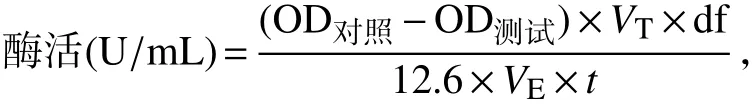
式中,VT为反应液总体积(mL),df为稀释倍数,12.6为在290 nm波长下的微摩尔消光系数,VE为加入的酶液体积(mL),t为反应时间(min).
1.2.5 产酶菌株16S rRNA基因测序及鉴定根据北京天根生化科技有限公司提供的试剂盒以及说明书进行DNA的提取.使用通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′扩增细菌16S rDNA[14-15].参考文献[16-17],进行PCR扩增,扩增条件为:预变性94℃,4 min,变性94℃,30 s,退火55℃,35 s,延伸72℃,90 s,32个循环后,最后延伸72℃,10 min.PCR产物经1.0%琼脂糖凝胶电泳鉴定,120 V,20 min,紫外灯下观察.琼脂糖凝胶回收根据北京天根生化科技有限公司提供的试剂盒以及说明书进行PCR产物回收.将克隆子送昆明擎科生物科技有限责任公司测序,将获得的序列提交GenBank (http://www.ncbi.nlm.nih.gov/genbank),根据BLAST数据库中细菌16S rRNA基因序列进行相似性比较分析,利用MEGA 7.1软件进行系统进化分析.
1.2.6 酶学性质收集最佳发酵时长条件下培养得到的菌体,经超声波细胞破碎(冰浴,30 mL pH 7.6 PBS,30 min)得到胞内粗酶,用于后续实验.
(1)pH对尿酸氧化酶活性的影响在最适酶活温度下,配制不同pH值的缓冲液,磷酸氢二钠-柠檬酸缓冲液(pH=3.0~8.0),甘氢酸-氢氧化钠缓冲液(pH=8.0~10.0),检测不同的pH值(pH=3.0~10.0)对尿酸氧化酶酶活性的影响,以pH值增加0.6为1个梯度.每组实验设置3个平行.
(2)温度对尿酸氧化酶活性的影响将酶液分别在25~60℃条件下检测尿酸氧化酶活性,每5℃为1个梯度.每组实验设置3个平行.
(3)pH对尿酸氧化酶稳定性的影响将酶液置于不同pH值的缓冲液中于4℃孵育12 h和24 h,以不做处理条件下所检测到的活性为对照组,其余pH值的缓冲液处理后测得的酶活与其相比,并计算相对酶活,用相对酶活绘制出酶的pH稳定性曲线.每组实验设置3个平行.
(4)温度对尿酸氧化酶稳定性的影响将酶液分别置于不同的温度(35、40、45℃)下保温,在保温20、40、60、80、100、120、140、160、180、200 min时测定酶活.以保温0 min条件下所测得的酶活为对照组,其余温度下所测得的酶活与其相比,并计算相对酶活,用相对酶活绘制出酶的热稳定性曲线.每组实验设置3个平行.
1.2.7 尿酸氧化酶产酶条件优化产尿酸氧化酶发酵培养基的组分为7个影响因素而作为研究对象,以尿酸氧化酶酶活为响应值,进行试验次数N=15的Plackett-Burman(PB)设计[18-19],PB试验设计的因素与水平见表1.

表1 Plackett−Burman试验因素及水平设计Tab.1 Factors and levels of Plackett-Burman experiments(g/L)
2 结果与分析
2.1 产尿酸氧化酶菌株的筛选和鉴定通过分离筛选获得具有尿酸降解能力的1株菌株,编号为DLCS-31,经发酵初步酶活测试,酶活力为0.007 U/mL.经16S rRNA基因测序,DLCS-31的序列长度为1 382 bp,将其16S rRNA基因序列(GenBank登录号为NO.MW090726)与数据库中的序列进行同源性比对,发现其与克雷伯菌属的16S rRNA基因序列自然聚类,与Klebsiellasp.2392JX174269.1相似性超过99%,基于16S rRNA序列同源性构建菌株DLCS-31的系统进化树见图1,从图中可以看出DLCS-31与Klebsiellasp.菌株聚在一支,表明DLCS-31属于Klebsiella属的菌株.

图1 基于16S r RNA序列同源性构建菌株DLCS−31的系统进化树Fig.1 Phylogenetic tree of strain DLCS-31 constructed based on the homology of 16S rRNA sequence
2.2 菌株生长和尿酸降解曲线实验结果(图2)显示,DLCS-31经发酵培养0~40 h生长量呈增长趋势,尿酸残余量在不断降低,说明菌体在不断增加,且降解着体系中的尿酸.40~50 h,生物量趋于平缓,无增大趋势,尿酸残余量也没有再降低,说明菌体没有再增加,酶不再降解尿酸.尿酸残余量(以OD290表示)逐渐降低,在30~40 h期间,尿酸降解速度趋于平缓.

图2 DLCS−31菌株生长和尿酸降解曲线Fig.2 Growth and uric acid degradation curves of DLCS-31 strain
2.3 胞内胞外粗酶活测定按照实验方法,检测各发酵时长对应胞内胞外粗酶活(图3).发酵20 h的胞内酶酶活最高,因此选择发酵20 h的胞内粗酶做后续研究.
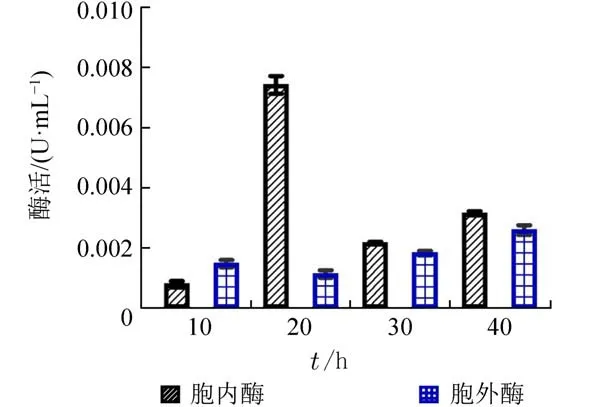
图3 DLCS−31胞内胞外粗酶活Fig.3 Extracellular and intracellular crude enzyme activity of DLCS-31
2.4 尿酸氧化酶酶学性质分析
2.4.1 温度和pH对尿酸氧化酶活的影响按照实验方法,在不同pH和温度条件下测定酶的活性,以相对酶活为纵坐标,pH和温度为横坐标做pH-酶活关系曲线,温度-酶活关系曲线(图4).
结果显示(图4),反应体系的pH从3.0升高到6.6过程中,尿酸氧化酶的相对酶活从0升高到100%,之后随pH从6.6升高到10.0,酶活呈快速下降趋势,该酶的最适pH应在6.6左右.该酶的最适反应温度为40℃,从25℃到40℃该酶活总体呈现增大趋势,过了40℃酶活快速减小,55℃检测时已失活(图4).

图4 p H(a)和温度(b)对菌株DLCS−31活性的影响Fig.4 Effects of pH (a)and temperature (b)on the activity of strain DLCS-31
2.4.2 pH和温度对尿酸氧化酶稳定性的影响以不经处理条件下所测得的酶活为对照组,其余各pH和温度条件下处理所测得的酶活与其相比并计算相对酶活,用相对酶活绘制出酶的pH和温度稳定性曲线(图5).
结果显示(图5),与最适pH测定时一致,pH=4.0以前,DLCS-31尿酸氧化酶活性较低,pH=10.0后,酶活逐渐消失;处理12 h的相对活性明显高于处理24 h的,即随处理时间增长,对应酶活逐渐降低,但处理24 h整体趋势仍保持pH对酶活性影响的一般趋势,且处理24 h,最适pH附近酶活没有损失,其余同一pH下活性损失不过半,说明该酶pH稳定性较好.在35、40℃和45℃,该酶能够在长时间内维持超过60%的酶活,表明该酶热稳定性较好.随保温时长增加,相对酶活总体趋势呈现降低趋势,且温度越高,失活越早,温度耐受性质符合一般酶的规律.

图5 p H(a)和温度(b)对菌株DLCS−31稳定性的影响Fig.5 Effects of pH (a)and temperature(b)on the stability of strain DLCS-31
2.5 尿酸氧化酶产酶条件优化以产尿酸氧化酶发酵培养基组分为影响因素进行试验次数N=15的Plackett-Burman(PB)设计,试验的设计及结果见表2.
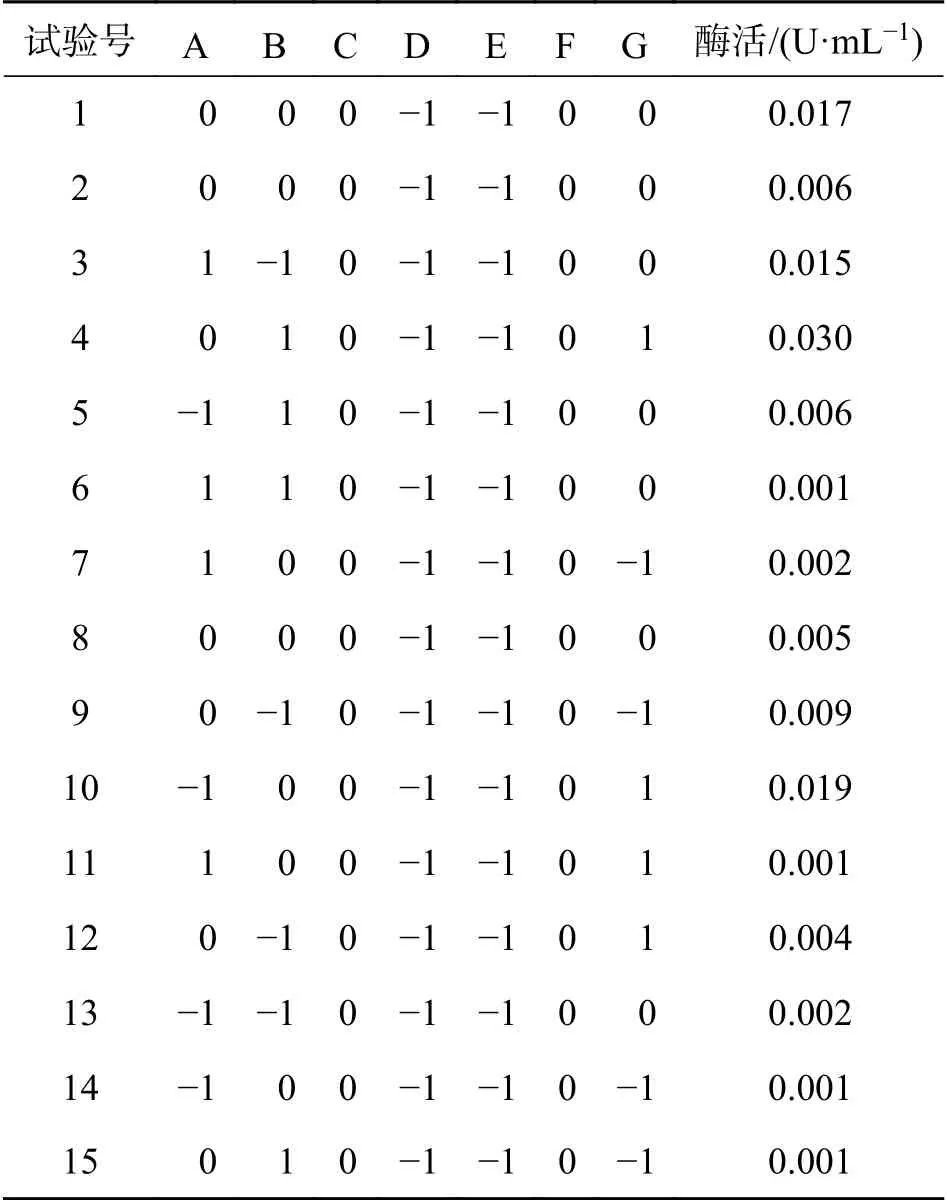
表2 Plackett−Burman试验设计与结果Tab.2 Design and results of Plackett-Burman experiments
结果显示(表2),试验号2、5、6、7、8、11、12、13、14和15酶活低于优化前(0.007 U/mL),试验号1、3、4、9和10酶活明显高于优化前,其中试验号4产酶条件优化效果最好,酶活约提高了4.3倍,达到了明显的优化效果.表明试验号4的条件设计为菌株DLCS-31的最佳产酶条件.
3 讨论
微生物种类繁多,是尿酸氧化酶的重要来源之一,但99%以上的微生物在实验室条件下无法培养.克隆和表达不同来源微生物的尿酸氧化酶基因是研发高效重组尿酸氧化酶药物的重要方法[20-21].尿酸氧化酶作为医学检测试剂和高尿酸相关疾病治疗用酶,具有非常广泛的市场应用前景.目前已有黄曲霉菌(Actinomadura amylolytica)、产朊假丝酵母菌(Candida utilis)和枯草芽孢杆菌(Bacillus subtilis uricase)等微生物被用于尿酸氧化酶的商业化生产,但是存在产酶量普遍较低,无法满足尿酸氧化酶生产的需求,且存在分离纯化程序复杂、酶学性质不稳定、抗原性高等问题[2,13].临床所用的重组尿酸氧化酶药物普遍具有半衰期短、免疫原性高、价格高等缺陷,并且在人体内环境条件下活性丧失严重,比活性一般小于60%[10-12].
本研究从苍山土壤环境中筛选得到了具有尿酸降解能力的1株菌株,编号为DLCS-31,经发酵初步酶活测试,酶活力为0.007 U/mL.经PB设计优化产酶条件,酶活约提高了4.3倍,为0.030 U/mL.经16S rRNA基因测序分析,DLCS-31属于Klebsiella属的菌株.该酶的最适反应温度为40℃,在25~50℃条件下有活性,表明该酶有良好的温度环境适应性,与大理本地环境温度较为相符.其最适pH为6.6,属于中性尿酸氧化酶,在pH 4.0~10.0范围内该酶有活性,表明该酶pH适应范围较广,对环境酸碱性不敏感,环境适应性较强. 在35、40 ℃和45℃下,该酶能在100 min以内保持超过60%的酶活,表明该酶热稳定性较好.随保温时长增加,相对酶活总体趋势呈现降低趋势,且温度越高,失活越早,温度耐受性质符合一般酶的性质.不同pH条件下处理12、24 h,该酶在pH 4.0~9.0范围内,能维持70%以上的活性,说明该酶pH耐受性较好.但与江绍锋、赵运胜和Bongaerts G.P.A早期报道的Klebsiella oxytoca[22],B. fastidiouss[23-24]及刘广桢等报道的Candida utilis[8]相比,酶活力较低,且最适温度、pH等酶学性质有一定的差异.此外,野生菌的生长和产酶依赖尿酸诱导,并且可同化的底物少,这就提高了尿酸氧化酶的生产及研究成本,尚需遗传改良以提高产酶率及活性.野生菌株的遗传背景相对复杂,提高酶活和改进酶学性质存在一定难度.因此,提高酶活性及改进酶学性质是我们下一步重点研究的方向.
