岗松总黄酮对脂多糖诱导RAW264.7细胞炎症的影响*
2021-12-03邱宏聪赖克道刘布鸣
邱宏聪,赖克道,梁 冰,王 丽,黄 艳,2,刘布鸣,2
(1.广西中医药研究院,广西南宁 530022; 2.广西中药质量标准研究重点实验室,广西南宁 530022)
0 引言
免疫系统最重要的核转录因子(NF-κB)广泛存在于多细胞有机体中,主要通过调控下游靶基因转录参与免疫炎症反应、细胞周期调控、细胞凋亡及细胞黏附等过程。NF-κB信号通路的异常激活通常会介导多种慢性炎症的发生[1,2],而通路相关蛋白的突变则会导致遗传性疾病的出现或免疫病变,因此开展NF-κB信号通路的研究,在临床炎症的治疗中具有深刻的应用前景。
岗松富含槲皮素、杨梅素等黄酮组分[3-7]。岗松总黄酮(GSH)为本课题组开发的专利产品[8],对体外培养的宫颈癌SiHa细胞增殖、迁移、侵袭具有明显的抑制作用,并促进其凋亡[9],且能显著抑制LPS诱导RAW264.7细胞中TNF-α及IL-6含量,下调iNOS、COX-2蛋白表达[10]。本研究将继续深入考察GSH对炎症因子IL-1β、IL-8、TGF-β,以及NF-κB信号通路中IκBα、NF-κB p65表达的影响,探讨GSH抗炎活性可能的作用靶点。
1 材料与方法
1.1 材料
1.1.1 细胞及培养
小鼠RAW264.7单核巨噬细胞(购自中国科学院细胞库),接种于含10%胎牛血清、100 U·mL-1青/链霉素的dMEM培养基中,然后置于5% CO2、37℃培养箱中培养。
1.1.2 药品与试剂
岗松药材采收于广西北海市,经广西中医药研究院姜平川研究员鉴定为岗松(BaeckeafrutescensL.)的干燥茎叶。MTT(SIGMA),IL-1β、IL-8、TGF-β ELISA试剂盒(RB公司),TRIZOL、TAQ、RNASE INHIB.、dNTP试剂(Life公司),β-actin抗体(江苏康为世纪生物科技股份有限公司),RIPA细胞裂解液(Thermo公司),PBS、蛋白酶抑制剂(Solarbio公司),预染蛋白marker(Formentas公司);IκBα抗体(CST公司),碱性磷酸酶标记的马抗小鼠IgG(北京中杉金桥生物技术有限公司),碱性磷酸酶显色试剂盒(上海碧云天生物技术有限公司),超纯水;其他试剂为分析纯。
1.1.3 仪器
酶标仪(Thermo 公司),QPCR(ROCHE公司),离心机(Eppendorf公司),Fastprep破碎仪(Mpbio公司),电泳仪(BIO-RAD公司),半干转膜仪(BIO-RAD公司)。
1.2 方法
1.2.1 GSH的制备[11,12]
将岗松茎叶用70%乙醇(固液比1∶16)进行3次提取,每次提取时间为60 min,过滤合并滤液并浓缩,使岗松提取药液的生药含量为0.3 g·mL-1。用AB-8型大孔吸附树脂填装柱子,将岗松提取药液上柱(1 BV·h-1流速、3 BV体积),用50%乙醇洗脱(2 BV·h-1流速、5 BV用量),浓缩,干燥,即得岗松总黄酮(GSH)。将GSH 用DMSO溶解,配制成50,100,200 μg·mL-1溶液,备用于细胞试验。
1.2.2 细胞分组及处理
取对数生长期的RAW264.7细胞,经0.25 g·L-1胰蛋白酶EDTA消化细胞后,调节细胞浓度至1×106个·mL-1,并接种于细胞培养瓶中。设置实验组分别为空白对照组(以无血清DMEM孵育);LPS模型组(加入0.1 μg·mL-1LPS孵育24 h);GSH组(设置GSH含量为50,100,200 μg·mL-13个剂量组,即GSH50、GSH100、GSH200),先GSH预处理细胞2 h后,再加入0.1 μg·mL-1LPS孵育24 h,待测。
1.2.3 MTT法检测细胞增殖活性
分组处理后的细胞,首先置于5% CO2、37℃培养箱中继续培养24 h,弃上清液;接着向每孔加入终质量浓度为1 mg·mL-1的MTT溶液100 μL,并将96孔板移至培养箱中继续孵育4 h后终止培养,吸弃上清液;然后,每孔加入200 μL DMSO溶液,置摇床上50 r/min震荡10 min;最后,于酶标仪上490 nm波长处测定各孔的吸光度。
1.2.4 ELISA法测定细胞中IL-1β、IL-8、TGF-β含量
取预处理后的细胞上清液,参照ELISA试剂盒说明书的要求操作,测定IL-1β、IL-8、TGF-β的含量。
1.2.5 WB法检测细胞中IκBα蛋白的相对表达量
分组处理后的细胞用冰PBS洗涤,加入蛋白酶抑制剂和磷酸酶抑制剂并收集细胞,经超声破碎后离心处理15 min (12 000 r·min-1,4℃),取上清液待用。采用电泳分离,每孔加25 μg上清液进行上样,分离后的蛋白转移到聚偏氟乙烯膜上,脱脂牛奶封闭,分别用一抗(IκBα、β-actin)孵育过夜,洗膜后,接着用二抗孵育,再次洗膜,显影。通过密度分析测定蛋白含量,目的蛋白的相对含量=目的蛋白密度/β-actin的密度。
1.2.6 QPCR检测细胞中NF-κB p65的mRNA基因表达
分组处理后的细胞采用Trizol一步法抽提总RNA,经反转录合成cDNA,其中,总RNA 5 μL、50 μmol·L-1Oligo(dT) 0.5 μL、10 μmol dNTP 1 μL、DEPC 水1 μL。β-actin引物序列:正向引物5′-CATTGTCACCAACTGGGACGATA-3′,反向引物5′-GGATGGCTACGTACATGGCTG-3′; NF-κB p65引物序列:正向引物5′-CACCAAGGATCCACCTCACC-3′,反向引物5′-AATGGCTTGCTCCAGGTCTC-3′。PCR扩增体系为20 μL,反应条件为95℃ 30 s,40个扩增循环(95℃ 10 s,60℃ 30 s,70℃ 45 s),循环完成后测定NF-κB p65的mRNA表达水平。采用相对定量研究分析法,以2-△△Ct比较各组之间NF-κB p65 mRNA 表达的差异。
1.2.7 统计学方法
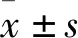
2 结果与分析
2.1 细胞增殖活性的检测
由表1可见,LPS组细胞存活率显著低于空白对照组,表明LPS对RAW264.7细胞具有抑制作用。不同浓度的GSH对LPS诱导的RAW264.7细胞具有显著的保护作用,细胞存活率均有提高。

表1 GSH对细胞增殖活性的影响Table 1 Effects of GSH on cell proliferation activity n=6)
2.2 IL-1β、IL-8、TGF-β含量的测定
由表2可见,正常RAW264.7细胞上清液的IL-1β、IL-8、TGF-β含量较低,给予0.1 μg·mL-1LPS刺激后,IL-1β、IL-8以及TGF-β含量均显著增加,而用50-200 μg·mL-1岗松总黄酮预处理细胞后,IL-1β、IL-8以及TGF-β均受到明显抑制(P<0.01)。

表2 GSH对IL-1β、IL-8、TGF-β的影响Table 2 Effects of GSH on IL-1β、IL-8、TGF-β
2.3 IκBα蛋白相对表达的检测
空白RAW264.7细胞IκBα表达较高,给予0.1 μg·mL-1LPS刺激后,IκBα表达明显降低,用不同浓度的GSH预处理细胞后,与LPS组比较,IκBα表达显著回升(P<0.05或P<0.01),表明GSH能有效上调炎症细胞中IκBα的表达(图1和图2)。
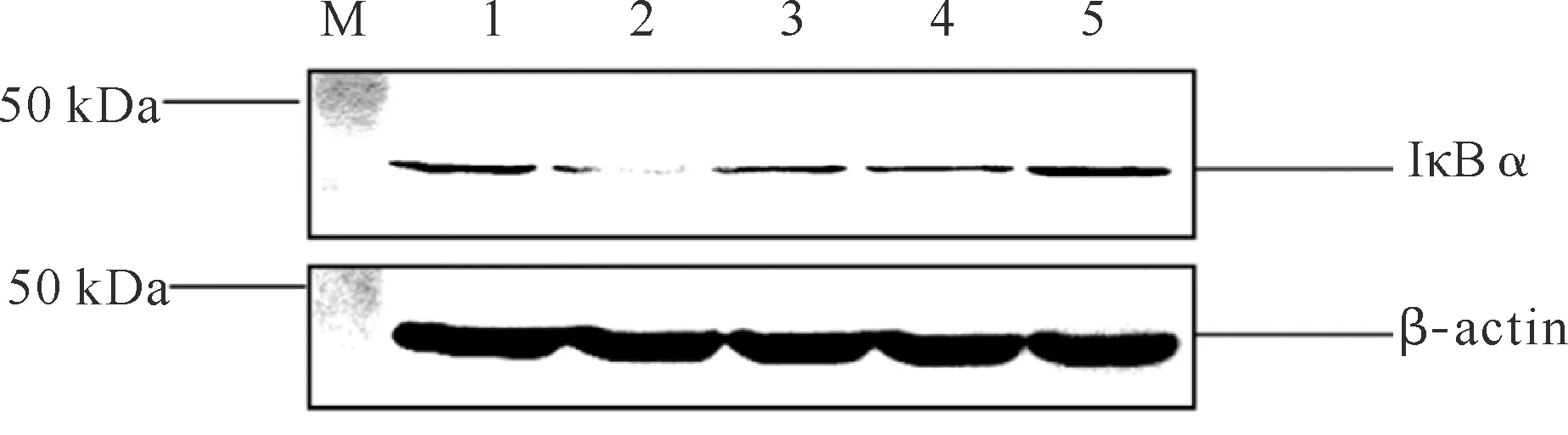
M:预染蛋白Marker Pre-stained protein marker;1:空白对照组Blank control group;2:LPS组LPS group;3:GSH50;4:GSH100;5:GSH200图1 GSH对IκBα蛋白表达的影响Fig.1 Effects of GSH on the expression of IκBα

与LPS组比较,*表示P<0.05,**表示P<0.01Compared with LPS group,*indicates P<0.05,**indicates P<0.01图2 IκBα蛋白相对表达量Fig.2 Relative expression of IκBα
2.4 NF-κB p65扩增曲线和溶解曲线
扩增曲线和溶解曲线见图3-6。从扩增曲线可以看出,荧光强度和初始拷贝数呈良好的线性关系。溶解曲线峰值单一,没有杂峰,表明QPCR产物纯度较高,反应具有良好的特异性。
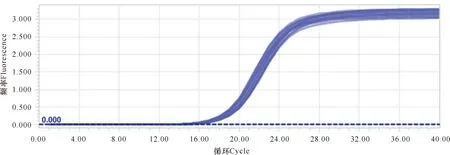
图3 β-actin扩增曲线Fig.3 Amplification curve of β-actin

图4 NF-κB p65扩增曲线Fig.4 Amplification curve of NF-κB p65

图5 β-actin溶解曲线Fig.5 Solubility curve of β-actin

图6 NF-κB p65溶解曲线Fig.6 Solubility curve of NF-κB p65
2.5 NF-κB p65的mRNA表达水平的检测
GSH对NF-κB p65 mRNA表达水平的影响结果见表3及图7。结果表明,空白RAW264.7细胞NF-κB p65表达较低,给予0.1 μg·mL-1LPS刺激后,表达明显增强;用不同浓度的GSH预处理细胞后,与LPS组比较,表达受到明显的抑制(P<0.01),表明GSH能有效抑制炎症细胞中NF-κB p65的过度表达。

表3 GSH对NF-κB p65 mRNA表达水平的影响 n=6)Table 3 Effects of GSH on NF-κB p65 mRNA expression

与LPS组比较,**表示P<0.01Compared with LPS group,**indicates P<0.01图7 NF-κB p65的mRNA相对表达量Fig.7 Relative expression of NF-κB p65 mRNA
3 讨论
本课题组通过建立LPS刺激RAW264.7细胞体外模型[13-15],评价GSH对RAW264.7细胞增殖活性的影响,采用ELISA、Western bloting 等方法,分析GSH对相关炎症因子(IL-1、IL-6、TGF-β、TNF-α等)和蛋白( iNOS和COX-2等)表达水平的影响。前期实验已证明GSH能显著抑制LPS诱导RAW264.7巨噬细胞中TNF-α及IL-6含量[10],本研究进一步验证:50 μg·mL-1剂量的GSH已经能显著抑制IL-1β、IL-8、TGF-β等炎症因子,并能够显著上调IκBα蛋白表达,表明GSH具有良好的抗炎活性。本实验β-actin和NF-κB p65溶解峰都为单峰,说明本实验的PCR扩增为特异性扩增;同时,定量检测结果显示,GSH能够抑制LPS诱导RAW264.7巨噬细胞中NF-κB p65 mRNA表达。
综上,GSH可促进RAW264.7细胞增殖(P<0.05),抑制LPS诱导的RAW264.7巨噬细胞中IL-1β、IL-8、TGF-β含量,上调IκBα蛋白表达,抑制NF-κB p65 mRNA表达,表明GSH可能通过抑制NF-κB信号通路,抑制下游炎症因子的表达,从而发挥抗炎活性作用。因此,抑制NF-κB信号通路可能是GSH发挥抗炎活性的一个作用靶点。然而,其具体的作用机制还需要进一步的研究。
