土壤环境中可降解丙酸细菌的筛选和鉴定
2021-12-03都萃颖卢佳熠姚国新戴余军
都萃颖,卢佳熠,胡 浪,姚国新,戴余军,李 静,郑 操
(湖北工程学院生命科学技术学院/湖北省植物功能成分利用工程技术研究中心,湖北孝感 432000)
低分子质量有机酸普遍存在于土壤环境中,在土壤形成、污染物转化和促进植物对养分吸收等过程中起着十分重要的作用[1‑4]。丙酸是土壤中含量较高的低分子质量有机酸之一[5‑6],目前已广泛应用于食品、化工等领域[7‑9]。丙酸的大量生产与使用,会加剧其向土壤、水体等环境中的排放,长此以来便有可能打破其在自然环境中的动态平衡,造成诸如土壤生态系统失衡等问题。丙酸的微生物降解利用是维系丙酸动态平衡状态的重要途径,挖掘土壤中可代谢丙酸的细菌资源,可为土壤修复提供资源材料,对于农业生态系统的可持续发展意义重大。
丙酸为短碳链脂肪酸,分解途径与脂肪酸的β-氧化路径一样,通常需要与辅酶A 结合形成丙酰-CoA才能被生物体利用。由于丙酰-CoA的主体含有3 个碳原子,不能直接参与脂肪酸经典的β-氧化过程,也不能直接进入三羧酸循环,因此,丙酸的氧化主要通过以下3条途径完成:(1)甲基丙二酸单酰-CoA 途径,此途径主要存在于动物体内;(2)3-羟基-丙酰-CoA 途径,此途径也需要经过一步β-氧化,但不同于脂肪酸经典降解的β-氧化过程,主要存在于植物和昆虫体内;(3)2-甲基柠檬酸循环途径,该循环途径广泛分布于细菌和真菌中[10]。由此可见,2-甲基柠檬酸循环是细菌代谢利用丙酸的最重要途径[11]。在大肠杆菌(Escherichia coli)[12]、肠道沙门氏菌(Salmonella enterica)[13]、耻垢分枝杆菌(Mycobacterium smegmatis)[14]、苏云金芽孢杆菌(Bacillus thuringiensis)[6]、谷 氨 酸 棒 杆 菌(Corynebacterium glutamicum)[15]等方面的研究表明,细菌通过2-甲基柠檬酸循环分解利用丙酸,从而为其生长和繁殖提供物质与能量。大多数研究仅关注2-甲基柠檬酸循环本身的生物学功能,例如,解析该循环中关键酶基因的转录调控及其介导的细胞生理功能,而很少从生态学的视角去审视自然环境中细菌分解代谢丙酸的重要意义。同时,以往研究常常以实验室中现有且已知的单一细菌菌株为研究对象,考察其对丙酸的利用能力,而不是从真实的生态环境中分离获得的菌株出发,有目的地研究其丙酸代谢能力和生态学功能。
丙酸是土壤中含量较高的低分子质量有机酸,因此,丙酸的微生物利用对于土壤生态平衡和微生物自身生存来说,都具有重大意义。目前,围绕丙酸的研究主要集中在微生物发酵生产和应用等方面[7,16],虽然在实验室中的研究也发现多种细菌可以利用丙酸[6,12‑15],但较少有研究关注实际环境中能够分解代谢丙酸的细菌。分离与鉴定土壤样本中可利用丙酸的细菌及其种属,促进对自然环境中具备丙酸代谢能力的细菌种属的认识,可为研究丙酸及其他低分子质量有机酸对土壤生态环境的影响及作用机制提供试验材料,为将相关菌株应用于土壤生态修复奠定基础。
1 材料和方法
1.1 试验材料
1.1.1 土壤样品的采集与前处理 共采集4份土壤样品,均来自湖北省孝感市湖北工程学院生命科学技术学院楼(以下简称生科楼)附近5~10 cm 的土层。将1—4 号土壤样品分别装入无菌密封袋中,4 ℃保存备用。各土壤样品的基本理化性质和采集生境:1号土壤样品采自生科楼东侧荒地,质地较疏松,颜色均一,呈黄棕色;2 号土壤样品采自生科楼南侧菜地,质地疏松,呈黄棕色;3 号土壤样品采自生科楼西侧石楠树下,质地疏松,呈棕色;4 号土壤样品采自生科楼北侧草地,质地松软,呈深棕色。将各土壤样品碾碎至细粉状,筛除较大的颗粒和杂物。
1.1.2 培养基配方 Lysogeny broth(LB)培养基:NaCl 10 g、酵母提取物5 g、蛋白胨10 g,pH 值7.0~7.5,加ddH2O定容至1 L。
含丙酸唯一碳源的培养基(以下简称丙酸培养基):丙酸钠8.27 g、(NH4)2SO42 g、K2HPO41 g、MgSO40.5 g、FeCl3·6H2O 0.1 g,pH 值7.0,加ddH2O定容至1 L。
相应的固体培养基需添加1.5%~2.0%的琼脂粉。所有培养基均在121 ℃高压灭菌30 min。
1.1.3 试剂与耗材 高保真PrimeSTAR®GXL DNA Polymerase 购自宝日医生物技术(北京)有限公司,1 kb DNA Ladder Marker 购自北京博迈德基因技术有限公司,细菌基因组DNA 抽提试剂盒、琼脂糖凝胶DNA 回收试剂盒购自北京百泰克生物技术有限公司。通过分析细菌16S rDNA 基因序列来鉴定各细菌分离株的种属,用于扩增16S rDNA 基因片段的引物名称及序列:27F,5′-AGAGTTTGATCCT‑GGCTCAG-3′;1541R,5′-AAGGAGGTGATCCACC‑C-3′[17],引物由南京金斯瑞生物科技有限公司合成。
1.2 试验方法
1.2.1 以丙酸为唯一碳源筛选土壤中可利用丙酸的细菌 称取1 g 粉末状土壤,溶解于9 mL 无菌水中,静置5 min 后用移液枪取1 mL 接种至20 mL 液体LB 培养基中,置于200 r/min、28 ℃恒温摇床复苏培养2 h 后,吸取适量培养原液涂布丙酸固体培养基,再置于28 ℃恒温培养箱中倒置培养2~3 d。将长出的单菌落挑至固体LB 培养基上复壮后,再将菌落转接至固体丙酸培养基上,以复证各菌株的丙酸利用能力。对于复证结果为阳性的菌株,将其置于-80 ℃、20%的甘油中保存。对采集的4 份土壤样品均采用上述相同操作,以分离目标菌株。
1.2.2 菌苔形态观察 将筛选获得的单菌落接种于固体丙酸培养基上,28 ℃培养2~3 d,利用肉眼观察菌苔的生长状态、颜色、透明度、光泽度与湿度,并作记录。
1.2.3 菌株分子生物学鉴定 利用细菌基因组DNA 抽提试剂盒抽提所有细菌分离株的基因组DNA,并将其作为模板扩增16S rDNA 基因片段,PCR 扩增程序:95 ℃预变性5 min;95 ℃变性40 s,50 ℃退火30 s,72 ℃延伸1.5 min,循环30 次;72 ℃延伸10 min,最后25 ℃延伸5 min。对扩增产物采用切胶法回收并测序,对测得的序列利用GenBank数据库BLAST 在线比对工具进行细菌分离株的种属分析[17]。
1.2.4 菌株中2-甲基柠檬酸循环关键酶基因分析prpC、prpD和prpB为2-甲基柠檬酸循环中的3个关键酶基因。通过16S rDNA基因鉴定所得目的菌株的全基因组序列尚未公布,因此,以目的菌株所在属的全基因组序列已公布的代表性菌株为对象,用已知的苏云金芽孢杆菌BMB171 中PrpC、PrpD 和PrpB 的氨基酸序列为查询序列,通过Bioedit 软件以本地比对的方式搜寻细菌分离株中prpC、prpD和prpB3个关键酶基因。
2 结果与分析
2.1 土壤样品中可利用丙酸的细菌菌株分离结果
将在液体LB 培养基中复苏得到的菌液涂布固体丙酸培养基,初筛得到单菌落菌株。为排除因LB培养基残留而导致的细菌在丙酸培养基上生长的可能性,将初筛得到的单菌落再复点至固体丙酸培养基上进行丙酸利用能力的复证,结果见图1。共筛选得到了10株细菌菌株,其中,B1、B2、B3 三株细菌分离自1号土壤样品;B4、B5 两株细菌分离自2号土壤样品;B6菌株分离自3号土壤样品;B7、B8、B9、B10菌株分离自4号土壤样品。
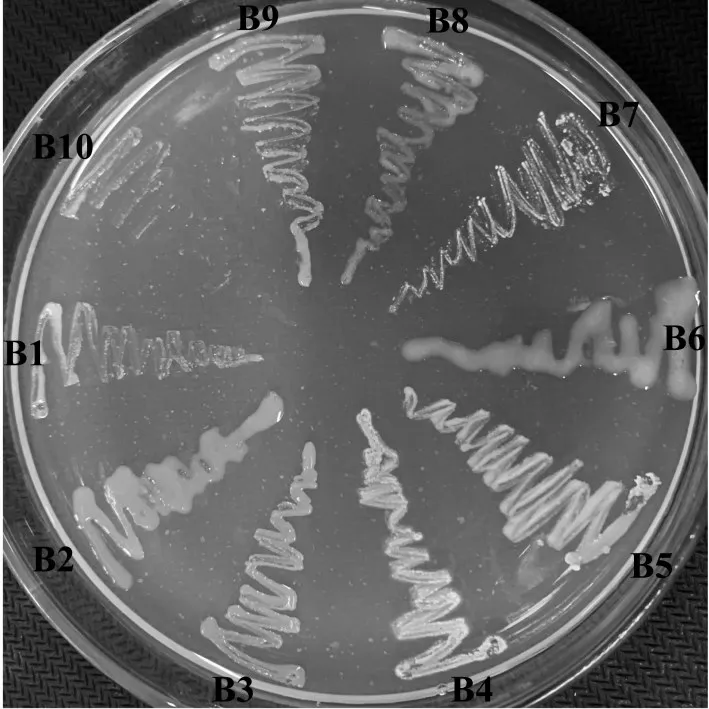
图1 10株细菌丙酸代谢能力复证Fig.1 Reconfirmation of propionic acid metabolism ability of 10 bacterial strains
2.2 分离菌株的菌苔形态学观察结果
对上述获得的10株细菌菌株进行生长状态、菌苔色泽等信息的形态学观察,结果见表1。B1 菌株菌落呈淡黄色,透明度、光泽度、湿度均为中等,但生长状态较差,说明该细菌利用丙酸的能力较弱,暗示其胞内丙酸代谢途径可能不发达或不活跃;B2菌株菌落呈红棕色,透明度中等,光泽度高,湿度大,生长状态好;B3 菌株菌落呈红棕色,透明度、光泽度、湿度均为中等,生长状态好;B4菌株菌落呈白色,透明度、光泽度低,湿度小,生长状态好;B5菌株菌落呈白色,透明度、光泽度低,湿度小,生长状态好;B6 菌株菌落呈乳白色,透明度中等,光泽度高,湿度大,生长状态好;B7 菌株菌落呈白色,透明度、光泽度低,湿度小,生长状态较好;B8菌株菌落呈红棕色,透明度中等,光泽度高,湿度大,生长状态较好;B9 菌株菌落呈红棕色,透明度、光泽度、湿度均为中等,生长状态较好;B10 菌株菌落呈淡黄色,透明度、光泽度、湿度均为中等,但是生长状态在10株细菌中表现最差。

表1 10株细菌的来源信息与菌苔形态观察结果Tab.1 Summary of the sample source and colony morphology of 10 bacterial strains
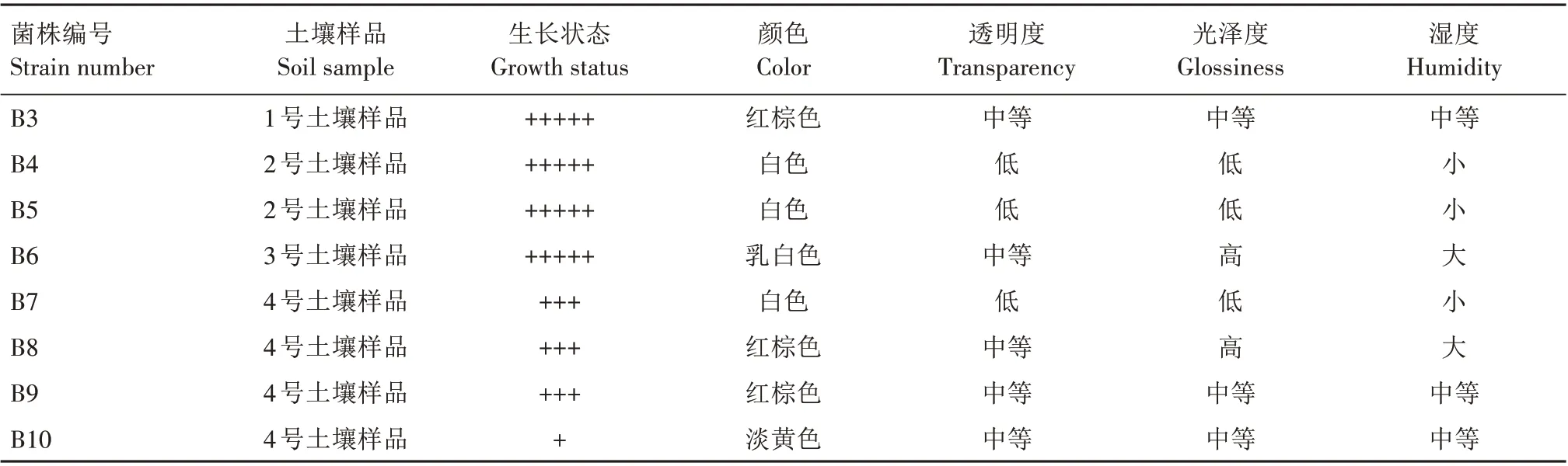
续表1 10株细菌的来源信息与菌苔形态观察结果Tab.1(Continued) Summary of the sample source and colony morphology of 10 bacterial strains
2.3 分离菌株的鉴定结果
抽提上述10 株分离菌株的总DNA,并用通用引物对27F/1541R 进行16S rDNA 基因片段扩增,扩增产物的检测结果如图2 所示。可以看出,泳道B1—B10 在1 500 bp 左右均有非常明显的条带出现,其大小与细菌16S rDNA 基因大小一致,表明10株菌株的16S rDNA 基因均已扩增成功。采用切胶法依次回收上述10 株细菌的16S rDNA 基因扩增产物,送至北京擎科新业生物技术有限公司进行DNA序列测定。
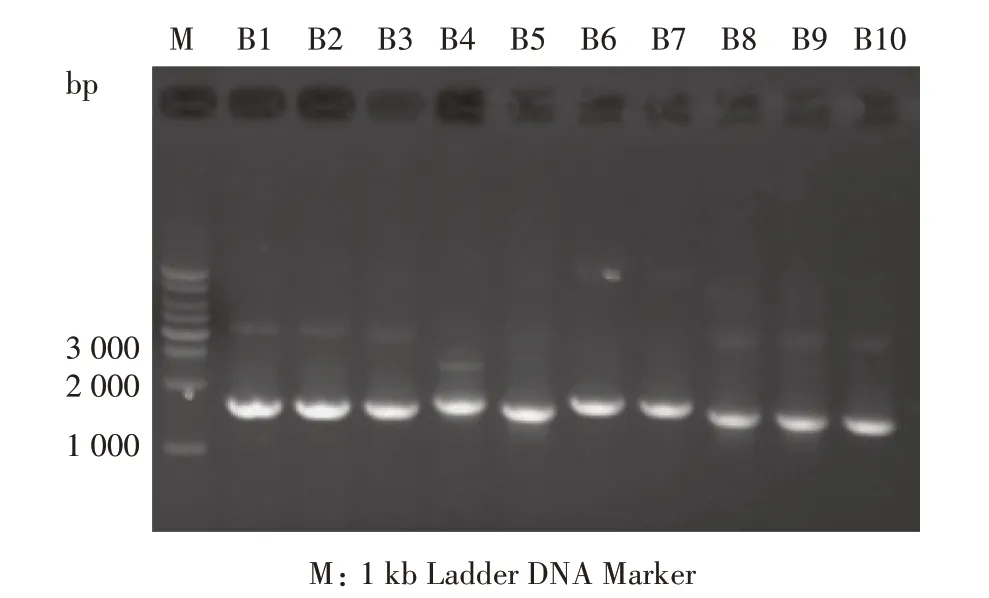
图2 10株细菌中16S rDNA基因RCR产物的琼脂糖凝胶电泳Fig.2 Detection of 16S rDNA genes of 10 bacterial strains by PCR amplification and agarose gel electrophoresis
利用GeneBank 数据库BLAST 比对分析10株细菌的16S rDNA 基因片段序列,结果见表2。由表2可知,B1 属于放线菌门(Actinobacteria)、节杆菌属(Arthrobacter);B2 和 B8 属 于 放 线 菌 门(Actinobacteria)、红球菌属(Rhodococcus);B3、B6、B10 同属厚壁菌门(Firmicutes)、芽孢杆菌属(Bacillus);B4 属于放线菌门(Actinobacteria)、链霉菌 属(Streptomyces);B5 属 于 放 线 菌 门(Actinobacteria)、微杆菌属(Microbacterium);B7 属于放线菌门(Actinobacteria)、白蚁菌属(Isoptericola);B9 属于放线菌门(Actinobacteria)、解木聚糖微菌属(Xylanimicrobium)。综上,4份土壤样品中能够利用丙酸的细菌种类较多,种属分布亦较为广泛。
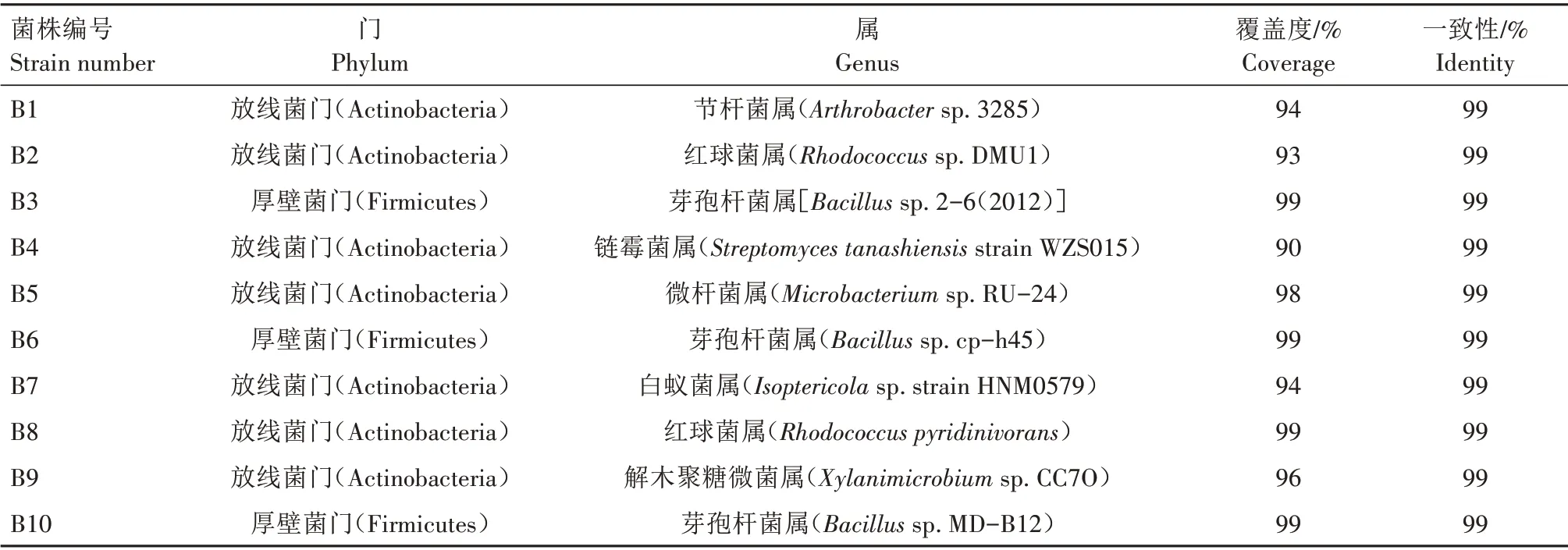
表2 10株细菌的种属鉴定Tab.2 Identification results of 10 bacterial strains
2.4 分离菌株中的丙酸利用途径关键酶基因的生物信息学分析
在细菌中,2-甲基柠檬酸循环是参与代谢丙酸的最主要的路径[6,11]。2-甲基柠檬酸循环与三羧酸循环高度关联,但在该循环中,存在3个特异性的关键酶蛋白,分别为2-甲基柠檬酸合成酶(PrpC)、2-甲基柠檬酸脱水酶(PrpD)和2-甲基异柠檬酸裂解酶(PrpB)(图3A)。3个关键酶的编码基因(prpC、prpD、prpB)在基因组中紧密排列,共同组成prp操纵子。基于此,分析了prpC、prpD和prpB3 个基因在10株菌株中的分布。结果表明,除属于红球菌属的2 株细菌(B2 和B8)不含有这3 个基因外,其余8 株细菌均含有完整的上述3 个基因(图3B),说明在红球菌属中,丙酸的分解代谢可能通过其他的路径介导完成。在除红球菌属以外的其他8 株细菌中,根据prpC、prpD和prpB3个基因的排列方式,可以将其分成Ⅰ和Ⅱ两大类。在第Ⅰ类细菌中,尽管有的菌株3 个基因位于正链,有的3 个基因位于负链,但3个基因的转录顺序依次为prpD、prpB、prpC;在第Ⅱ类细菌中,3 个基因的转录顺序则依次为prpC、prpD、prpB(图3B)。同时,第Ⅰ类细菌中所有的菌株都属于放线菌门,而第Ⅱ类中所有的菌株均属于厚壁菌门,暗示着不同门细菌中prpC、prpD和prpB3个基因来源于不同的进化分支。值得注意的是,在菌株B5 中,含有2 个拷贝的prpC、prpB和prpD,说明该菌株具备较强的丙酸代谢能力。
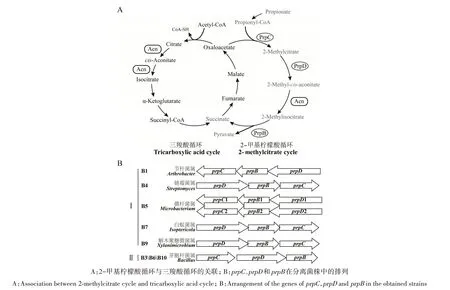
图3 分离菌株中2-甲基柠檬酸循环关键酶基因的分布Fig.3 Distribution of the key enzyme genes of 2-methylcitrate cycle in the obtained strains
3 结论与讨论
以丙酸为唯一碳源营养,从4 份土壤样品中共分离和鉴定得到10株细菌,分布于放线菌门和厚壁菌门中。这10株细菌对丙酸的利用能力差异较大,可作为后续细菌代谢丙酸分子机制及生态修复应用等研究的宝贵试验材料。
在自然环境中,丙酸可通过微生物合成与植物根系分泌等天然方式释放到环境中,是土壤中最常见的低分子质量有机酸之一[5‑6]。土壤微生物是生态系统中最重要的物质分解者,对于维持生态系统的平衡至关重要[18‑23]。这些微生物能够从土壤中获取必要物质能量以满足自身生长与繁殖,也是其发挥重要生态学功能的前提。本研究利用丙酸作为唯一碳源营养的方法从4份土壤样品中共分离筛选到10 株细菌,经过16S rDNA 鉴定,显示其均为革兰氏阳性细菌,分布于放线菌门(B1、B2、B4、B5、B7、B8、B9)和厚壁菌门(B3、B6、B10)。根据对细菌菌落生长状态的观察,可评判出相应细菌利用丙酸能力的强弱。其中,B2、B3、B4、B5、B6 菌株生长状态最好,说明其利用丙酸能力最强;而B10菌株生长状态最差,说明其利用丙酸能力最弱;其余菌株生长状态普遍较好,彼此间差异不大。此外注意到,B3、B6、B10菌株虽然同属芽孢杆菌属,但却呈现出了不同的生长情况,表明这些芽孢杆菌代谢丙酸的分子机制极有可能不同。进一步分析了细菌中重要的丙酸代谢路径2-甲基柠檬酸循环在10 株菌株中的分布,发现B2 菌株不具有2-甲基柠檬酸循环,表明B2 菌株极有可能通过其他路径代谢利用丙酸。本研究在揭示了具有丙酸代谢功能细菌种类的同时,也为细菌中丙酸代谢分子机制的研究提供了丰富的试验材料。
近年来,发展绿色生态和可持续性农业一直是热门研究方向与社会话题。丙酸作为重要的食品防腐剂和医药化工原料,已被广泛应用于食品和化工等行业[7-9]。丙酸的大量生产和使用,会导致自然生态环境中残留的丙酸浓度升高,从而影响包括丙酸在内的低分子质量有机酸在原有生态系统中的平衡。本研究筛选和鉴定到多株具有较强丙酸利用能力的细菌菌株(B2、B3、B4、B5、B6),其中B3 和B6菌株为芽孢杆菌,所产生的芽孢具备的强效环境抗逆特性也能够增强其作为生态修复功能菌的应用潜力。因此,本研究筛选得到的丙酸利用细菌,尤其是B3 和B6 菌株,为修复生态系统中因积累过量丙酸等低分子质量有机酸而产生的环境问题提供了宝贵的菌株资源。
