中心切割反相/反相二维液相色谱-串联质谱法测定烟叶潜香类糖苷
2021-12-02董惠忠沈世豪王天南汪阳忠刘百战
陈 敏,董惠忠,沈世豪,王天南,汪阳忠,吴 达,刘百战
(上海烟草集团有限责任公司技术中心,上海 200082)
糖苷是烟草致香中一类重要的前体物质,是指由单糖或低聚糖的R—OH、R2—NH、RSH和另一分子中的半缩醛羟基等基团形成的化合物。烟叶中糖苷类成分复杂,包括潜香糖苷类和多酚糖苷类[1]。离线分离制备实验表明,潜香类糖苷含量(10-6g/g)远低于多酚类糖苷(10-2g/g),多酚类糖苷背景干扰大,且二者分离难度大,目前尚无准确、快速测定烟草潜香类糖苷的报道。通过离线制备色谱研究发现,烟草潜香类糖苷主要包括3-氧代-7,8-二氢-α-紫罗兰醇-β-D-吡喃葡萄糖苷、3-氧代-α-紫罗兰醇-β-D-吡喃葡萄糖苷和3-羟基-β-二氢-大马酮-β-D-吡喃葡萄糖苷等,在卷烟燃吸时裂解成3-氧代-α-紫罗兰醇和巨豆三烯酮,对烟草吸味具有较大贡献[2]。因此,开发准确、快速的烟叶潜香类糖苷测定技术,对评价烟叶品质具有重要意义。
目前,用于检测烟草中糖苷含量的方法包括气相色谱-质谱法(GC-MS/MS)[3-4]、高效液相色谱-质谱法(HPLC-MS/MS)[5-6]、电喷雾电离质谱法(ESI-MS)[7]、超临界流体色谱法(SFC)[8]等。王燕等[9]利用热重、红外检测器的GC-MS/MS联用仪对3-氧代-α-紫罗兰醇-β-D-吡喃葡萄糖苷进行分析,发现在265 ℃条件下,糖苷可迅速反应生成大量巨豆三烯酮。GC-MS/MS法检测烟草糖苷的优点在于选择性好、仪器分辨率高、适于分析热稳定的小分子化合物,但缺点是化合物定性困难、无法同时准确区分烟草中不同糖苷物质。李苇苇等[10]采用反相高效液相色谱-质谱法(RPLC-MS/MS)分析烟草提取液中5种糖苷类化合物,通过分析相对分子质量和碎片离子结构,获得待测物分子结构,但该方法须反复制备,前处理繁琐。LC-MS/MS法检测烟草糖苷的优点在于效率高、应用范围广,但缺点是耗时较长、前处理较繁冗[11-13]。
二维液相色谱技术分析复杂基质样品具有极高的灵敏度和选择性[14],现已被广泛用于检测烟气中烟草特有的亚硝胺(TSNAs)[15-16]、烟叶农药残留[17]、烟叶香味成分前体物等方面[17-20]。
本研究拟采用二维液相色谱法测定烟叶潜香类糖苷,样品经第一维液相色谱有效分离后,目标组分经稀释后中心切割至捕集柱,阀转动后目标组分洗脱至第二维进一步分离分析,最后进入三重四极杆质谱多反应监测模式(MRM)分析。由于两维采用不同的流动相和色谱柱,且中心切割能够有效去除大部分干扰成分,可显著提高目标物灵敏度。将该方法应用于不同类型、不同产地烟叶样品中3种糖苷的测定,并分析糖苷含量与烟叶品质的内在关系。
1 实验部分
1.1 仪器与装置
中心切割二维色谱由Agilent 1290 液相色谱、Agilent 1260四元泵、Agilent 1260单泵和六通阀构成:均为美国Agilent公司产品;API 4000三重四极杆质谱仪:美国AB Sciex公司产品;电子天平(感量0.000 1 g):瑞士Mettler Toledo公司产品;SW12H超声仪:瑞士Sono Swiss公司产品;Milli-Q纯水仪:美国Millpore公司产品。第一维液相色谱柱CAPCELL PAK MGⅢ C18(2.0 mm×50 mm×3 μm),第二维液相色谱柱Welch Ultimate XB C18(2.1 mm×200 mm×3 μm),捕集柱(C18柱)Thermo Scientific Acclaim Polar Advantage Ⅱ(4.6 mm×10 mm×5 μm):均为安谱公司产品。
1.2 材料与试剂
烤烟烟末(0.42 mm,40目):上海烟草集团有限责任公司产品;乙腈、甲酸、甲醇:色谱纯,德国Merck公司产品;0.22 μm有机相滤膜:安谱公司产品。
1.3 实验条件
1.3.1样品预处理 称取0.5 g烟末(精确至0.1 mg)于20 mL离心管中,加入10 mL纯乙腈,30 ℃超声萃取20 min,以2 000 r/min离心3 min,取上清液,过0.22 μm有机相滤膜。
1.3.2色谱条件 中心切割二维液相色谱-串联质谱进样量为2 μL,柱温均为30 ℃。第一维反相液相色谱中,流动相A为0.1%甲酸水溶液,B为0.1%甲酸甲醇溶液;梯度洗脱程序:0~3 min(95%A),3~20 min(95%~25%A),20~20.1 min(25%~5%A),20.1~25 min(5%A),25~26 min(5%~95%A),26~50 min(95%A);流速0.2 mL/min。第二维反相液相色谱中,流动相C为0.1%甲酸水溶液,D为0.1%甲酸乙腈溶液;梯度洗脱程序:0~20 min(95%C),20~40 min(95%~60%C),40~40.1 min(60%~5%C),40.1~45 min(5%C),45~45.1 min(5%~95%C),45.1~50 min(95%C),流速0.4 mL/min。六通阀切割时间为16~18 min,此时补液流路为水,流速1 mL/min,其他时间流速0.1 mL/min。
1.3.3质谱条件 电喷雾离子源(ESI),正离子多反应监测模式扫描;喷雾电压(ion-spray voltage)5 500 V;雾化气Gas1压强413.7 kPa;辅助雾化气Gas2压强344.7 kPa;气帘气(curtain gas)压强137.9 kPa;离子源温度300 ℃;去簇电压60 V;检测时间20 ms;糖苷检测离子对列于表1。

表1 糖苷检测的离子对Table 1 Ion pairs of mentioned glycoside detection
2 结果与讨论
2.1 中心切割二维液相色谱-串联质谱系统的建立
本研究建立的中心切割二维液相色谱检测装置示于图1。第一维色谱系统(1D)利用C18柱对样品基质分离除杂,将目标馏分经中心切割至第二维色谱柱内收集保留,再利用第二维色谱系统(2D)分离后进行定量检测。同时,在分析过程中通过六通阀切换,达到理想的分离纯化效果。
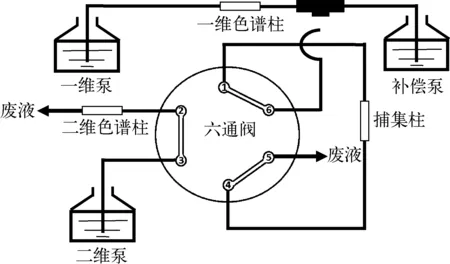
图1 中心切割反相/反相二维液相色谱系统Fig.1 Heart-cutting Rp/Rp two dimensional liquid chromatography system
烟叶糖苷的化学结构复杂,标准样品难以获得,因此,采用易获得的芸香苷标样代替。由于烟叶潜香类糖苷与芸香苷的极性相似,在反相液相色谱上的保留时间接近[22]。采用芸香苷标样对糖苷可能流出的区域进行标记,在此基础上确定二维切割时间,将烟叶潜香类糖苷转移至第二维反相液相色谱进一步分离。芸香苷的一维液相色谱紫外吸收图示于图2,保留时间为17.3 min,推测烟叶糖苷可能在附近共流出。
以芸香苷保留时间为基准,分别将二维切割时间设置为15~16 min、16~17 min、17~18 min、18~19 min。馏分经过补液稀释后在捕集柱上富集,通过阀转动,被第二维流动相分离后进入MRM模式。第一维不同切割时间的糖苷MRM谱图示于图3。第一维切割15~16 min、18~19 min馏分中均无3种糖苷目标物;第一维切割16~17、17~18 min馏分中,3种糖苷均有信号。因此确定第一维馏分切割时间为16~18 min。
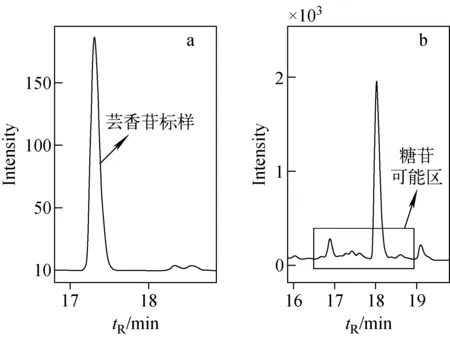
注:a.芸香苷标样;b.烟叶样品图2 一维液相色谱的紫外吸收谱图Fig.2 UV absorption spectra in the first dimensional chromatography
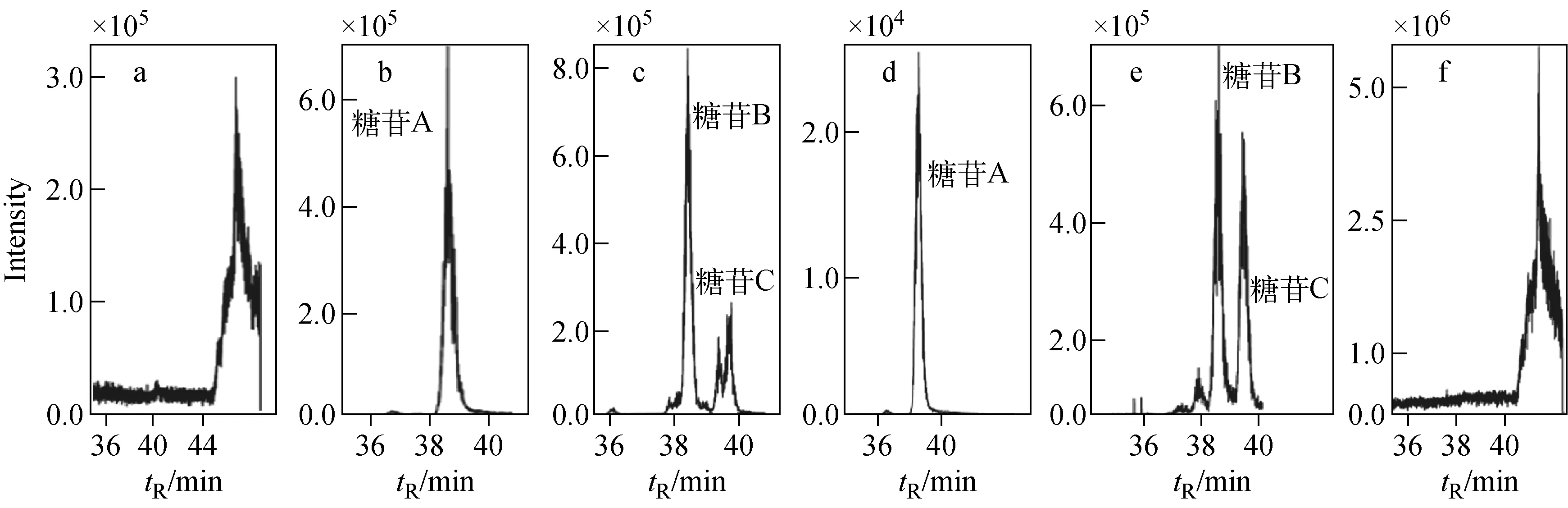
注:a.15~16 min;b.c.16~17 min;d.e.17~18 min;f.18~19 min图3 不同切割时间的第一维馏分经第二维分离后进入质谱的MRM图Fig.3 MRM diagrams of glycoside mentioned in the first dimensional step during different elution times
2.2 方法重复性
对实际样品中糖苷A、B和C进行日内、日间重复性考察,结果列于表2。结果表明,日内重复性相对标准偏差(RSD)在1.0%~3.2%之间,日间重复性RSD在2.8%~8.4%之间,能够满足日常检测需求。
2.3 不同类型烟叶样品考察
本实验测定了不同类型的烟叶样品,结果列于表3。可见,白肋烟中糖苷含量很低,烤后烟叶和青烟叶中糖苷含量较高,与文献[21]报道一致。香料烟、晒红烟、晒黄烟中糖苷的相对含量约为烤烟的10%~20%,这可能由于白肋烟、晒烟在晾晒调制过程中糖苷发生了降解。

表2 实际样品测定中方法重复性考察(n=3)Table 2 Repeatability in real samples (n=3)
烤烟、白肋烟、香料烟、晒烟等不同类型烟叶的还原糖含量差异显著,烤烟还原糖含量显著高于晾晒烟,葡萄糖含量一般在10%以上。因此,烤烟中类胡萝卜素降解产物3-氧代-α-紫罗兰醇、3-羟基-β-二氢大马酮、3-氧代-7,8-二氢-α-紫罗兰醇在C13-降异戊二烯醇的糖苷含量最高。白肋烟调制过程中,烟叶水分和晾房温湿度适宜,调制周期长,烟叶酶活性维持时间长,糖分呼吸消耗多,还原糖消耗量大,因此白肋烟中糖和糖苷含量最低,该结果与文献[21-22]报道一致。
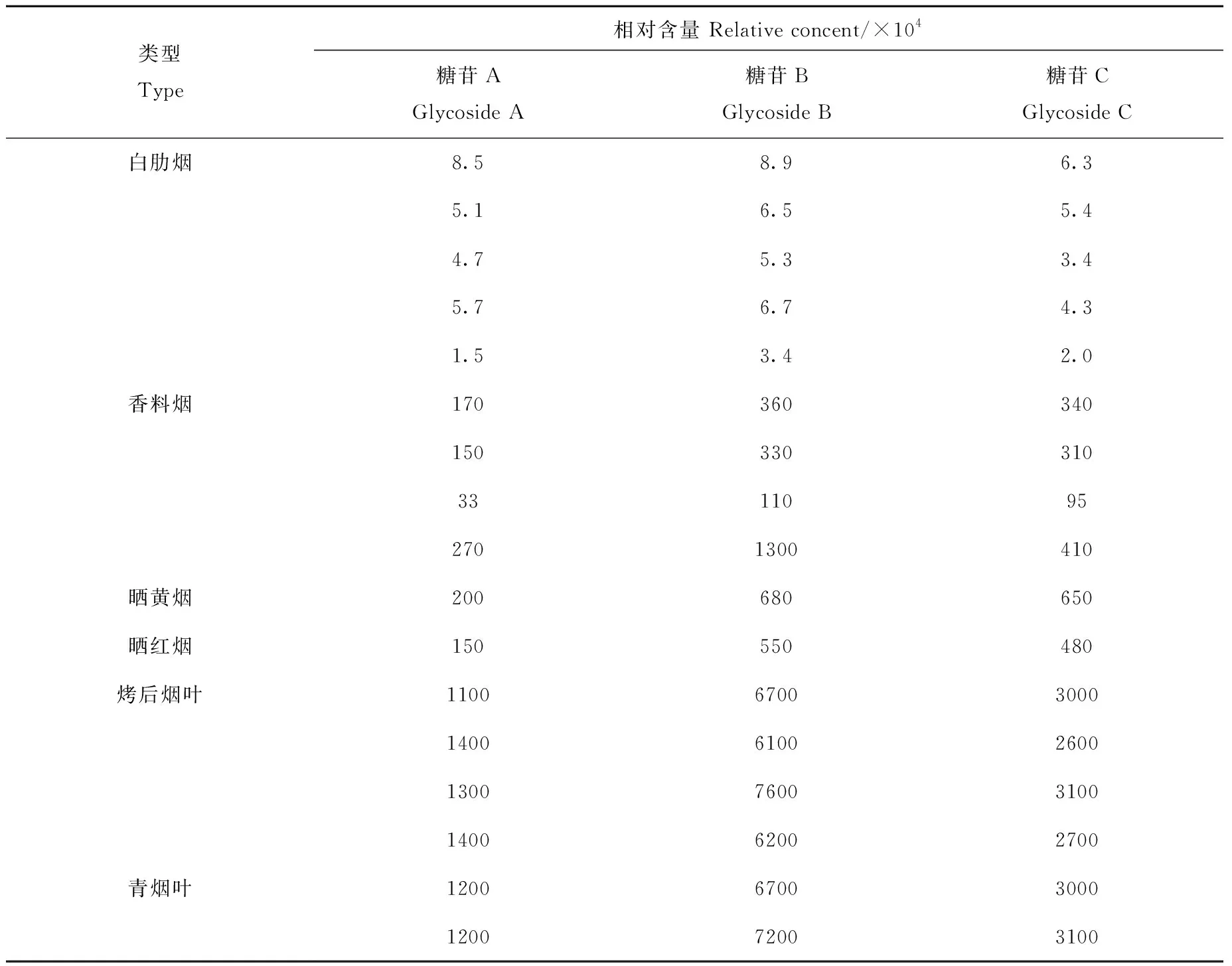
表3 不同类型烟叶中糖苷的相对含量(峰面积)Table 3 Relative concent (peak area) of detected glycosides in different tobacco leaves
香料烟、晒烟烟叶中的还原糖含量介于烤烟与白肋烟之间,潜香糖苷含量也介于二者之间。因此,不同类型烟叶中还原糖含量越高,则糖苷含量越高。
2.4 不同香型、产地样品的糖苷含量分析
对来自不同产地的157个烟叶样品进行测定,以中间香型样品为基准进行归一化,将清香型、浓香型和中间香型样品取均值进行分析,结果示于图4。可以发现,不同香型的样品中,清香型样品的糖苷A含量较高,浓香型样品的糖苷B和糖苷C含量相对较高,中间香型烟叶样品各组分含量处于二者之间。
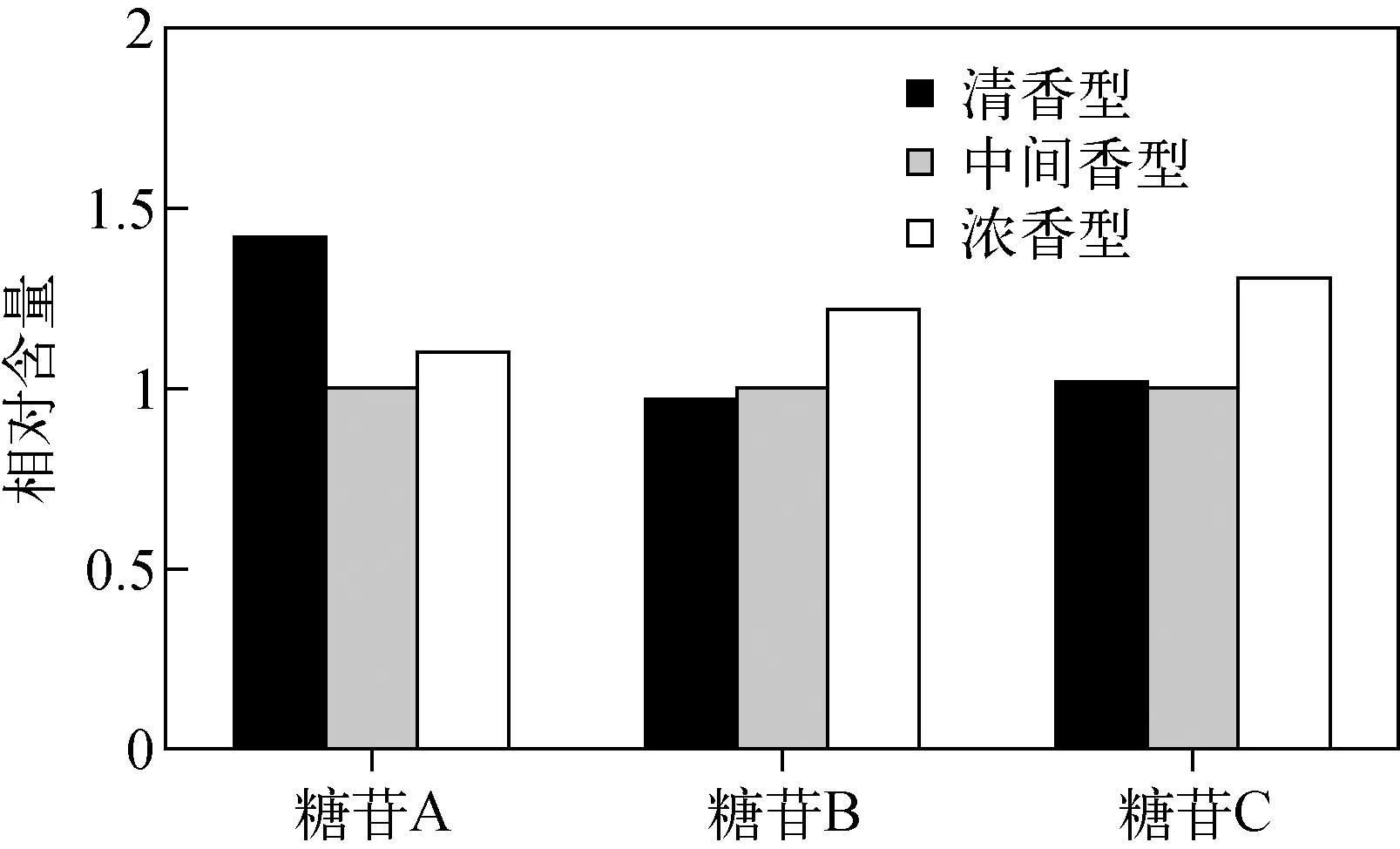
图4 不同香型烟叶样品中糖苷的相对含量Fig.4 Relative concents of glycosides in different tobacco samples
不同产地烤烟的糖苷相对含量均值示于图5。糖苷A,糖苷B和糖苷C含量有明显差异,总体上糖苷B和糖苷C含量较高,变化规律相似,糖苷A含量略低。从糖苷总量看,糖苷总量较低的为黑龙江、四川,糖苷总量较高的为河南、山东,糖苷总量中等的为福建、云南、贵州。
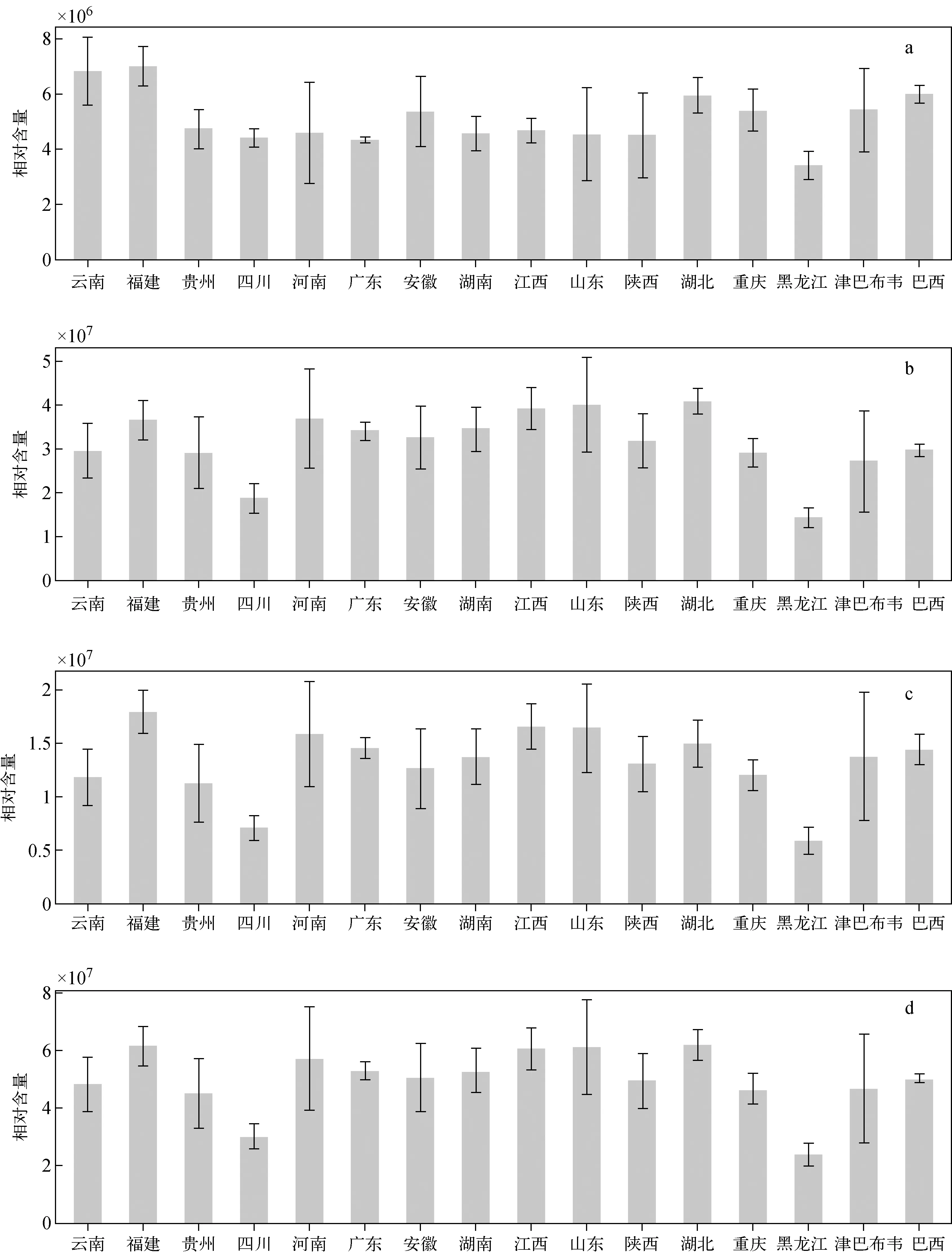
注:a.3-氧代-7,8-二氢-α-紫兰罗醇-β-D-吡喃葡萄糖苷;b.3-氧代-α-紫罗兰醇-β-D-吡喃葡萄糖苷;c.3-羟基-β-二氢-大马酮-β-D-吡喃葡萄糖苷;d.糖苷总量图5 不同产地烤烟糖苷的相对含量均值Fig.5 Average relative contents of glycosides from different regions
3 结论
本研究建立了中心切割反相/反相二维液相色谱-串联质谱法测定烟叶中潜香类糖苷含量,具有样品前处理简单、仪器自动运行、重复性好、检测结果稳定可靠,适用于大批量烟叶样品的日常检测。
