小反刍兽疫病毒H蛋白的原核表达及免疫原性测定
2021-12-01李丹宋浩志高维崧刘兴健张志芳李轶女
李丹,宋浩志,高维崧,刘兴健,张志芳,李轶女
中国农业科学院生物技术研究所,北京100081
小反刍兽疫(peste des petits ruminants,PPR),俗称羊瘟,又称小反刍兽假性牛瘟,是由小反刍兽疫病毒(peste des petits ruminants virus,PPRV)引起的一种急性、烈性、接触性疾病[1],其发病率和死亡率分别达到100%和90%[2]。该病于1940年首次发生于非洲象牙海岸,之后逐渐蔓延[3]。2003年以来,我国周边的缅甸、老挝、俄罗斯等国家相继爆发了严重的小反刍兽疫疫情[4]。2007年7月我国西藏自治区日土县热帮乡龙门卡村发生PPR疫情后,又相继发生了多起流行疫病[5],且该病传播速度快、风险高,对我国动物疫情的防控造成极大的威胁[6]。我国已将其列为一类动物疾病,为最高关注级别。
目前,对于小反刍兽疫尚无有效的治疗方法,主要通过研制疫苗进行防控[7]。传统疫苗如弱毒疫苗、灭活疫苗,虽然可以有效预防疫病的发生,但是无法通过血清学检测区分疫苗免疫动物与自然感染动物[8],难以在PPR流行地区进行有效的调查,且在保存、使用和接种等方面均易出现相关问题[9]。近年来,基因工程疫苗取得了巨大的进展,由于其具有安全、免疫效果可靠、易大量生产等特点,在预防小反刍兽疫疫情中发挥重要作用。但作为一种新型疫苗,基因工程疫苗仍有较多需要改进的地方[10],如免疫效力有待提高及可能产生免疫耐受、插入突变等现象。近年来,PPR疫苗的研制仍是研究的热点。
小反刍兽疫病毒属于副黏病毒科、麻疹病毒属[11],其基因组为单股负链RNA[12],含有6个基因,依次为3′-N-P-M-F-H-L-5′,编码核衣壳蛋白(N)、磷蛋白(P)、基质蛋白(M)、融合蛋白(F)、血凝蛋白(H)和大蛋白(L)6个结构蛋白和C、V 2种非结构蛋白[13]。其中,PPRV的H基因全长1 852 bp,编码609个氨基酸,分子量约为70 kD[14]。PPRV H蛋白具有神经氨酸酶及血凝素活性[15],其是病毒表面的主要抗原,与宿主细胞表面受体连接,可诱导机体产生中和抗体[16−17]。因此,H蛋白可作为抗原进行PPRV疫苗研究。本研究将H蛋白在原核表达系统中进行表达,并通过菌株筛选及表达条件进行优化提高H蛋白表达量,将该抗原制备为疫苗在小鼠中对其免疫效果进行评价,以期为H蛋白筛选出一种高表达条件,并对原核表达系统中表达的H蛋白免疫原性进行初步评价。
1 材料与方法
1.1 主要材料及试剂
SPF级实验小鼠购自北京维通利华实验动物技术有限公司;T4DNA连接酶、DNA聚合酶、重组酶购自北京诺维赞生物科技有限公司;质粒提取试剂盒、凝胶回收试剂盒、BCA蛋白定量试剂盒购自天根生化(北京)科技有限公司;限制性内切酶、Protein marker购自Thermo Scientific公司;鼠源PPRV H单克隆抗体购自英国皮比赖特研究所(Pirbright Institute);HRP标记山羊抗小鼠IgG购自Beyotime公司;化学发光试剂盒购自碧云天生物技术公司;佐剂Montanide GEL 02 PR购自法国SEPPIC公 司;TOP10、BL21(DE3)、BL21(DE3)PLySs、Rosetta(DE3)感受态细胞、Vero细胞由实验室保存;PPRV疫苗株(PPRV 75/1 Clone9)购自天康生物技术公司;胎牛血清(fetal bovine serum,FBS)及DMEM培养基购自Gibco公司;ELISA及包涵体纯化所用试剂配方参照张伟业等[18]的方法。其余试剂均为国产分析纯;PPRV的H基因由南京金斯瑞生物科技有限公司合成,引物合成及测序由北京睿博兴科生物科技有限公司完成。
1.2 原核表达载体的构建
1.2.1 目的基因的优化合成从GenBank数据库中查找目前公布的小反刍兽疫H蛋白的氨基酸序列,利用Mega[19]软件进行序列比对,筛选出1条符合我国流行趋势的氨基酸序列,对其进行跨膜区预测及信号肽分析。综合考虑密码子使用情况及临近密码子使用频率等其他负面约束,对PPRV的H基因序列进行优化,并在其5′端添加起始密码子及BamHⅠ酶切位点,3′端添加终止密码子及EcoRⅠ酶切位点,将该基因序列送至南京金斯瑞生物技术有限公司进行合成,合成的基因连接于pUC57载体上,并命名为pUC57-PPRV H。
1.2.2 原核表达载体的构建根据优化后的
pUC57-PPRV H基因设计引物进行PCR扩增,引物序列为PPRV H-F1:5′-CGGGATCCATGAGCGCGCAGCGTGAACGTATC-3′;PPRV H-R1:5′-CGGAATTCTTACACCGGGTTGCAGGTAACC-3′(下划线处分别表示BamHⅠ和EcoRⅠ酶切位点)。PCR程序为:95℃预变性5 min;95℃变性30 s,57℃退火30 s,72℃延伸1 min,30个循环。扩增产物经琼脂糖凝胶电泳检测,并利用胶回收试剂盒回收目的片段,利用BamHⅠ和EcoRⅠ双酶切后在T4 DNA连接酶作用下连接于pET28a载体上,转化TOP10感受态细胞,在卡那抗性平板上筛选出阳性菌落,提取质粒,并用BamHⅠ和EcoRⅠ进行双酶切鉴定,鉴定正确的质粒送至北京睿博兴科生物科技有限公司测序。
1.3 重组蛋白的诱导表达
将重组质粒pET28a-PPRV H转化大肠杆菌BL21(DE3)、Rosetta(DE3)、BL21(PLySs)感受态细胞,在卡那抗性(50 mg·mL−1)平板中筛选阳性菌落,挑取单菌落于4.5 mL相同浓度卡那抗性的无菌LB培养基中,置于37℃摇床220 r·min−1培养2.5~3.5 h,加入不同浓度IPTG诱导6~8 h,同时,设置未加诱导剂作为对照。8 000 r·min−1离心10 min收集菌体,并加入450 μL PBS重悬,按照破碎3 s停5 s的原则进行超声破碎,12 000 r·min−1离心10 min,收集上清及沉淀,分别取10 μL上清及沉淀进行SDS-PAGE分析。
1.4 融合蛋白的亲和纯化
在200 mL培养基中大量表达PPRV H蛋白,离心收集菌体。加入20 mL裂解缓冲液置于冰上裂解30 min,然后进行超声破碎(功率为200 W)5次,每次间隔2 min,12 000 r·min−1离心10 min,收集沉淀,用20 mL包涵体洗涤液Ⅰ和包涵体洗涤液Ⅱ洗涤1次,弃多余液体,沉淀中加入20 mL脲NTA-0 Buffer缓冲液于4℃过夜溶解。12 000 r·min−1离心10 min,取上清用0.45 μm滤器过滤后装入镍柱,收集穿透液重复上柱2次,分别用咪唑浓度为50、100、250 mmol·L−1的NTA-尿素缓冲液进行洗脱,收集洗脱液,进行SDS-PAGE检测纯化结果。
1.5 Western-blot分析及质谱鉴定
将表达的蛋白样品进行SDS-PAGE后,用湿转法转移至硝酸纤维素膜上,在3%的BSA中过夜封闭,将鼠源PPRV H单克隆抗体稀释1 000倍后孵育1.5 h,再将HRP标记山羊抗小鼠IgG稀释5 000倍孵育1.5 h,每次孵育前用PBST将多余液体清洗干净。最后在膜上滴加化学发光液后置于化学发光仪中显色。对鉴定正确的样品,切取SDS-PAGE中大小合适的蛋白胶条置于PBS缓冲液中,送至上海欧易生物公司,使用Easy-nLC 1 200液相系统、高pH分离液相色谱仪等进行质谱鉴定。
1.6 重组蛋白PPRV H免疫小鼠
将购买的Balb/c小鼠饲养至7周龄,取纯化的PPRV H蛋白样品20 μg与佐剂Montanide GEL 02 PR按照7∶1混合后腹腔多点注射小鼠,同时,设置PBS组作为阴性对照,每个样品设10个重复。从一免2周开始每周进行眼球后静脉取血,取得的血液室温静置2 h,2 000 r·min−1离心5 min分离血清。免疫3周后,以相同剂量进行二次免疫,每周取血清置于−80℃冰箱保存。
1.7 酶联免疫吸附实验(ELISA)检测血清抗体滴度
对纯化好的PPRV H蛋白用蛋白定量试剂盒进行浓度测定,用包被缓冲液稀释至5 μg·mL−1,每孔100 μL加入96孔板中,置于4℃冰箱过夜包被。每孔加入300 μL 3% BSA,置于37℃培养箱封闭1.5 h。将小鼠血清从200倍开始进行2倍倍比稀释后,每孔加入100 μL孵育1.5 h,同时将PBS组血清以相同倍数稀释作为阴性对照。以HRP标记的山羊抗小鼠IgG为二抗,每孔100 μL孵育1 h。每次抗体孵育前用PBST将多余液体清洗干净。加入OPD显色液于暗处显色30 min,加入50 μL 2 mol·L−1硫酸终止反应,在酶标仪中492 nm处测定吸光值。计算P/N值,样品组大于阴性对照2.1倍即为阳性。
1.8 中和抗体检测
将Vero细胞用含10%FBS及1‰青霉素链霉素(1∶1)的DMEM培养基稀释至105个·mL−1,每孔100 μL加入96孔板中培养约10 h,待细胞完全贴壁。将小鼠血清置于56℃水浴锅30 min使灭活补体,经0.22 μm滤膜过滤后,用无血清DMEM培养基进行2倍倍比稀释。将稀释后的血清与等体积的100倍半数组织细胞感染量(median tissue culture infective dose,100 TCID50)PPRV疫苗株混合,置于37℃培养箱孵育1 h。每孔200 μL加入培养好的Vero细胞中,每个样品设5个重复,同时设置空细胞对照组及病毒对照组。每天观察细胞发病状况,待病毒对照组全部发病时进行记录,能完全中和病毒的血清最大稀释倍数即为血清的中和抗体效价。
2 结果与分析
2.1 目的基因的优化合成
从GenBank数据库中获取小反刍兽疫H蛋白的氨基酸序列(GenBank:AJE30413.1),小反刍兽疫病毒H蛋白编码609个氨基酸,对其进行信号肽预测及跨膜区分析,结果显示,PPRV H蛋白无信号肽,其36~58位为跨膜区序列。去除跨膜区及胞内区序列,将其余氨基酸序列进行密码子优化,优化后基因长度为1 659 bp,通过密码子适用指数(codon adaptation index,CAI)及GC含量预测其表达水平,结果显示,H蛋白优化后序列的CAI达0.94,表明该基因序列的密码子使用情况较理想,GC含量为46.98%,在理想的GC含量范围内,预测该基因有较高的表达水平。将该序列送至南京金斯瑞生物技术有限公司进行合成。
2.2 原核表达载体的构建
设计引物通过PCR扩增出PPRV的H基因序列,经琼脂糖凝胶电泳,在1 600 bp附近出现清晰的目的条带,与预期大小一致(图1A),对其进行回收后利用双酶切法连入pET28a载体,在卡那抗性平板中筛选出阳性菌株,提质粒后用BamHⅠ与EcoRⅠ进行酶切鉴定,结果如图1B所示,在1 600 bp及5 300 bp附近分别出现目的基因及载体条带,与预期结果相符。将该质粒送至北京睿博兴科生物技术公司测序,测序结果与目的片段相符,表明原核表达载体pET28a-PPRV H构建成功。
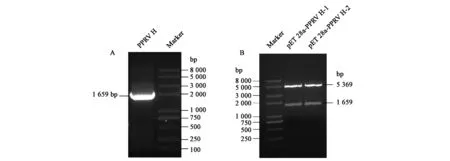
图1 目的基因的PCR扩增及重组质粒的BamHⅠ、EcoRⅠ酶切鉴定Fig.1 PCR amplification of the target gene and BamHⅠand EcoRⅠdigestion identification of the recombinant plasmid
2.3 重组蛋白的诱导表达
将重组质粒转化BL21(DE3)、Rosetta(DE3)、BL21(DE3)PLySs感受态细胞,经表达条件优化后,筛选出表达量高的Rosetta(DE3)菌株在37℃、0.5 mmol·L−1IPTG诱导7 h进行表达。表达产物经SDS-PAGE检测,与未诱导组相比,IPTG诱导后在65 kD附近出现清晰条带,与预期大小相符。且该蛋白主要出现在沉淀中,表明外源蛋白主要以包涵体形式表达,可溶性表达较少(图2)。

图2 重组蛋白在Rosetta菌株中的诱导表达Fig.2 Induced expression of recombinant protein in Rosetta strains
2.4 重组蛋白的亲和层析纯化及浓度测定
在大量诱导表达的菌液中收集菌体,经超声破碎、离心、洗涤、溶解等步骤后,将包涵体样品用镍柱进行亲和层析纯化,纯化的样品经SDS-PAGE检测,在咪唑浓度为100及250 mmol·L−1的NTA-脲洗脱液中均有单一蛋白被洗脱下来,大小与目的蛋白相符(图3)。将纯化得到的单一蛋白样品混合后用BCA蛋白定量试剂盒进行浓度测定,结果显示,纯化得到的蛋白浓度为108 μg·mL−1。
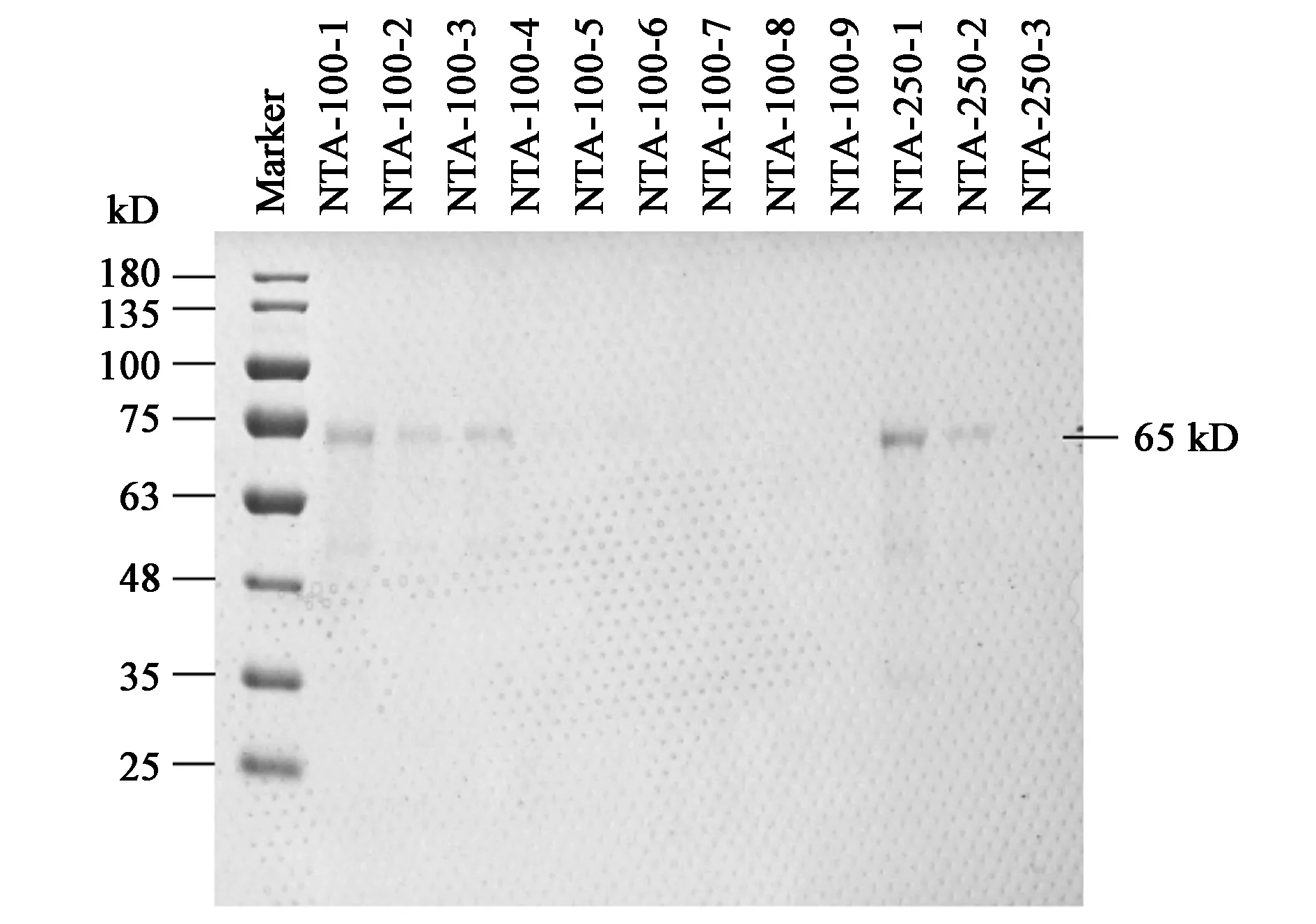
图3 重组蛋白的镍柱亲和纯化Fig.3 Nickel column affinity purification of recombinant protein
2.5 Western blot分析及质谱鉴定
以PPRV H单克隆抗体作为一抗,HRP标记山羊抗鼠IgG为二抗对纯化的样品进行Western blot试验,在约65 kD附近出现清晰条带,大小与预期一致,而对照中无相应条带(图4),表明目的蛋白在大肠杆菌中表达,且表达量较高。进一步切取目的蛋白进行质谱鉴定,结果表明该蛋白为PPRV H蛋白。
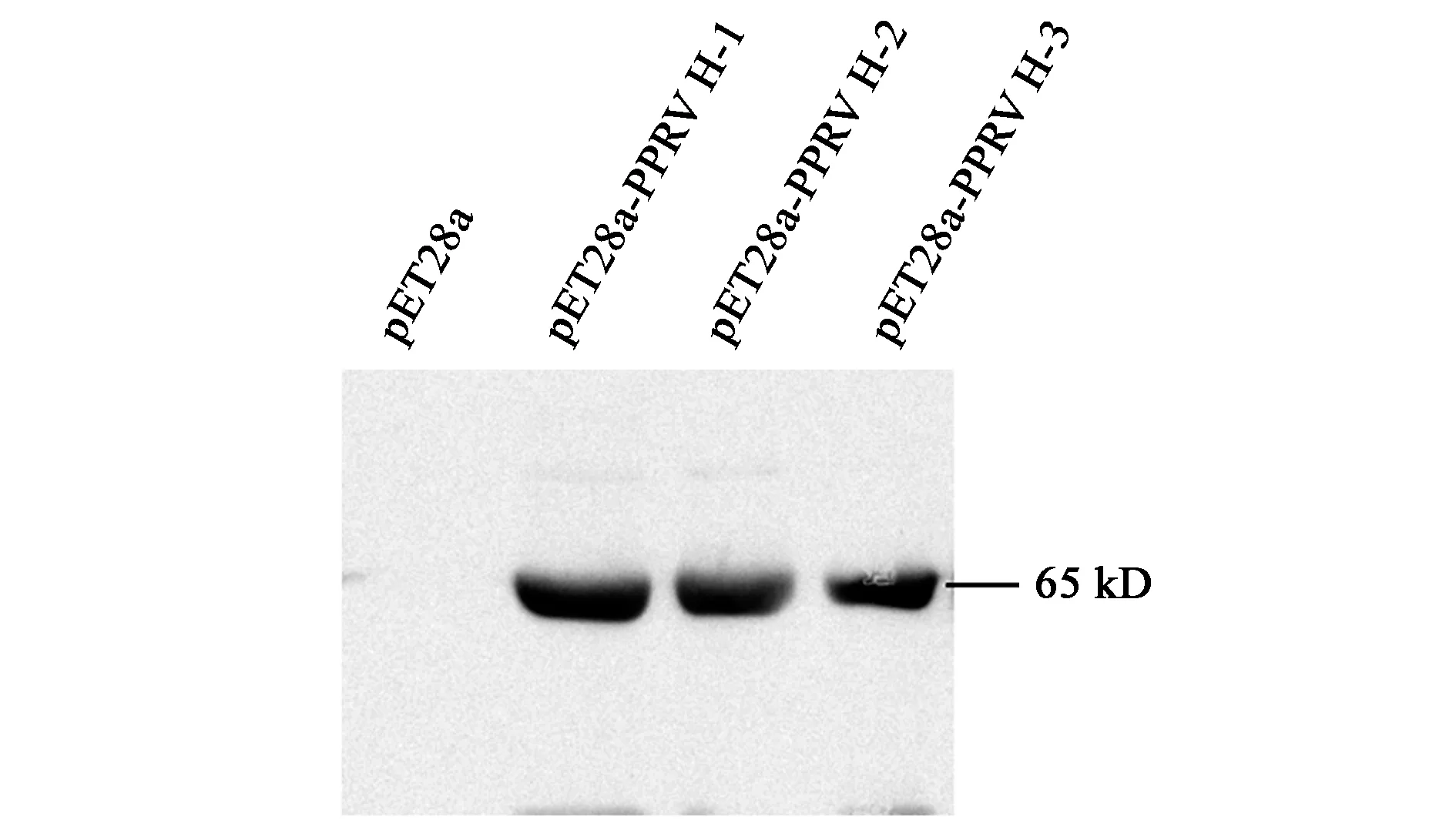
图4 重组蛋白的Western blot分析Fig.4 Western blot analysis of recombinant protein
2.6 重组蛋白免疫小鼠后血清抗体效价检测
将20 μg纯化的PPRV H蛋白样品混合佐剂后以免疫小鼠,取血清后以0.5 μg H蛋白作为抗原进行ELISA效价检测。一免2周时,样品组吸光值明显高于对照组,表明小鼠产生了PPRV H蛋白抗体,抗体滴度为1∶100。随着时间延长抗体滴度逐渐升高,在两免2周时抗体滴度达到1∶6 400,表明H蛋白可诱导小鼠产生较强的免疫反应(图5)。

图5 重组蛋白免疫小鼠后引起的抗体效价检测Fig.5 Detection of antibody titer caused by recombinant protein immunization in mice
2.7 重组蛋白免疫小鼠后血清抗体效价检测
为测定血清对PPRV病毒的中和效价,进一步对两免2周时血清在Vero细胞上进行中和抗体检测。如图6所示,加入TCID50的病毒感染细胞时,细胞出现明显聚集、皱缩等病变现象;当加入的小鼠血清能完全抑制病毒扩增时,无病变现象出现;空细胞对照组无病变现象。结果显示,该血清对PPRV疫苗株具有明显的中和效应,根据Reed-Muench法计算后,其中和抗体效价不高于1∶40。
3 讨论
近年来,随着生命科学的发展,小反刍兽疫疫苗的研发取得了明显的进展,灭活疫苗、基因工程疫苗、重组疫苗相继问世,对控制小反刍兽疫疫情蔓延具有重要作用。但这些疫苗通常需辅助剂以提高免疫效果,仍需开发出可引起强烈的细胞免疫应答和体液免疫应答的疫苗,以有效控制该病在我国的蔓延,甚至消灭该病,因此,对小反刍兽疫疫苗的研制引起了人们广泛关注。PPRV H蛋白是病毒粒子上的重要糖蛋白之一,具有神经氨酸酶活性和血凝素活性,其主要作用是作为受体连接病毒和宿主细胞,调节病毒吸附及侵入,并能诱导机体产生中和抗体[7],是机体主要的保护性免疫原。
Tian等[20]将H蛋白全长克隆至pET28a载体上,并在Rosetta菌株中进行表达,优化条件后其表达量仍较低,而选择将H蛋白的主要抗原位点分段进行表达,表达量明显提高,且能引起宿主的免疫反应,但抗原的完整性受到影响,进而可能影响后续试验。2006年,陈勇军等[21]发现,将猪繁殖与呼吸综合症病毒GP5蛋白的跨膜区去掉,在原核表达系统中可明显提高该蛋白的表达量,并证实去掉跨膜区的GP5蛋白仍能诱导良好的体液免疫和细胞免疫。因此,为高效表达具有免疫活性的H蛋白,可将H蛋白跨膜区及胞内区序列去掉,保留其所有胞外区序列进行表达。另外,丁军颖等[22]发现,菌株浓度不同时进行诱导表达,对丁肝抗原蛋白的表达具有重大影响。王劼等[23]发现,菌株浓度、IPTG用量及诱导时间对目的蛋白表达量均有显著影响。因此,合适的表达条件对提高外源蛋白的表达量具有重要意义。本研究对表达菌株及表达条件进行了优化,筛选出表达量高的菌株在合适的条件下表达H蛋白,为原核表达系统表达H蛋白提供了实验基础。
目前在大肠杆菌中表达PPRV H蛋白主要用于制备抗体[24],本研究利用大肠杆菌Rosetta(DE3)菌株高效表达仅去除跨膜区的H蛋白,并对表达蛋白在小鼠中的免疫效果进行了评价,发现该蛋白在小鼠中引起了较强的免疫反应,血清抗体滴度在两免2周时达到1∶6 400,并产生了PPRV病毒的中和抗体,表明大肠杆菌表达的H蛋白具有良好的免疫原性及反应原性,能诱导小鼠产生保护性中和抗体,说明原核表达的H蛋白作为PPRV亚单位疫苗的研究应用前景良好。
