6-氯-1,4-二氢-1,4-环氧萘的合成*
2021-12-01徐小娜王晓霞仝红娟
徐小娜,王晓霞,李 祯,柯 苗,仝红娟
(1.咸阳职业技术学院 医药化工学院,陕西 咸阳 712000;2.陕西省中药绿色制造技术协同创新中心,陕西国际商贸学院 医药学院,陕西 西安 712046)
萘作为一种常见的芳香族化合物,广泛的存在于自然界及人工合成分子中,具有重要的用途[1-3]。基于萘结构的衍生物在药物化学领域展现出的优异的发展前景,表现出广泛的生物活性,如人类免疫球蛋白 E(lge)抗体抑制活性[4]、抗疟疾活性[5]、杀菌活性[6]、抗肿瘤活性等[7]。苯炔作为有机合成中的活泼中间体,具有反应活性高、反应速度快、在低温条件下就可以发生反应等特点[8-10]。因而,苯炔被用于多种类型的反应[11,12],其中最主要的反应类型之一就是Diels-Alder 反应,苯炔中碳碳三键的亲电性很强,在Diels-Alder 反应作为亲二烯体,可以与环戊二烯、呋喃等二烯体发生反应,用来制备各种桥环类化合物,以苯炔和呋喃为原料,经过Diels-Alder 反应是构建氧桥环化合物的一种有效方法[13]。
为了研究含有氧桥环结构的萘衍生物在药物化学方面的应用,本研究以4-氯-2-碘苯酚(2)为原料,分别经过羟基保护和Diels-Alder 反应,两步合成得到6-氯-1,4-二氢-1,4-环氧萘(1),目标化合物(1)是一种含有氧桥环结构的萘衍生物,其结构中氯取代基和烯烃可以进一步进行衍生化(图1)。该研究提供了一种结构新颖的含有氧桥环结构的萘衍生物,并为该类化合物的设计合成提供了一种可行的方法。


图1 6-氯-1,4-二氢-1,4-环氧萘(1)的合成路线Fig.1 Synthetic route of 6-chloro-1,4-dihydro-1,4-epoxynaphthalene(1)
1 实验部分
1.1 原料与仪器
4-氯-2-碘苯酚(纯度99%)、4-甲基苯磺酰氯(TsCl)(纯度 98%)、N,N-二异丙基乙胺(DIEA)(纯度99%)、呋喃(纯度99%)、异丙基溴化镁(i-PrMg-Br)的四氢呋喃溶液(1mol·L-1),泰坦生物科技有限公司;柱层析硅胶(300~400目青岛海洋化工厂)。
AV300 型核磁共振仪(CDCl3或 DMSO-d6为溶剂,TMS 为内标,德国 Bruker 公司);Ultima Global Spectrometer 型质谱仪(ESI 源,美国 Waters 公司);RE-52AA 旋转蒸发仪(上海亚荣生化仪器厂);SHBШ 循环水式多用真空泵(郑州长城工贸有限公司)。
1.2 合成方法
1.2.1 4-氯-2-碘苯基-4-甲基苯磺酸酯(3)的合成 N2保护下,将 5.1g(20.0mmol)4-氯-2-碘苯酚、5.2g(40.0mmol)DIEA 分别加入 80mL 二氯甲烷中,搅拌均匀后,缓慢滴加5.0g(26.0mmol)4-甲基苯磺酰氯(TsCl)的二氯甲烷溶液(80mL),加完后室温反应1h,反应结束后加入150mL 饱和食盐水稀释,用分液漏斗分离出有机相,然后经无水Na2SO4干燥、减压浓缩、硅胶柱层析分离纯化(v石油醚∶v乙酸乙酯=10∶1),得到7.5g 黄色固体,收率92%。1H NMR(300MHz,CD3OD):δ 7.83~7.78(m,3H),7.47~7.42(m,3H),7.30(d, J=8.7Hz, 1H), 2.48(s, 3H)。ESI-MS, m/z: 409.0[M+1]+。
1.2.2 6-氯-1,4-二氢-1,4-环氧萘(1)的合成 无水、N2保护下,将 408mg(1.0mmol)4-氯-2-碘苯基-4-甲基苯磺酸酯(3)溶于15mL 无水四氢呋喃中,然后缓慢滴加1.3mL(1.3mmol)异丙基溴化镁,反应在-78℃下进行30min,然后用注射器缓慢滴加410mg(6.0mmol)呋喃,加完后继续在室温下反应30min。TLC 监测反应结束后,加入5mL 饱和NH4Cl水溶液淬灭反应,再加入20mL 饱和食盐水稀释,最后用乙酸乙酯(20mL×3)萃取,有机相合并后经无水Na2SO4干燥、减压浓缩、硅胶柱层析分离纯化(v石油醚∶v乙酸乙酯=5∶1),得到 118mg 灰白色固体,收率66.5%。1H NMR(400MHz,CDCl3)δ 7.40(s,1H),7.13(s, 2H), 7.04(qd, J=5.5, 1.4Hz, 2H), 5.71(s, 2H);13C NMR(100MHz, CDCl3)δ 151.29, 147.71, 142.68,142.13, 127.13, 123.48, 120.99, 118.24, 81.59。ESIMS, m/z:179.2[M+1]+。
2 结果与讨论
2.1 物料比对化合物1 收率的影响
在异丙基溴化镁作用下,4-氯-2-碘苯基-4-甲基苯磺酸酯(3)原位生成苯炔中间体,然后与呋喃发生Diels-Alder 反应生成6-氯-1,4-二氢-1,4-环氧萘(1),因此,两种反应原料呋喃与4-氯-2-碘苯基-4-甲基苯磺酸酯(3)的物料摩尔比对产物1 收率的影响较大。按照1.2.2 反应条件,考察物料比即n呋喃∶n3对产物 1 收率的影响,结果见表 1。

表1 物料比对化合物1 收率的影响Tab.1 Effect of mole ratio on the yield of compound 1
当 n呋喃∶n3=4∶1 时,产物 1 收率只有 44.7%,当呋喃的量增加到物料摩尔比为 n呋喃∶n3=6∶1 时,产物1 收率达到最高66.5%,而继续增加呋喃用量,收率没有明显变化。因此,选择最佳物料摩尔比为n呋喃∶n3=6∶1。
2.2 异丙基溴化镁用量对化合物1 收率的影响
4-氯-2-碘苯基-4-甲基苯磺酸酯(3)异丙基溴化镁(i-PrMgBr)作用下脱除碘原子,原位生成苯炔中间体(4-氯苯炔),理论上只消耗一个当量异丙基溴化镁,但由于反应体系不能保证绝对无水,会有少量异丙基溴化镁被消耗,所以需要异丙基溴化镁过量才能保证反应完全,但如果异丙基溴化镁过量太多,又会有其他副产物生成。因此,控制反应中异丙基溴化镁的用量对产物1 的收率具有重要影响,按照1.2.2 的反应条件,考察异丙基溴化镁的用量,即ni-PrMgBr∶n3对产物1 收率的影响,结果见表2。

表2 异丙基溴化镁用量对化合物1 收率的影响Tab.2 Dosage of i-PrMgBr on the yield of compound 1
当异丙基溴化镁用量为ni-PrMgBr∶n3=1.1∶1 时,产物1 收率仅为54.8%,增加其用量为ni-PrMgBr∶n3=1.3∶1时,产物1 收率最高达到66.5%,继续增加异丙基溴化镁的用量,产物收率出现降低,副产物增多。所以确定异丙基溴化镁的最佳用量为ni-PrMgBr∶n3=1.3∶1。
2.3 反应温度和时间对化合物1 收率的影响
苯炔中间体性质非常活泼,通常在较低温度下(-78℃)即可发生反应,温度升高会伴随副产物增多。因此,4-氯-2-碘苯基-4-甲基苯磺酸酯(3)在异丙基溴化镁(i-PrMgBr)作用下原位生成的苯炔中间体(4-氯苯炔),再呋喃发生Diels-Alder 反应得到产物1,为了减少副产物的产生,所以需要尽量控制反应温度在-78℃进行,通过TLC 监测可以看出,该反应过程非常快,在-78℃下反应30min,原料可以消耗完全并得到产物1,然后自然升至室温反应30min,对于产物收率没有明显的影响。因此,对于反应时间考察意义较小。
2.4 产物1 的核磁共振谱图分析
对于目标化合物 1 的1H NMR 分析(图 2),δ 7.40,单峰,积分为1H,归属为芳环氢;δ 7.13,单峰,积分为 2H,归属为芳环氢;δ 7.04,qd 峰,偶合常数分别为5.5 和1.4Hz,积分为2H,归属为烯烃两端氢信号;δ 5.71,单峰,积分为2H,归属为氧桥环两个桥头上次甲基信号。对于目标化合物1 的13C NMR 分析(图 3),δ 151.29、147.71、142.68、142.13、127.13、123.48、120.99、118.24 均属于芳环或烯烃结构上的碳核信号;δ 81.59 是氧桥环两个桥头上次甲基碳核信号。通过对1H NMR 和13C NMR 分析,可以确定产物1结构的正确性。
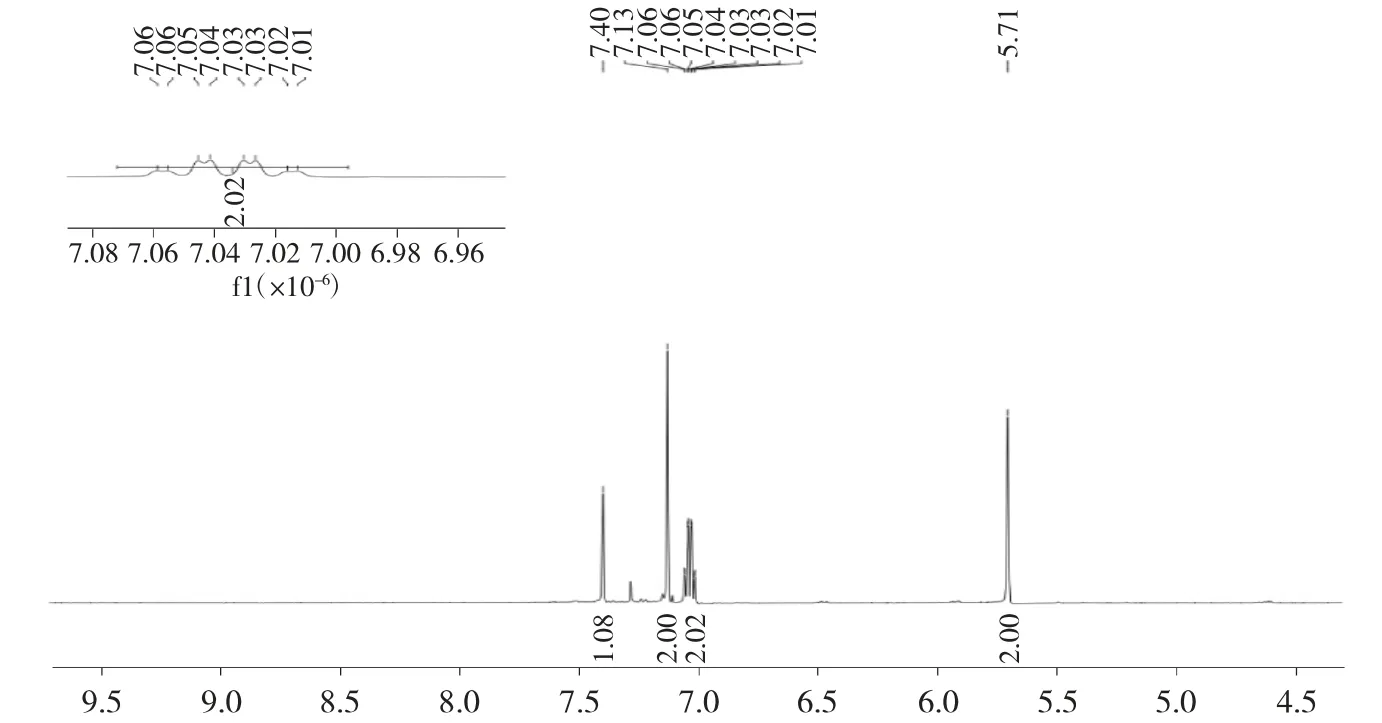
图2 化合物1 的核磁共振氢谱Fig.21H NMR of compound 1
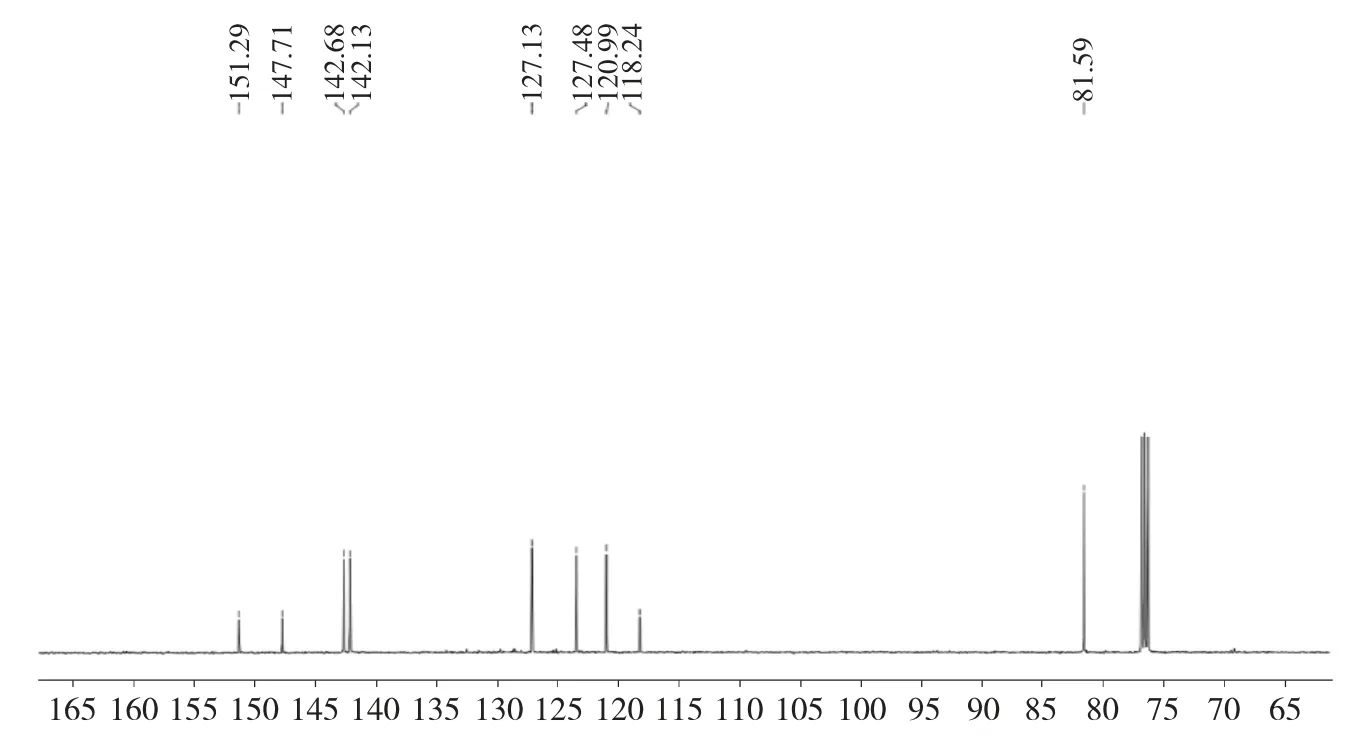
图3 化合物1 的核磁共振碳谱Fig.313C NMR of compound 1
3 结论
本研究报道以4-氯-2-碘苯酚(2)为原料,首先经过羟基保护得到4-氯-2-碘苯基-4-甲基苯磺酸酯(3),然后在异丙基溴化镁作用下原位生成苯炔中间体,最后再和呋喃发生Diels-Alder 反应得到氧桥环化合物6-氯-1,4-二氢-1,4-环氧萘(1),并重点讨论影响产物收率的主要因素,确定最佳反应条件为:物料摩尔比为n呋喃∶n3=6∶1;异丙基溴化镁的最佳的用量为ni-PrMgBr∶n3=1.3∶1。该研究为氧桥环化合物合成及活性分子开发提供了可行方法及参考思路,具有一定的应用价值。
