淡豆豉发酵制备过程异黄酮变化规律研究△
2021-12-01赵佳琪王满元陈红王思齐张海硕付予劼
赵佳琪,王满元*,陈红,王思齐,张海硕,付予劼
1.首都医科大学 中医药学院,北京 100069;2.中医络病研究北京市重点实验室,北京 100069
淡豆豉是一味药用历史悠久、临床应用广泛的发酵炮制类中药,《中华人民共和国药典》(以下简称《中国药典》)2020 年版规定其原料为豆科植物大豆Glycine max(L.)Merr.的干燥成熟种子(黑豆)[1],并新增含量测定项,要求本品按干燥品计算,含大豆苷元(daidzein,DAE)和染料木素(genistein,GEE)的总质量分数不得少于0.040%。淡豆豉的炮制过程中既存在大豆异黄酮(soybean isoflavone,SIF)苷类向苷元类的转化[2-3],也会发生苷元类物质的破坏[4]。新增含量测定项的目的在于以SIF类物质发酵终产物的含量评价淡豆豉的质量。历代医家均以“发透”作为淡豆豉的质量评价标准[5]。但《中国药典》2020 年版淡豆豉含量测定项标准较低,虽然能够有效区分淡豆豉的真伪[6],但不能有效区分“发不透(不及)”“发透(适中)”与“发过(太过)”的样品,尚不足以评价淡豆豉的优劣,需要进一步明确发酵过程中SIF 变化规律,为提高淡豆豉质量控制标准提供科学依据。
天然的SIF 包 括DAE、GEE、黄豆黄素(glycitein,GLE)3 种苷元及这3 种苷元各自的葡萄糖苷、乙酰基葡萄糖苷和丙二酰基葡萄糖苷[7]。SIF类物质最简便的定量方法为比色法,但辅料中的黄酮、香豆素等酚酸类成分会干扰比色法测定的结果。同时定量12个SIF的方法最为准确,但部分对照品不易得,导致该方法推广较困难[8]。因此,本研究采用紫外-可见分光光度法测定发酵原料中SIF 类物质含量;采用高效液相色谱法(HPLC)同时定量原料及不同发酵阶段样品中的9 个SIF,以丙二酰基大豆苷(malonyldaidzin,MDA)、丙二酰基染料木苷(malonylgenistin,MGE)、乙酰基黄豆黄苷(acetylglycitin,AGL)为丙二酰基和乙酰基葡萄糖苷的代表,探究SIF 类物质在淡豆豉制备过程中的变化规律,为优化淡豆豉制备工艺、提升其质量控制水平提供参考。
1 材料
HWS-150B 型恒温恒湿箱(天津市泰斯特仪器有限公司);DFY-200C 型粉碎机(温岭市林大机械有限公司);DV215CD 型电子分析天平(奥豪斯仪器有限公司);KQ-500E型超声波清洗器(昆山市超声仪器有限公司);UV-2450 型紫外-可见分光光度计、LC-20A 型高效液相色谱仪(包含LC-20AT 泵、SIL-20A 型恒温自动进样器、CTO-20A 型柱温箱、SPD-M20A 型检测器、LC solution 型色谱工作站)均购于日本岛津公司。
对照品MDA(批号:PS010932,纯度>95.0%)、MGE(批号:PS010924,纯度>98.0%)均购自成都普思生物科技有限公司;AGL(批号:P20J9F66220,纯度>98.0%,上海源叶生物科技有限公司);大豆苷(daidzin,DAI,批号:11738-201302,纯度:91.3%,中国食品药品检定研究院);DAE、黄豆黄苷(glycitin,GLI)、染料木苷(genistin,GEI)、GEE(批号分别为G1514019、C1911183、F1827120、H1631055,纯度均≥98.0%,Aladdin 公司);GLE(批号:BCBP9034V,纯度≥98.0%,美国Sigma 公司);乙腈(色谱纯,美国Fisher 公司);甲醇、冰乙酸(分析纯,北京化工厂);娃哈哈纯净水。
雄黑豆、马料豆、青蒿、桑叶均购自河北省安国市百草康商贸有限公司,批号分别为20191113、20191113、20191120、20200215,经首都医科大学中医药学院王满元教授鉴定为正品。其中雄黑豆、马料豆均为豆科植物大豆Glycine max(L.)Merr.的干燥成熟种子,青蒿为菊科植物黄花蒿Artemisia annuaL.的干燥地上部分,桑叶为桑科植物桑Morus albaL.的干燥叶。
2 方法
2.1 淡豆豉的发酵炮制
参考《中国药典》2020 年版制法,并结合本课题组发酵经验制备淡豆豉:挑选出光滑饱满、无裂纹、不皱缩的马料豆,洗净。另取桑叶、青蒿各100 g,加入10 倍量水煎煮0.5 h,用8 层纱布滤过,药渣加6 倍量水再煎煮0.5 h,滤过,合并药液,浓缩至1 L。将煎液拌入净马料豆1000 g 中,浸泡10 h,俟吸尽后,置蒸具内隔水蒸2.5 h,闷0.5 h,取出,晾至40 ℃以下,转移到发酵容器内,用已晾凉的桑叶、青蒿药渣覆盖,在温度为(26±2)℃、湿度为80%的条件下培养4 d,取出,除去药渣,洗净,沥干多余水分,置于密闭容器中,放入(45±2)℃条件下培养15 d,取出,隔水蒸0.5 h,60 ℃烘干,即得。取不同炮制阶段的豆豉样品,见表1。

表1 不同炮制阶段豆豉样品信息
2.2 紫外-可见分光光度法测定原料黑豆中SIF含量
常用于制备淡豆豉的黑豆包括马料豆和雄黑豆[9]。以DAE、GLE、GEE 为对照品测定雄黑豆、马料豆中SIF总量。
2.2.1 对照品溶液制备 精密称取对照品DAI、GLI、GEI、GLE、GEI、GEE 适量,分别用80%甲醇配制成质量浓度为20 μg·mL-1的对照品母液。将DAE、GLE、GEE 对照品母液用80%甲醇依次稀释为质量浓度分别为2、4、6、8、10 μg·mL-1的系列对照品溶液。
2.2.2 供试品溶液制备 分别取雄黑豆、马料豆,粉碎,过40 目筛,精密称取0.2 g,加80%甲醇10 mL,超声提取1 h,滤过,取续滤液稀释10倍,即得供试品溶液。
2.2.3 检测波长的选择 以80%甲醇为空白溶液,在波长190~400 nm 下分别对DAI、DAE、GLI、GLE、GEI、GEE 对照品母液进行光谱扫描,确定各成分的最大吸收波长(λmax)。
2.2.4 标准曲线绘制及样品含量测定 以80%甲醇为空白溶液,分别在DAE、GLE、GEE 的λmax下测定系列对照品溶液及供试品溶液的吸光度(A)。以对照品溶液质量浓度为横坐标(X),A为纵坐标(Y)绘制标准曲线。将供试品溶液A值代入标准曲线,计算样品中异黄酮含量。
2.3 HPLC同时定量样品中9个SIF
2.3.1 样品质量校正 称量得到不同样品的平均粒质量(M),按照公式(1)~(2)计算样品相对于原料的质量损失及校正系数。

2.3.2 色谱条件 色谱柱:Agilent ZORBAX Eclipse XDB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为0.1%醋酸溶液(A)-乙腈(B),梯度洗脱(0~35 min,13.0%~23.5%B;35~45 min,23.5%~85.0%B;45~50 min,85.0%B;50~51 min,85.0%~13.0%B;51~60 min,13.0%B);流速:1.0 mL·min-1;柱温:35 ℃;进样量:10 μL;检测波长:254 nm;理论板数按DAE峰和GEE峰计算应不低于5000。
2.3.3 对照品溶液制备 分别精密称取对照品MDA、DAI、DAE、AGL、GLI、GLE、MGE、GEI、GEE 适量,加入对应量二甲基亚砜(DMSO)溶解成1 mg·mL-1的对照品溶液,用80% 甲醇配制为各组分质量浓度均为50 μg·mL-1的混合对照品母液,将混合对照品母液用80%甲醇倍比稀释为50.00、25.00、12.50、6.25、3.13、1.56、0.78、0.39、0.20 μg·mL-1的系列混合对照品溶液。
2.3.4 供试品溶液制备 取原料及制备过程中样品,粉碎,过40 目筛,精密称取0.2 g,加80%甲醇10 mL,超声提取1 h,用0.45 μm 有机系微孔滤膜滤过,滤液即为供试品溶液。
2.3.5 方法学考察
2.3.5.1 标准曲线及线性关系 按2.3.2 项下色谱条件测定系列混合对照品溶液,以对照品溶液质量浓度为横坐标(X),峰面积为纵坐标(Y)绘制标准曲线。
2.3.5.2 精密度试验 取S4 淡豆豉0.2 g,精密称定,按2.3.4 项下方法制备供试品溶液,连续进样6次,测定9个SIF含量,考察精密度。
2.3.5.3 重复性试验 取S4 淡豆豉0.2 g,精密称定,平行6 份,按2.3.4 项下方法制备供试品溶液,测定9个SIF峰面积,考察重复性。
2.3.5.4 稳定性试验 取S4 淡豆豉供试品溶液,分别于0、2、4、8、12、24 h进样,测定9个SIF峰面积,考察稳定性。
2.3.5.5 加样回收率试验 取6 份已知质量浓度的S4 样品,分别精密加入相当于各被测成分100%量的混合对照品,制备供试品溶液,进样检测,记录目标成分色谱峰的峰面积,计算加样回收率。
2.3.6 样品含量测定 按2.3.2 项下色谱条件测定供试品溶液,将供试品溶液中各组分的峰面积值分别代入标准曲线,计算样品中各成分含量。
3 结果
3.1 原料黑豆中SIF含量
3.1.1 检测波长的选择 经过光谱扫描,得到DAI、DAE、GLI、GLE、GEI、GEE 的λmax分别为248、249、256、257、259、259 nm。经比较分析发现,同一苷元结构的葡萄糖苷及苷元具有近似的λmax,故选择DAE、GLE、GEE 3 个苷元的λmax为吸收波长,分别以3个苷元为对照品进行定量。
3.1.2 3 个苷元的线性关系 如表2 所示,DAE、GLE、GEE 3 个对照品标准曲线回归方程的r≥0.999,表明在2~20 μg·mL-1的质量浓度范围内,三者线性关系良好。
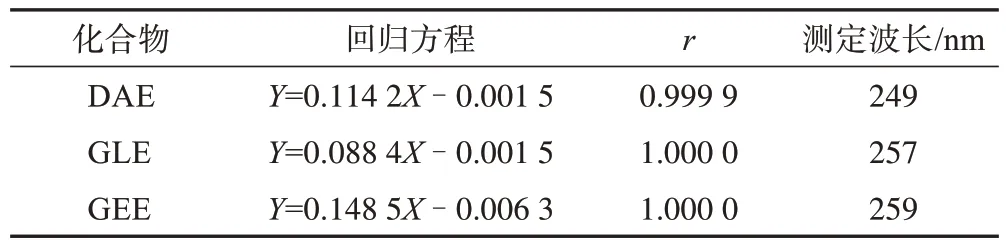
表2 DAE、GLE、GEE线性关系
3.1.3 不同原料中SIF 含量 不同苷元紫外吸收光谱存在一定差异,导致以不同苷元计算得到的同一样品中SIF 含量有差别。因此,以不同苷元计算得到的SIF 含量求均值,得到马料豆中SIF 质量分数为(3 244.41±925.57)μg·g-1[(11.96±2.82)μmol·g-1],雄黑豆中SIF 质量分数为(1 655.54±462.97)μg·g-1[(6.10±1.41)μmol·g-1]。由结果可知,马料豆中SIF 含量约为雄黑豆的2 倍,在发酵过程中异黄酮成分的变化会更明显,且马料豆籽粒较小而更易“发透”,便于研究淡豆豉发酵过程中异黄酮的变化规律,故选用马料豆为原料制备样品。
3.2 样品中9个SIF含量
3.2.1 样品质量校正 发酵过程样品的M见表3,在淡豆豉发酵过程中,随着发酵的进行,质量损失逐渐增多,导致相同数量的豆子在发酵后相较于原料质量下降。在进行定量测定时,若直接以称量的质量进行计算会出现所测成分含量虚高的现象,不能真实反映淡豆豉发酵过程中SIF 含量变化,故需以原料质量为标准,按公式(3)对样品进行质量校正。

表3 不同炮制阶段豆豉样品的粒质量、质量损失及校正系数(,n=3)

表3 不同炮制阶段豆豉样品的粒质量、质量损失及校正系数(,n=3)
3.2.2 方法学考察结果
3.2.2.1 系统适应性 混合对照品及样品的HPLC图如图1 所示,DAI、GLI、GE、MDA、MGE、AGL、DAE、GLE、GEE 的保留时间分别为11.952、13.424、20.602、21.743、31.133、32.079、37.051、40.563、43.801 min。该条件下系统适用性良好。
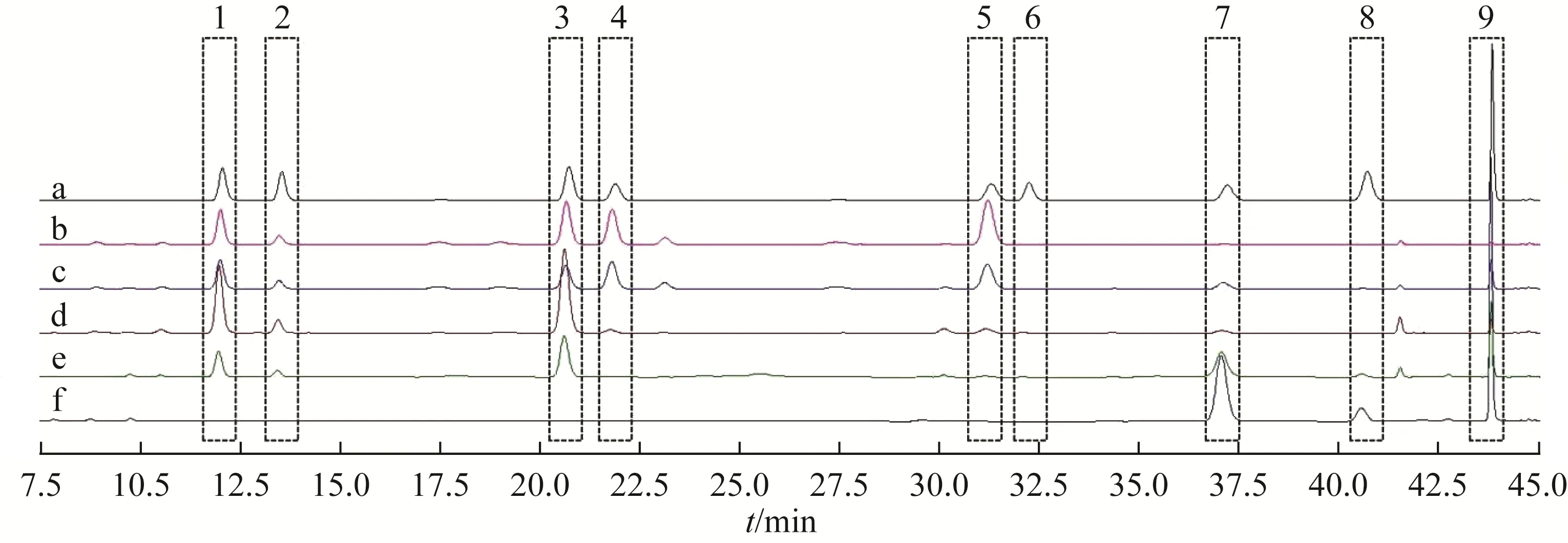
图1 SIF对照品及样品的HPLC图
3.2.2.2 标准曲线及线性关系 如表4 所示,所有对照品标准曲线回归方程的r≥0.999,表明在0.20~50.00 μg·mL-1对照品线性关系良好。

表4 SIF对照品的线性关系
3.2.2.3 精密度试验 DAI、GLI、GEI、MDA、MGE、AGL、DAE、GLE、GEE峰面积的RSD分别为0.52%、0.76%、0.65%、1.32%、1.01%、0.98%、0.62%、0.42%和0.13%,表明本方法精密度良好。
3.2.2.4 重复性试验 DAI、GLI、GEI、MDA、MGE、AGL、DAE、GLE、GEE 含量的RSD 分别为1.02%、0.88%、0.46%、1.11%、0.56%、0.92%、0.79%、0.47%和0.38%,表明本方法重复性良好。
3.2.2.5 稳定性试验 DAI、GLI、GEI、MDA、MGE、AGL、DAE、GLE、GEE峰面积的RSD分别为0.62%、0.42%、0.74%、0.79%、0.68%、0.75%、0.55%、0.64%和0.63%,表明供试品溶液在24 h内稳定性良好。
3.2.2.6 加样回收率试验 结果见表5,待测成分的加样回收率在96.72%~97.16%,RSD≤2.90%,表明该方法具有较高的回收率。

表5 淡豆豉中9个SIF的加样回收率

续表5
3.2.3 样品中各组分含量
马料豆(S0)中9个SIF总质量分数为(4 374.23±93.59)μg·g-1[(8.91±0.19)μmol·g-1],其中苷类占99.10%,苷元占0.90%(表6)。马料豆中SIF主要以丙二酰基葡萄糖苷、葡萄糖苷形式存在。经过浸泡的样品(S1)中苷类占86.82%,苷元占13.18%。经过隔水蒸的样品(S2)中苷类占95.71%,苷元占4.29%,SIF 主要以葡萄糖苷形式存在。前酵结束的样品(S3)中苷类占52.11%,苷元占47.89%,SIF主要以葡萄糖苷和苷元形式存在。后酵阶段,苷类含量持续降低,苷元含量持续升高,后酵7 d 的样品(S6)中检测不到苷类,SIF 仅以苷元形式存在。继续发酵,苷元含量持续减少,且GEE 减少最为显著。S6 中苷元含量达到峰值,为(1 940.2±29.12)μg·g-1,即(7.37±0.82)μmol·g-1,此时样品中的苷元总量相当于SIF 总量,相较于紫外-可见分光光度法测定所得马料豆中SIF 含量损失了约38%。S6 中DAE 和GEE 总量在进行质量校正前为0.226%,远高于《中国药典》2020 年版规定标准。
表6 样品中9种SIF质量分数(,n=3) μg·g-1

表6 样品中9种SIF质量分数(,n=3) μg·g-1
注:-表示未检测到。
4 讨论
《本草纲目》记载:“豉,诸大豆皆可为之,以黑豆者入药”[10]。现代研究证明,黑豆相比于黄豆、红豆、绿豆、白芸豆更适合作为淡豆豉的发酵原料[11-12]。本研究结果显示,马料豆中异黄酮含量高于雄黑豆,与文献研究结果一致[13]。同时,马料豆的籽粒较小而更易“发透”,有利于缩短淡豆豉的发酵周期,便于厂家组织生产,有助于改善淡豆豉发酵周期长、市售淡豆豉质量普遍偏低的现状。
原料马料豆中SIF 主要以糖苷形式存在,其中以丙二酰基葡萄糖苷、葡萄糖苷含量较高。在淡豆豉的发酵过程中,苷类向苷元转化,具体表现为样品中的丙二酰基葡萄糖苷持续减少;乙酰基葡萄糖苷、葡萄糖苷作为转化的中间形式,其含量在前处理阶段波动、在前酵及后酵阶段下降;发酵产物苷元整体呈波动上升趋势,最终含量可达(7.37±0.82)μmol·g-1,约为马料豆中苷元含量的92 倍。从发酵阶段分析,前处理过程中主要发生丙二酰基葡萄糖苷向乙酰基葡萄糖苷和葡萄糖苷的转化,经过前处理的样品中SIF 主要以葡萄糖苷形式存在。前酵阶段微生物大量繁殖,代谢产生的β-葡萄糖苷酶可使苷类大量转化为苷元[14],前酵结束时,样品中苷类和苷元接近1∶1。后酵阶段苷类继续转化为苷元,后酵7 d 的样品中无法检测到SIF 苷类,提示此时样品中的苷类已最大程度地转化为苷元,样品达到了“发透”的水平。此时样品中SIF 绝大部分以苷元形式存在,且DAE∶GLE∶GEE≈6∶1∶5。继续发酵,样品中的苷元含量逐渐降低,且GEE 降低最为明显。以上结果表明,发酵时间不足,样品中的苷类尚未最大程度转化为苷元,表现为“不及”;发酵时间过长,会导致苷元进一步损失,出现“发过”的情况。《中国药典》2020 年版中淡豆豉制法项下明确“置容器内再闷15~20 天”,本研究发现以马料豆为原料时,该工艺存在“发过”的风险。提示《中国药典》2020 年版中淡豆豉制法可结合原料种类及发酵原理进一步优化,以便厂家进行生产,进而提高市场淡豆豉质量。
前处理结束、前酵结束、后酵第七天时,样品中DAE 和GEE 的总量分别为0.009%、0.101%、0.226%。对比《中国药典》2020年版标准可知,现行标准可筛除未经发酵的产品,区分豆和豉,但不能区分淡豆豉的发酵程度和质量优劣。提示《中国药典》2020 年版标准可结合淡豆豉发酵过程中异黄酮变化规律进一步完善,如控制DAE 和GEE 总量>0.100%,可筛除市场中的大部分劣豉,同时促进厂家优化发酵工艺,提升市场淡豆豉质量。
本研究阐明了淡豆豉发酵过程中异黄酮的变化规律,为优化淡豆豉制法和完善其质量标准提供参考。
