细胞外钙水平对奶牛中性粒细胞内钙影响特征研究
2021-12-01张冰冰张伟郭寒李明洋李小曼李享杨威余丽芸徐闯
张冰冰,张伟,郭寒,李明洋,李小曼,李享,杨威,余丽芸,徐闯
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.黑龙江八一农垦大学动物科技学院)
奶牛低钙血症是围产期高产奶牛高发的一种以钙稳态失衡为主的疾病。数据显示,发达国家规模化牧场围产期奶牛低钙血症发病率达到50%以上,其中临床型低钙血症的发病率接近5%[1-3]。据统计,黑龙江省规模化牛场围产期奶牛临床型低钙血症发病率为2%~5%,而亚临床低钙血症在分娩后12~24 h内的发病率高达80%,产后3~14 d内发病率为30%~45%[4]。奶牛低钙血症影响奶牛胃肠及子宫平滑肌收缩,增加产后奶牛真胃变位、酮病、胎衣不下和繁殖障碍等疾病的发生概率[5]。此外,奶牛低钙血症导致子宫内膜炎、乳房炎等细菌感染引起的疾病高发[6-7],给奶牛的健康和畜牧业经济持续发展产生严重影响。在生理上,奶牛子宫腔内细菌在产后前两周将持续存在,很可能导致器官功能的损害,然而低钙血症奶牛显著增加了子宫内膜炎的发生[8]。
低钙血症奶牛血浆皮质醇浓度升高,中性粒细胞吞噬活性比例降低,以及单核细胞对抗原激活刺激的反应受损[6]。有研究显示,在产后头3 d,血钙<2.15 mmol·L-1的奶牛的总循环中性粒细胞数、中性粒细胞吞噬能力和中性粒细胞氧化爆裂能力均降低[9]。面对每日暴露于单细胞病原体的环境,多细胞生物严重依赖先天免疫系统作为对入侵者的第一反应。中性粒细胞是先天免疫系统的终末分化细胞成分,约占外周白细胞总数的35%~75%。中性粒细胞作为机体第一道防线在感染初期的防御中起着重要作用,其杀灭病原体的方式主要包括迁移,吞噬,黏附,脱颗粒作用等。
Ca2+是机体各项生理活动中不可缺少的离子。在细胞内,Ca2+开启(或关闭)需要大量的效应因子,这些效应因子控制着关键的生物过程,如胞外作用(包括神经递质释放和分泌)、肌肉收缩、受精、酶活性(例如,凝血级联反应)和对抗原的免疫反应[10]。Ca2+也是多种细胞表面受体的细胞内信号转导的第二信使,参与细胞的能量代谢、增殖以及凋亡等病理生理过程[11]。钙离子释放激活的钙通道蛋白(ORAI1)是一个33 kDa的蛋白,包含4个跨膜结构域(TM),n端和c端均位于胞质中。它是一种位于质膜中的高度Ca2+选择性离子通道,介导“存储操作”Ca2+信号。这些信号在调节关键的细胞反应中起着至关重要的作用,包括基因表达、生长、分泌和运动。ORAI1通道在质膜(PM)中起作用,但通过STIM1蛋白介导的ER和PM之间的动态膜间耦合过程被激活[12]。STIM1感知ER上Ca2+含量,Ca2+耗竭时形成斑块状结构结合PM上的ORAI1,触发Ca2+依赖的基因转录、T细胞激活或肥大细胞脱颗粒[13]。实验拟利用含不同浓度钙离子培养基培养细胞,旨在研究低钙条件下对中性粒细胞内钙的影响,为奶牛低钙血症对中性粒细胞免疫功能影响研究提供基础数据。
1 材料和方法
1.1 实验动物
从黑龙江省大庆市某集约化奶牛场筛选体况(3分,总分为5分)及胎次(2~4胎)相近的分娩后3 d内的奶牛,从奶牛尾静脉采血,肝素抗凝,分离血浆利用钙测定试剂盒测定血钙浓度后将它们分为两组:健康对照组和低钙血症实验组,每组各3头。
1.2 主要试剂仪器
主要试剂:牛外周血中性粒细胞分离试剂盒,改良台式液均购自北京索莱宝科技有限公司;RPMI-1640培养液,PBS缓冲液购自Hyclone公司;钙测定试剂盒购自美国爱德士公司;ORAI1抗体购自美国proteintech公司;HRP标记的山羊抗兔IgG,Fluo-3AM均购自上海碧云天生物技术有限公司。
主要仪器:FACSCalibvr型流式细胞仪购自美国BD公司;CO2培养箱购自德国BINDER公司;DT5-2B型低速台式离心机,购自北京时代北利离心机有限公司;低速离心机,购自湖南湘仪离心机仪器有限公司;生化分析仪,购自美国爱德士公司。
1.3 实验方法
1.3.1 奶牛血钙浓度测定
选择清晨喂料前,固定奶牛后通过牛尾静脉采血5 mL收集在肝素抗凝管内,室温静置冷却后,经3 000 rpm离心15 min,分离血浆,通过自动生化分析仪进行奶牛血钙浓度的检测根据所检测的血钙浓度将奶牛分为两组,一组为健康对照组,一组为低钙血症组。
1.3.2 奶牛血液中性粒细胞的分离
采用牛中性粒细胞分离试剂盒,根据该试剂盒说明书分离健康奶牛和低钙血症奶牛血液中性粒细胞。简单概述为经分离液分离,经水平离心后收集细胞沉淀,用红细胞裂解液裂解红细胞,经三次洗涤后即为中性粒细胞。
1.3.3 流式细胞术检测细胞表面ORAI1蛋白丰度
为了分析钙离子对围产期奶牛血液中性粒细胞表面ORAI1蛋白的影响,实验将收集到的中性粒细胞按照细胞密度为5×105个·mL-1,经改良台氏液重悬后,加入ORAI1抗体室温孵育40 min后离心弃上清,经改良台式液洗涤2次,再加入HRP标记的山羊抗兔IgG避光孵育30 min后,经1 500 rpm离心5 min,加改良台氏液清洗2次后,利用流式细胞仪检测奶牛血液中性粒细胞的荧光强度,分析表面ORAI1蛋白蛋白的表达量。
1.3.4 细胞内钙离子的检测
为了检测中性粒细胞细胞内钙离子浓度,实验将所分离到的中性粒细胞按照5×105个·mL-1密度进行调整,经染色液37℃孵育30 min进行荧光探针装载,1 500 rpm离心5 min后经台式液清洗,清洗后再孵育10 min,从而确保Fluo-3AM在细胞内完全转变成Fluo-3后,经流式细胞仪检测荧光强度。染色液配置为:浓度为0.5μm·L-1的Fluo-3AM的溶液和台氏液1∶1 000配置成染色液备用。
1.3.5 在不同浓度钙的条件下培养中性粒细胞
将1.3.2步骤所述分离出的健康对照组的中性粒细胞分成四组,每组分别用加入0.2、0.6、1 mmol·L-1氯化钙以及PBS的RPMI-1640培养液培养,经37℃,5%CO2培养箱分别培养12、18 h,根据1.3.3、1.3.4步骤通过流式细胞仪检测中性粒细胞表面ORAI1蛋白丰度和细胞内钙离子浓度的荧光强度。
1.3.6 统计学分析
实验中所有数据均利用生物统计学方法经独立样本t检验进行数据分析,数据以“平均值±标准误差”表示。同行数据后所标*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结果与分析
2.1 血液中钙浓度检测
由表1可知,健康对照组奶牛的血钙浓度极显著高于低钙血症实验组奶牛。

表1 健康组奶牛和低钙血症组奶牛血钙浓度比较Table 1 Blood calcium of healthy cows and hypocalcemia cows
2.2 中性粒细胞膜表面ORAI1蛋白丰度的检测
经流式细胞仪检测结果显示,健康对照组奶牛中性细胞ORAI1蛋白丰度极显著高于低钙血症奶牛实验组(P<0.01),如图1所示。
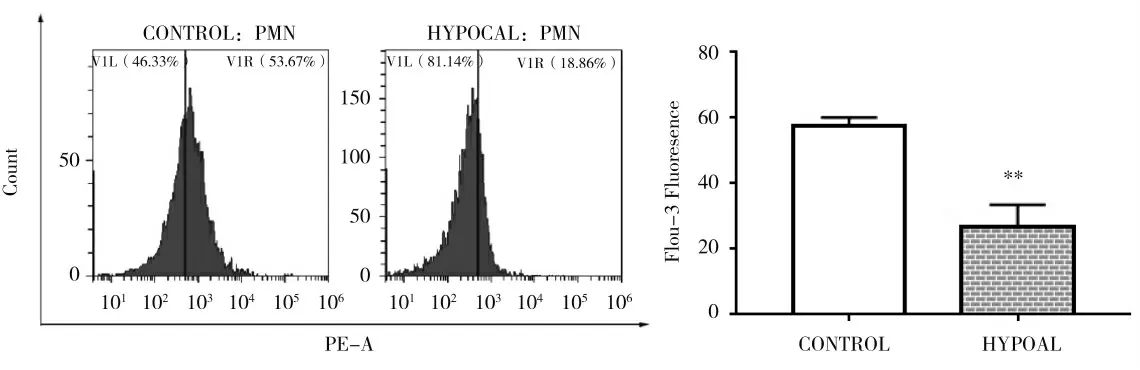
图1 健康对照组和低钙血症实验组中性粒细胞膜表面ORAI1蛋白丰度Fig.1 The abundance of ORAI1 protein on the surface of neutrophil membrane in healthy cows and hypocalcemia cows
2.3 中性粒细胞内钙离子检测
如图2所示,经流式细胞术结果表明健康对照组奶牛血液中性粒细胞细胞内钙离子浓度显著高于低钙血症实验组(P<0.05)。

图2 健康对照组和低钙血症实验组细胞内钙离子浓度Fig.2 Changes in calcium in neutrophil of healthy dairy cows and hypocalcemia dairy cows
2.4 不同浓度氯化钙刺激下12,18 h后ORAI1变化
为探究体外钙离子浓度对于奶牛中性粒细胞表面ORAI1蛋白的影响,研究利用不同浓度氯化钙刺激健康奶牛中性粒细胞,检测表面ORAI1蛋白丰度,我们分别检测12、18 h后不同浓度氯化钙刺激下PMN膜表面ORAI1蛋白丰度变化并分析,结果表明,不同浓度氯化钙刺激下12 h后,对照组中性粒细胞表面ORAI1蛋白丰度显著低于0.2 mmol·L-1和0.6 mmol·L-1实验组(P<0.05),极显著低于1 mmol·L-1实验组(P<0.01),图3所示。
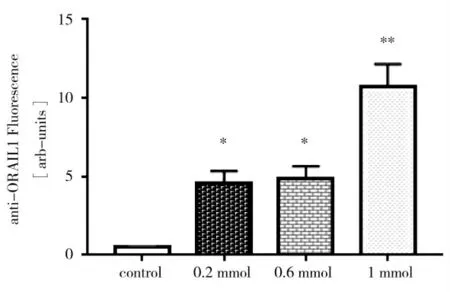
图3 不同浓度氯化钙刺激下12 h后ORAI1变化Fig.3 Effectof differentdoseof CaCl2 on ORAIproteinabundance in neutrophils of healthy dairy cows treated 12 h
图4表明不同浓度氯化钙刺激下18 h后,对照组中性粒细胞表面ORAI1蛋白丰度极显著低于0.02 mmol·L-1和0.6 mmol·L-1实验组(P<0.01)。
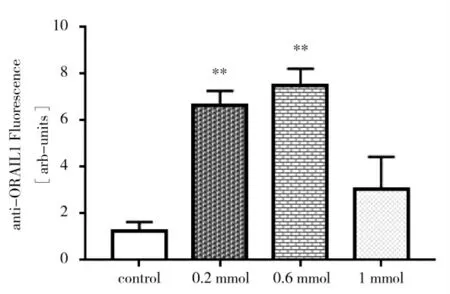
图4 不同浓度氯化钙刺激下18 h后ORAI1变化Fig.4 Effectof differentdoseof CaCl2 on ORAIprotein abundance in neutrophils of healthy dairy cows treated 18 h
2.5 不同浓度氯化钙刺激下12,18 h细胞内钙变化
为探究不同浓度氯化钙刺激奶牛中性粒细胞细胞内钙的变化,分离健康奶牛中性粒细胞,分别经0.2、0.6 mmol·L-1和1 mmol·L-1氯化钙刺激12、18 h,利用流式细胞术检测中性粒细胞细胞内钙离子荧光强度,结果表面,0.2、0.6 mmol·L-1和1 mmol·L-1氯化钙刺激12 h后中性粒细胞细胞内钙离子浓度显著高于正常对照组(P<0.05)。

图5 不同浓度氯化钙刺激下12 h后细胞内钙离子变化Fig.5 Effect of different dose of CaCl2 on intracellular Ca2+in neutrophils of healthy dairy cows treated 12 h
3 讨论
奶牛低钙血症是围产期奶牛高发的以钙稳态失衡为主的疾病,使奶牛钙依赖性肌肉平滑肌和骨骼肌机能受损,显著增加真胃变位、酮病、胎衣不下的发生[14]。研究发现,泌乳初期奶牛低钙血症与血液中白细胞活性低下有关,导致其对异物吞噬能力降低,从而增加了子宫内膜炎及乳房炎等炎性疾病的发生,给奶牛业带来了巨大的经济损失[15]。

图6 不同浓度氯化钙刺激下18 h后细胞内钙离子变化Fig.6 Effect of different dose of CaCl2 on intracellular Ca2+in neutrophils of healthy dairy cows treated 18 h
中性粒细胞是天然免疫系统中重要的组成成分,同时也是渗入受攻击组织的第一个白细胞,通过趋化因子的梯度渐变,招募血液中的中性粒细胞到达感染部位[16]。因此,中性粒细胞是抵抗病原微生物感染的主要防御细胞之一。
游离钙离子作为细胞内的一种主要第二信使参与细胞多种生理活动以及免疫功能的调节。在正常情况下,细胞外液、细胞液及内质网上的钙离子浓度差分别维持在1.5、50和400μM·L-1。这个稳态的维持依靠的是细胞膜和细胞器上的钙泵和直接转运体的相互作用。钙离子的主动转运紧密地控制着细胞内钙离子的浓度,从而使钙离子从细胞外流入可以引发细胞内信号,从而导致功能性反应[17]。在静息细胞中,细胞内钙的大部分位于ER内,这通常称为“钙库”。胞浆钙水平通过几个钙泵维持在相对较低的水平,包括分别将钙送到细胞外和ER空间的质膜和SERCA[18]。在包括免疫细胞(如中性粒细胞)在内的非兴奋性细胞中,SOCE是响应细胞刺激钙进入的主要机制。细胞表面受体的参与启动了信号传导级联反应,导致磷脂酶家族成员的磷酸化。磷脂酶将膜脂质磷脂酰肌醇4,5-二磷酸酯(PIP2)转化为甘油二酯(DAG)和三磷酸肌醇(IP3),其与内质网受体结合并从内质网中释放钙。钙从ER流出后,第二次长时间钙离子流过质膜。这种持续的钙进入激活了许多钙依赖性信号分子和转录因子,这些信号和转录因子调节了关键的免疫效应器功能,包括脱颗粒,细胞因子产生,细胞极化和增殖[19-20]。
在实验中,流式细胞仪检测健康对照组ORAI1蛋白表面丰度明显高于低钙血症实验组,呈现出极显著差异,说明患低钙血症奶牛ORAI1蛋白表面丰度降低。流式细胞仪检测健康对照组PMN内钙离子浓度明显高于低钙血症实验组,呈现出显著差异。这些结果表明奶牛发生低钙血症时PMN表面ORAI1丰度降低,影响奶牛血液中性粒细胞Ca2+进入细胞内,进而影响细胞内钙离子浓度。
为了进一步探究细胞外钙水平对PMN内钙的影响,我们在体外用不同浓度的氯化钙培养PMN并检测其表面ORAI1丰度及细胞内钙离子浓度。由结果可以看出,当细胞外钙离子浓度升高时,培养12 h后PMN表面ORAI1蛋白表面丰度和细胞内钙离子浓度也显著/极显著升高。这些结果说明当奶牛中性粒细胞外钙水平升高时,中性粒细胞膜上ORAI1蛋白丰度升高,中性粒细胞内钙离子进入调控水平也就升高,进而中性粒细胞内Ca2+浓度升高。但为何1 mmol·L-1氯化钙培养18 h后PMN表面ORAI1丰度比12 h时低,仍需进一步探究。
4 结论
细胞外液中的低钙水平可显著降低中性粒细胞内钙离子浓度以及ORAI1蛋白丰度的表达。
