基于微型化双光子荧光显微镜的自由活动小鼠脊髓成像方法
2021-11-30矣文玲巨富荣王立平蔚鹏飞
矣文玲 巨富荣 王立平 蔚鹏飞
1(中国科学院深圳先进技术研究院 深圳 518055)
2(中国科学院大学 北京 100049)
1 引 言
脊髓是中枢神经系统的重要组成结构之一。脊髓作为连接大脑与周围神经系统的桥梁,传送脑与外周之间的神经信息以协调生命体正常活动,在躯体感觉和运动过程中发挥重要作用[1-2]。近年来,微型化显微成像技术的发展,将光学显微成像技术与钙离子成像技术相结合,实现了在无束缚环境中对自由活动的动物大脑进行高空间分辨率(μm)和高时间分辨率(ms)的神经活动图像采集,且能容忍微米级的组织运动[3-4]。微型化活体成像方法的应用使脑成像领域的相关研究取得了突破性进展,但中枢神经系统的另一关键结构——脊髓的活体成像研究仍难以实现。这是因为小鼠自身呼吸、心跳以及运动引起的脊髓组织无规则运动范围较大,导致脊髓成像时对脊髓组织固定困难。加之双光子显微镜成像速度和光学薄片有限,导致小鼠在体脊髓成像时出现焦面漂移、图像扭曲或丢失[1,5]等问题。目前,已报道的关于脊髓光学成像的研究对象多为麻醉动物,鲜有清醒的自由活动状态的动物[2,6]。所以脊髓这一重要的神经结构在真实环境下如何编码大脑下行指令和外周输入信号尚不清楚[7-8]。
建立一套在自由活动状态下的动物活体脊髓成像方法,是进一步探索脊髓在神经系统中重要功能的关键途径之一。目前,自由活动状态下的动物活体脊髓成像仍止步于单光子显微成像[6]。相较而言,双光子显微成像不仅解决了标记密集的组织中信号密集导致无法分辨甚至无法聚焦等问题,显著提高了图像比度和在生物体组织内的穿透深度,而且能够实现亚细胞的形态结构高清晰成像。2017 年,程和平团队自主研发的微型化双光子荧光显微镜打破了仪器对动物成像研究的限制,能够在动物自由活动过程中实现快速的组织或细胞双光子活体成像[9]。目前,高分辨率微型化双光子荧光显微镜的应用,使国内外自由活动的动物在体成像领域的相关研究取得了突破性进展[9-12],也为实现在小鼠自由活动状态下的脊髓双光子成像带来了契机。突破脊髓活体成像的技术壁垒,建立自由活动的动物脊髓双光子成像的技术方法,对推动脊髓功能神经网络的研究具有重要意义。
脊髓结构的特异性带来的诸多问题,是实现自由活动的动物脊髓成像的一大阻碍。其中,脊髓结构复杂[1,13]、脊髓组织运动幅度较大且不规则、长期成像不稳定以及微型化显微镜稳定植入困难等[14],导致脊髓活体成像研究面临一系列挑战。本文研究基于微型化双光子荧光显微镜,建立一套适用于自由活动状态下小鼠的脊髓成像技术方法,以实现无束缚环境中自由活动的动物脊髓双光子成像。通过采用特定的脊髓固定零件以及固定方法,对无束缚环境中自由活动的动物脊髓前动脉血管进行长期成像,评估该方法是否能够解决目前脊髓活体成像所面临的问题——组织位移导致的成像抖动、微型化显微镜固定困难导致的成像不稳定等。此外,利用这一方法初步探究躯体感觉和运动过程中,脊髓的背角神经细胞活动对躯体感觉和运动信息的编码。基于微型化双光子荧光显微镜,建立小鼠自由活动状态下脊髓活体成像的技术方法,有望帮助理解自然行为下脊髓神经元的活动模式和进一步探究脊髓的病理变化原因。
2 材料和方法
2.1 动物
本文研究中所用动物的饲养条件和实验方案经中国科学院深圳先进技术研究院动物伦理委员会审查通过(编号:SIAT-IRB-181026-NS-WLP-A0540)。实验选用年龄为 8~13 周的C57BL/6J 雄鼠(浙江维通利华实验动物技术有限公司)。其中,脊髓血管成像实验使用 6 只小鼠,神经元钙信号采集实验使用 4 只小鼠。动物饲养于无特定病原体的屏障环境中,照明周期为12 h 光照/12 h 黑暗,饲养温度为 20~26 ℃。术后单笼饲养 3 天至基本恢复后,放回群居饲养笼中正常饲养。
2.2 脊髓手术
首先建立一种将微型化双光子显微镜植入脊髓的方法,在小鼠自由活动的过程中和接受不同外界刺激时,对脊髓前动脉血管和神经元钙信号变化进行成像观察。手术操作步骤大致如下:
(1)脊髓固定。首先,对小鼠进行称重,采用异氟烷将小鼠深度麻醉,并剔除小鼠背部毛发。然后,沿着脊柱正中央剪开皮肤,采用眼科剪将脊柱紧贴腰段 3~6 节段的两侧肌肉剪开;将小鼠脊椎骨暴露后,尽可能剥离脊椎骨之间的肌肉组织,暴露出完整的脊柱。接下来,借助定制的脊髓固定装置将脊髓固定零件——V 型槽(图 1(a))稳定嵌入椎骨两侧以固定脊髓:调整左右两侧 V 型槽的距离,将腰段 3~5 节段固定后,调整横突位置使完整的横突置于两侧 V 型槽中,微调并固定 V 型槽直至基本消除椎骨的抖动;使用无菌生理盐水冲洗创面至无明显渗血后,用适量的双氧水处理骨头表面至表面剩余肌肉组织萎缩;再次使用无菌生理盐水冲洗至脊椎骨表面无残余组织碎屑后,缝合头尾 V 型槽两侧多余剪开的皮肤。最后,采用压缩空气瓶吹干脊椎骨表面以及两侧缝合皮肤表面的生理盐水,涂抹 3M 组织胶水以封闭手术创口周围皮肤和肌肉,并用无尘纸吸附多余的 3M 组织胶水。
(2)脊髓暴露和 V 型槽植入。采用颅骨钻打磨选定目标成像节段的椎板,将其磨薄至约25~30 μm 后,轻轻掀开部分脊椎板,以暴露中央前动脉血管和周围脊髓白质;清理干净脊髓表面,随后采用玻璃盖玻片隔绝暴露的脊髓组织和空气,并用牙科水泥辅助密封;同时,使用牙科水泥将已调整好位置的 V 型槽稳定地黏附于椎骨两侧,待牙科水泥干透,完成脊髓创口密封和 V型槽植入后缝合周围皮肤,涂抹适量碘伏消毒。
手术前将手术器械和零件进行高压灭菌处理。手术过程中使用异氟烷维持麻醉状态,同时保持脊髓暴露位置表面湿润,并采用生理盐水反复冲洗暴露位置,防止病菌感染。术后连续 6 d进行消炎和镇痛处理。其中,消炎采用兽用青霉素(剂量:0.03 g/kg),腹腔注射,每天 1 次;镇痛采用盐酸曲马多(剂量:0.3 mL/kg),手术当天及术后 2 d 进行腹腔注射,每天 1 次。饲养 30 d后进行活体成像,其中术后第 1 周尽量单笼饲养以避免小鼠打斗影响手术效果。
2.3 活体内双光子荧光显微成像
采用成像视野为 420 μm×420 μm 的大视场微型化双光子荧光显微镜,在自由活动的小鼠中进行脊髓前动脉血管成像,以评估无束缚条件下脊髓血管活体成像的图像稳定性与图像清晰程度。此外,对不同运动状态下自由活动的小鼠的脊髓背角神经元钙信号活动进行成像记录,初步分析小鼠在运动过程中脊髓如何编码简单的运动和感觉信息。
小鼠术后恢复 30 d,将其清醒固定,通过眼窝窦注射 20 μL 浓度为 10 mg/mL 的 FITC-dextran标记血管。采用微型化双光子显微成像系统对FITC-dextran 标记的脊髓前动脉血管进行成像位点定位后,在脊髓相应位置放置成像套件,并将其和小鼠背部的 V 型槽进行稳定黏附以固定成像窗口(图 1(b));在确定具体成像区域后,将重量仅 2.8 g 的大视场微型化双光子显微镜镜头用螺丝固定在成像套件中(图 1(c)),对脊髓内同一血管结构进行观察和图像采集。直至所有成像测试结束后取下成像套件进行回收。
脊髓前动脉血管长期成像实验中,以植入成像套件当天为起始记录日期(Day 1),每天成像前将微型化双光子显微镜镜头重新放入已经固定好的成像套件中。脊髓背角神经元钙信号记录实验中,将携带遗传编码钙离子指示蛋白基因序列片段GCaMP6s的重组腺病毒注射到脊髓中对脊髓神经元进行标记。待病毒表达和手术恢复 30 d后,同样采用上述方法对脊髓神经元钙信号活动进行成像。
2.4 行为学测试
测试前半小时将小鼠放入行为学测试房间中以适应测试环境,测试均在直径 50 cm×高 50 cm的圆形旷场中进行。其中,每项行为学测试前均让小鼠先适应旷场环境 1~2 min;所有血管图像和行为学视频均为同步记录。
自由活动:将脊髓已植入大视场微型化双光子荧光显微镜探头的小鼠放入圆形旷场中,同时记录小鼠运动状态和脊髓成像共 5 min 用于数据分析。
气流处理:采用压缩空气对小鼠进行急性气流刺激。在气流处理前同时记录小鼠自由活动行为状态和脊髓前动脉血管图像;采用压缩空气气流处理 10 s,该时间段内给小鼠 1~3 次气流处理,每次持续 1~2 s,以小鼠出现瞬时速度变化为气流刺激成功标志;在气流处理后同样记录小鼠运动视频和血管图像。以气流处理的 10 s 时间窗为中点,截取气流处理前-中-后各 10 s,连续 30 s的行为学视频和对应的同步血管图像用于分析。
夹尾处理:用定制的夹子(P=340 g)[15]夹住小鼠尾巴根部持续 10 s。以夹尾处理的 10 s 时间窗为中点,截取夹尾处理前-中-后各 10 s,连续30 s 的行为学视频和对应的同步血管图像作为分析对象。
2.5 病毒标记
按照“2.2 脊髓手术”中的操作暴露脊髓上表面后,首先采用灭菌的生理盐水清理干净脊髓表面;接下来,借助微量病毒注射泵进行病毒注射,以中央动脉血管为坐标零点,将注射位点调整至距中央前动脉血管左侧 300~400 μm(灰质区间)、深度 250 μm,在 20 min 内缓缓推入 300 nL AAV9-CaMKIIα-GCaMP6s 病毒[16];最后,采用玻璃盖玻片以及牙科水泥密封暴露的脊髓,并缝合周围皮肤,待病毒表达 21 d 后进行活体成像。
2.6 数据处理
图像位移统计:基于同步记录的行为学视频,选取目标时间段内的血管图像,采用 ImageJ对图像进行分析。具体步骤如下:(1)采用“Image”→“Z-projector”→“Average intensity”,获取目标时间段内连续图像的平均投影;(2)将不同时间的图像采用“Image”→“Merge Channels”进行处理,并对不同时间段的图像进行标记和重叠,通过测量图像中血管同一位置之间的距离,评估不同时段内图像间位移。在比较不同时段内图像间位移时,对头尾轴和左右轴分别选取 8 个血管位点进行位移统计,并分别取平均值作为目标图像之间的头尾轴图像位移和左右轴图像位移。其中,在自由活动状态下的血管图像位移,则选取整个分析时段内前 20 张血管图像与剩余图像进行对比,来估算活动期间血管图像的位移情况。
钙成像数据分析:采用大视场微型化双光子显微镜对脊髓背角神经元进行成像,激发光波长为 920 nm。成像视野:420 μm×420 μm;成像XY像素:512×512;采集帧率:4.84 Hz,单向扫描。收集钙成像图像后,采用 ImageJ 软件对单个神经元钙信号进行分析。具体步骤如下:首先,采用“Plugin”→“Process”→“Running z-projector”对图像进行预处理,随后采用插件“Plot z-axis profile”分析选定细胞的荧光变化强度,分析后收集脊髓背角神经元钙活动变化规律。荧光信号变化计算公式为 ΔF/F0=(F-F0)/F0×100%,其中F0指目标行为事件发生前 10 s时间窗内的平均荧光信号基线。
行为学数据分析:小鼠行为学视频片段使用Anymaze 动物行为学分析软件和 Matlab 进行分析。提取分析的时段内小鼠运动距离以及运动速度作为运动能力评估指标。
2.7 统计与分析
使用 GraphPad Prism 或 Microsoft Excel 软件对数据进行绘图。所有的数据分析均在 GraphPad Prism9.0 中完成,图中均表示为平均值±标准误差。长期成像的图像位移比较采用双因素方差分析,运动能力评估采用单因素方差分析,其余实验结果采用非配对 t 检验。其中,统计显著性表示为:*P<0.05,**P<0.01,***P<0.001,“ns”表示无显著性差异。
3 实验结果
3.1 自由活动的小鼠脊髓前动脉血管的双光子成像
在小鼠背部脊髓植入大视场微型化双光子荧光显微镜探头,对自由活动小鼠的脊髓浅层组织进行成像,同步采集圆形旷场中小鼠实时行为学视频和血管图像(图 1(d))。其中,脊髓固定装置的设计,是实现微型化双光子显微镜植入脊髓中的前提。借助定制的脊髓固定装置(图 1(a)),通过手术将小鼠脊髓暴露并将目标成像区与 V 型槽相对固定。为评估该方法应用于自由活动的小鼠脊髓成像时的稳定性以及图像质量,本文将脊髓中央最为明显的前动脉血管作为成像目标,采用FITC-dextran 标记之后进行实时脊髓血管图像和行为学视频同步采集。
截取 30 s 自由活动的小鼠行为视频进行分析,对运动速度的变化进行可视化(图 1(e)),并对不同速度状态对应的血管成像进行观察(图 1(f))。实验结果发现:在小鼠运动前、减速运动、最大瞬时速度运动、加速运动 4 个运动区间的代表性位置点对应的血管图像在小鼠身体头-尾方向(头尾轴)和水平方向(左右轴)均无明显位移且图像清晰(图 1(e))。上述结果表明,应用微型化双光子显微镜结合脊髓固定装置(图 1(a))、脊髓手术,可实现对自由活动的小鼠脊髓前动脉血管的稳定成像。
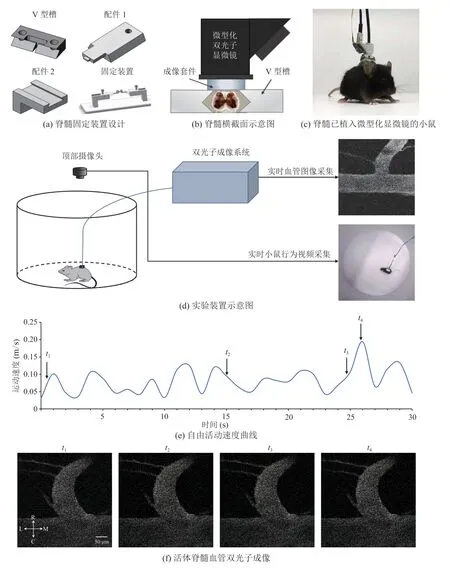
图1 自由活动的小鼠脊髓前动脉血管双光子成像Fig.1 Fluorescence imaging of the anterior spinal artery vessels in freely behaving mice
3.2 不同行为状态下的脊髓前动脉血管双光子成像评估
在正常的运动下,本研究实现了活体脊髓血管的清晰、稳定成像,但一些剧烈运动往往伴随较大幅度的脊髓无规则运动,可能导致成像目标剧烈晃动而干扰成像质量。为进一步对不同运动状态下活体内脊髓成像质量进行评估,以检验该成像方法结合不同行为学应用的有效性,本研究对小鼠的活动状态进行干预。通过对自由活动的小鼠施加外界刺激使其运动更加剧烈和运动表现多样化(图 2),从而实现在不同条件下的脊髓血管图像采集。此外,为量化成像过程中的图像质量,对小鼠身体头-尾方向(头尾轴),水平方向(左右轴)的血管图像位移进行对比和分析。
通过给自由活动的小鼠尾巴根部突然施加1~2 s 气流,诱发小鼠自发运动速度短时间内发生明显变化(图 2(a))。选取 4 个运动区间(运动前、加速运动、最大瞬时速度运动以及减速运动)的代表性位置点对应的血管图像进行观察比较,发现脊髓血管清晰,图像无明显晃动和内容丢失(图 2(b))。同时量化结果显示,气流处理前-中和前-后,头尾轴和左右轴的图像位移均无显著差异,说明气流刺激使血管图像产生了一定的位移。其中,头尾轴图像位移<18 μm、左右轴图像位移<5 μm,位移范围较小且在图像可校正范围内(图 2(c~d))。
采用夹子对自由活动的老鼠尾巴施加压力持续 10 s,导致其疼痛以诱发蜷缩及舔尾等躯干发生较大幅度的扭动行为,对夹尾前后的脊髓血管图像位移进行量化比较,以评估该条件下血管位移偏差(图 2(g))。结果表明,在夹尾过程中,尽管小鼠出现剧烈的挣扎以及舔尾行为,但血管图像依然稳定,仅有微小范围位移。基于此,对夹尾前和夹尾过程中,以及夹尾前和夹尾后的血管图像进行头尾轴、左右轴位移变化统计,以检验在剧烈运动状态下该成像方法的可行性。统计结果显示,夹尾刺激过程中头尾轴最大图像位移<30 μm,左右轴最大图像位移<8 μm(图 2(f))。
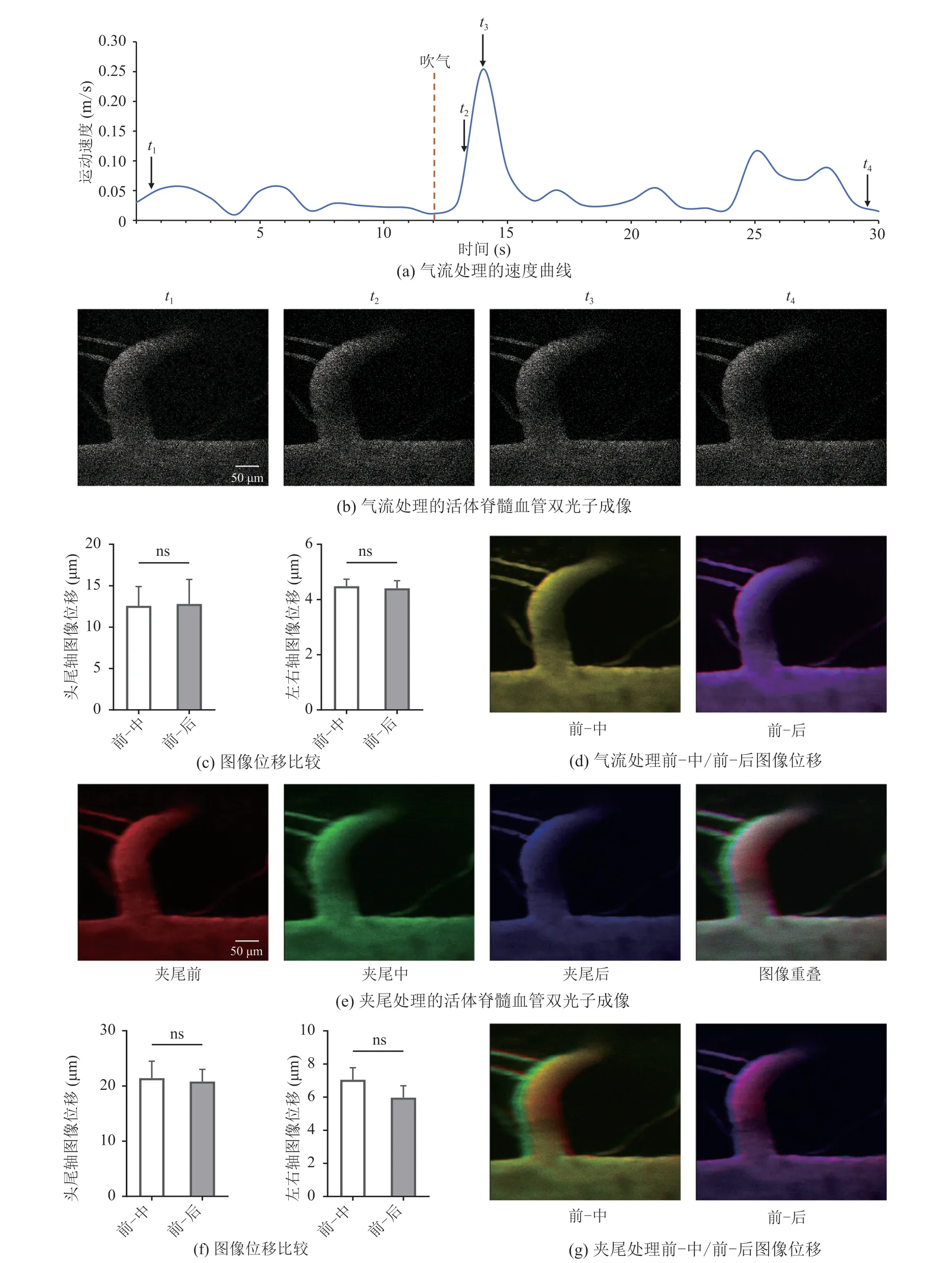
图2 外界刺激干预下的小鼠脊髓前动脉血管双光子成像位移偏差Fig.2 Two-photon imaging displacement of the anterior spinal artery vessels under the intervention of external stimuli
以上结果表明,在小鼠剧烈运动中,尽管部分行为会导致脊髓血管图像出现一定的位移,但图像采样依然具备高质量以及分析性,能物理矫正多种极端行为下的脊髓无规则扭曲,满足实时成像要求。
3.3 脊髓前动脉血管的长期双光子成像
为评估在长期成像过程中,脊髓适应成像固定零件的过程中所产生的微小位置变化对成像清晰程度和成像稳定性的影响,对自由活动的小鼠脊髓前动脉血管动态变化进行为期 7 d 的成像。实验采集测试开始的第 1 天、第 3 天、第 5 天和第 7 天的脊髓血管图像,进行观察比较和位移量化。结果表明,在连续成像测试过程中,血管结构清晰可见(图 3(a));图像头尾轴和左右轴的位移偏差均无显著差异,头尾轴图像位移<35 μm,左右轴图像位移<10 μm(图 3(b)),位移范围较小且均在图像可校正范围内。这表明该方法适用于长期成像,且成像效果较为稳定。此外,对测试期间小鼠运动能力进行评估,结果表明,第 1 天、第 3 天、第 5 天和第 7 天小鼠运动距离和平均运动速度均无显著差异(图 3(c)),说明手术方式以及成像过程不影响小鼠的基础运动状态。

图3 自由活动小鼠脊髓前动脉血管的长期双光子成像Fig.3 Long-term two-photon imaging of the anterior spinal artery vesselsin freely behaving mice
3.4 行为干预下的脊髓前动脉血管的长期双光子成像
为评估长期成像过程中,小鼠在剧烈运动时脊髓血管图像所产生的位移偏差能否被有效控制在可接受范围内,在植入成像套件后的第 1 天、第 3 天、第 5 天和第 7 天对自由活动的小鼠先后进行气流和夹尾处理。实验结果发现,血管结构成像依然清晰,图像质量较为稳定(图 4)。
气流处理改变小鼠瞬时运动速度,吹气前、中、后的脊髓血管图像高度重叠(图 4(a)),且在不同的时间点(第 3 天和第 7 天)血管结构成像清晰。进一步统计位移偏差,量化结果表明,每天气流处理前-中和前-后血管图像位移在头尾轴和左右轴均无明显差异,表明气流刺激使血管图像产生了一定的位移(图 4(b))。其中,头尾轴图像位移为 10~20 μm,左右轴为 4~8 μm,位移范围较小且在图像可校正范围内(图 4(c))。
夹尾处理能使小鼠身体产生较大程度的弯曲,自然状态下会伴随脊髓较大程度的形态变化。为进一步评估在此过程中本文成像方法是否将血管图像位移控制在理想成像允许范围内,在植入成像套件后的第 1 天、第 3 天、第 5 天和第7 天分别对小鼠实施夹尾处理。脊髓血管成像结果显示,血管结构依然清晰完整,无明显的图像扭曲和丢失现象图 4(d)。统计结果显示,每天夹尾前-中和前-后血管图像位移在头尾轴和左右轴均无显著差异(图 4(e)),头尾轴图像位移范围保持在 14~28 μm,左右轴在 4~8 μm(图 4(f))。
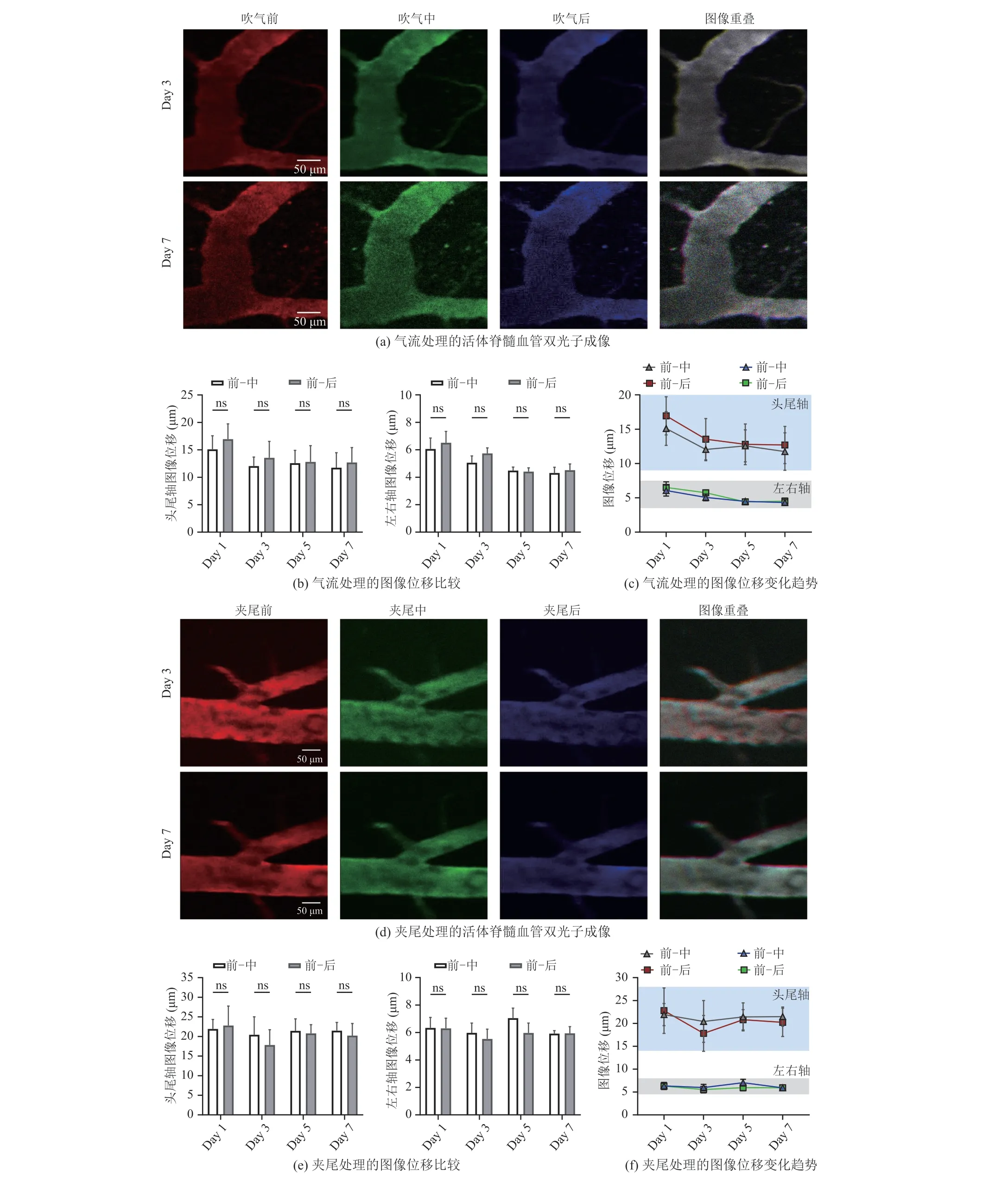
图4 行为干预下的小鼠脊髓前动脉血管的长期双光子成像Fig.4 Long-term two-photon imaging of the anterior spinal artery vessels in mice under behavioral intervention
以上结果表明,行为干预下的小鼠脊髓图像位移主要集中在头尾轴,与自由活动的小鼠脊髓位移主要集中在头尾轴一致。此外,在剧烈的刺激引发动物剧烈活动的前提下,脊髓图像会产生在可纠正范围内的位移,但是相较于之前已报道的有关自由活动的动物体内脊髓成像方法(左右轴≤13 μm,头尾轴≤50 μm),图像位移已有非常显著的减小[6],较大程度提升了成像质量。
3.5 脊髓背角神经元编码运动信息
脊髓在躯体感觉和运动过程中发挥重要的作用,传送脑与外周之间的神经信息以协调生命体正常活动,但目前对相关的神经元功能的研究较少。在小鼠自由活动过程中,对脊髓背角神经元检测发现,即使在小鼠剧烈的活动过程中依然能采集到高分辨的单个神经元钙活动信息(图 5(a)):当小鼠处于清醒固定状态时,脊髓背角浅层神经元几乎没有发放;当小鼠在无束缚环境中处于静息状态时,神经元活动水平也较低;当小鼠在自由运动状态时,少量细胞有微弱的活动;而当小鼠在原地梳理毛发时,明显观察到更多的神经元活动。
随机选取小鼠连续 60 s 运动过程中的神经元发放情况进行分析,对检测到的 5 个神经元进行示踪。分析发现,小鼠活动过程中神经元存在较低幅度的短暂自发放现象,其中 2 号、3 号和 5号神经元在 50~60 s 内部分时间点的钙离子活动显著增加,钙信号高于基线约 3 倍(图 5(b)左);在梳理毛发时神经元有强烈且持续的发放,其中1 号、2 号和 5 号神经元在 0~30 s 内部分时间点钙离子活动大幅度增加,神经元钙信号高于基线的 6 倍(图 5(b)右)。此外,通过比较脊髓背角神经元在不同行为下的活动细胞比例发现,小鼠运动时的神经元发放比例为 2.56%;而梳理毛发时的神经元发放比例为 15.73%,显著高于运动时的发放比率(图 5(c))。

图5 脊髓背角浅层神经元双光子钙成像Fig.5 Two-photon calcium imaging of neurons in the superficial spinal dorsal horn
4 讨论与分析
脊髓活体成像技术是进一步在生理或病理条件下探究脊髓功能和结构的关键瓶颈之一[6,13]。随着研究水平的不断深入,很多实验需要在无束缚环境的小鼠模型中进行,但由于技术水平的限制,目前很难在自由活动的动物模型中实现脊髓成像[2,17]。本文借助微型化双光子显微镜,开发出一套适于自由活动的动物脊髓双光子成像方法。同时,利用这一技术在自由活动的小鼠中实现了长期稳定的脊髓前动脉血管成像,并进一步在细胞层面上实现了对单个脊髓背角神经元功能的初步探究。
在实现小鼠脊髓活体成像的过程中,由于脊髓结构的特殊性使得无论是麻醉状态下的成像还是自由活动状态下的成像,均面临如何稳定植入光学成像套件的问题[1]。现有的脊髓长期成像主要是在麻醉或清醒固定的小鼠上实现,且多数以脊髓结构成像为主,因此手术只需要暴露少部分脊髓[18-19],而本文则更关注自由活动的小鼠中脊髓神经元的功能,成像目标以神经元胞体为主。但是由于脊髓浅层存在的大量白质结构,可成像的灰质区域分布于脊髓的两侧远端,因此进行脊髓背角浅层神经元成像需要更大的成像窗口[1]。虽然本文采用的植入式玻璃成像窗口增加了手术难度,但并没有影响小鼠的基本行为,鲜有出现小鼠后肢无力甚至瘫痪等一些常见的脊髓手术后遗症。更为重要的是,已报道的脊髓成像方法中由于动物呼吸、心跳以及自发活动常会引发明显的脊髓组织剧烈晃动,导致图像质量较差[14,20-21]。尽管在麻醉的小鼠中有很多改进的策略,但在清醒固定后,依然发现成像时有大幅度的组织位移,导致成像图像的丢失[6]。因此,本文进一步改进现有的脊髓植嵌体,采用新的手术固定方式,从成像的物理层面尽可能地削弱了脊髓的无规则运动,大幅度消除成像采集过程中图像的丢失或伪影,显著提高成像质量,为后期的图像处理简化了流程,实现了在自由活动的小鼠中长期稳定的脊髓双光子成像。
通过脊髓血管成像,本文评估了无束缚环境中自由活动的动物活体脊髓图像位移的范围。与现有的荧光成像技术相比,不仅在图像质量上体现了双光子成像的优越性,而且大幅度降低了成像过程中的组织位移,远低于现有的基于微型化单光子显微镜的活体脊髓成像技术[6]。此外,高质量的图像信息降低了图像处理以及分析难度,能够很好地匹配现有的图像处理软件。由于脊髓的组织位移与运动状态密切相关,在小鼠剧烈活动时(如加速运动、梳理毛发和舔舐伤口等过程中),脊髓往往存在大幅度的扭曲[22]。本文通过气流刺激以及夹尾实验,分别诱发小鼠突然加速和舔舐伤口等行为[22-23],该过程的成像质量评估结果表明,图像在头尾轴存在相对显著的位移,但图像仍旧清晰且无明显图像丢失或图像伪影等问题出现。此外,长期的成像结果表明,图像相对位移稳定,并没有随着时间的延长、脊髓自身的恢复、术后组织增生等,产生累积效应而影响图像质量。
脊髓对于感知和区分不同类型的环境因素以协调自身变化和外部环境变化,从而防止躯体损伤是至关重要的[24-25]。当皮肤受到不同的化学、热或机械刺激时,不同伤害性程度的感觉信息传到位于脊髓背角的神经元,但这些神经元如何编码这些信息,目前尚不完全清楚[26-29],已有的研究也局限于麻醉的小鼠或清醒固定的小鼠[1,30],鲜有自由活动的动物。通过使用基于微型化双光子荧光显微镜的自由活动小鼠脊髓成像方法,本文实现了对自由状态下小鼠脊髓神经元的双光子成像。这将为进一步解析参与感觉信息处理的背角神经元如何编码来自皮肤和其他组织、器官的信号,以及这些神经元在多大程度上编码小鼠的感觉、运动等信息,提供一定的技术支持。
5 结 论
本文工作首次将微型化双光子活体成像技术应用到自由活动的小鼠脊髓研究中。通过评估脊髓前动脉血管在正常行为和剧烈运动过程中的图像质量,验证了基于微型化双光子荧光显微镜的自由活动的小鼠脊髓成像方法的可行性。此外,利用这一技术优势,实现了脊髓背角浅层神经元活动中单个神经元钙信号的延时成像,突破了传统固定以及清醒成像束缚的限制,解决了活体脊髓成像研究中一个关键的技术难题。自由活动小鼠脊髓成像的实现,使得从真实的场景中研究感知觉信息输入和大脑指令输出在脊髓中的编码过程成为可能,将为进一步探究脊髓在躯体感觉和运动过程中神经元活动模式对神经信息的编码提供技术支持。
