阿片类药物所致痛觉敏化的神经炎症免疫机制 *
2021-11-30颜丽晖白静慧
姜. 爽. 颜丽晖. 夏. 蓉. 白静慧
(辽宁省肿瘤医院综合内科特需病房,沈阳 110042)
阿片类药物在疼痛领域的临床应用非常广泛,除常见不良反应外,阿片类药物诱导的痛觉敏化(opioid-induced hyperalgesia, OIH) 逐渐成为临床关注的重要问题。根据国际疼痛学会 (International Association For the Study of Pain, IASP) 对痛觉敏化的定义引申,OIH 可描述为由于阿片类药物暴露所致的痛觉感知增加。其特殊性在于用阿片类药物镇痛的初衷转化为相反的疼痛敏感度增加、阿片类药物对疼痛脱抑制的矛盾状态。由于目前对OIH 进行临床诊断和评估的方式非常有限[1],在阿片用药过程中的疼痛加重,往往被视为疾病进展或产生了阿片类药物耐受 (opioids tolerance, OT)。在缺少对OIH 鉴别和排除的情况下,因痛感恶化贸然增加阿片类药物滴定反而可能导致疼痛更难控制。因此,对OIH 的认识和理解对临床阿片类药物的合理使用非常重要。目前临床上已发现OT 病人疼痛阈值明显降低,更易发生痛觉敏化[2],但阿片类使用剂量与OIH 的相关关系并不明确[3]。
对OIH 发生机制的全面认识是合理干预的前提条件。既往对OIH 机制的研究主要集中于神经元的信号转导及功能调节方面,主要包括脊髓下行易化、突触可塑性变化、谷氨酸能系统活动增强、离子通道相关神经元兴奋性改变及受体电位改变、μ 阿片受体 (mu-opioid receptor, MOR) 功能变化等[4]。除参与痛觉调节常见的P 物质、胆囊收缩素、κ 受体激动剂强啡肽等,还有许多其他内源性神经肽被认为与OIH 相关[5]。
自“四联突触” (tetrapartite synapse) 模型[6]在神经病理性疼痛机制中提出以来,星形胶质细胞和小胶质细胞作为神经炎症免疫系统中的重要载体,也被认为参与了OIH。二者与传入神经元末梢突触前膜、投射神经元突触后膜一起,共同组成了神经免疫信号的交互核心。阿片类药物可能通过诱发中枢胶质细胞活化,引起促炎性细胞因子和趋化因子的释放,导致中枢敏化[7],而通过抑制胶质细胞活动,痛觉敏化可以得到改善。诸多炎症细胞因子介导了免疫信号在胶质细胞与神经元之间的传递[8,9],其他广义的神经免疫炎症细胞如少突胶质细胞、血管旁巨噬细胞、内皮细胞及浸润性免疫细胞、间充质干细胞等均有报道与OIH 相关,以前两者讨论为多。探讨OIH 背后神经炎症及免疫机制对长期以阿片镇痛为主的慢性难治性癌痛病人意义非凡。由于目前该方向研究国内尚无系统综述,本文仅对已获得报道进行初步汇总,以OIH 的非神经元机制为主要方向,针对神经胶质细胞功能障碍及炎症反应分子改变进行讨论。
一、胶质细胞参与OIH 的相关证据
在阿片类药物慢性作用下,通过免疫组化和蛋白印迹分析星形胶质细胞和小胶质细胞形态和数量上的变化,发现两种胶质细胞的活化可在脊髓及腹外侧中脑导水管周围灰质等处发生[10],这种活化往往与OT 或OIH 相关,且在给予相应的炎症抑制剂后,不仅两种胶质细胞的活化减弱,同时OIH 及OT 减少。进一步探讨信号通路发现,胶质细胞的炎症反应是通过核转录因子 (nuclear factor,NF-κB)、丝裂原活化蛋白激酶 (mitogen activated protein kinase, MAPK p38) 和细胞外信号调节激酶(extracellular signal regulated kinase, Erk) 等通路实现的,大部分免疫产物由上述通路激活或磷酸化后产生。MAPK 是典型的四级联信号通路,核心信号分子通路分Erk1/2 (p44/42)、JNK1-3(c-Jun 氨基酸末端激酶)/SAPK(应激激活蛋白激酶),p38 三大类型,在两种胶质细胞活动中均分别发挥了一定功能。Lin 等[11]曾在吗啡耐受的模型中通过基于神经炎症特征集的计算机辅助免疫染色图像诊断系统检测小胶质细胞及星形胶质细胞的活化,发现与神经元相比,神经炎性表达在两种胶质细胞中更多见。通过分析胶质细胞活化标志物,发现星形胶质细胞增生的常见标志是胶质纤维酸性蛋白 (glial fibrillary acidic protein, GFAP)表达增加,小胶质细胞增生常与CD11b(补体受体CR3)和Iba1 的表达增加有关[12]。后续研究曾广泛应用上述标志物检测观察胶质细胞活动,但应该注意的是,两种胶质细胞的标志物变化与其激活程度的关系不是一定的[12]。二者活动也并不是始终同步,星形胶质细胞和小胶质细胞可能同时被激活,在一些情况下也可以看到独立的胶质细胞活动。
最初观察认为吗啡暴露仅诱导星形胶质细胞的活化。急性期吗啡暴露引起背根神经节卫星胶质细胞中GFAP、IL-1β、基质金属蛋白酶9 (matrix metalloproteinase, MMP-9) 上调,认为星形胶质细胞活动增加[13]。慢性暴露于吗啡5~7 天后,逐渐发现脊髓神经元及星形胶质细胞中NF-κB p-65 磷酸化水平上调[14],而在小胶质细胞中并无这样的反应。吗啡还可使星形胶质细胞的p-JNK 水平升高且JNK拮抗剂可以控制OIH 进展,JNK 通路的活化与极低剂量吗啡诱导的热痛觉敏化相关[15]。在极低剂量阿片诱导的痛觉敏化模型中,也可发现星形胶质细胞的选择性激活,而小胶质细胞活性并不增强[16]。通过减少星形胶质细胞活化可逆转丁丙诺啡诱导的痛觉增敏。
慢性吗啡暴露下小胶质细胞的单一活化也被观察到。小胶质细胞是中枢固有免疫细胞,对局部炎症监测、诱导并维持慢性疼痛的过程中起关键作用,并通过与突触的物理接触具有重要的神经通路重塑作用。神经调节蛋白-1、MMP-2、MMP-9、趋化因子配体2 (CCL2) 等介体的释放参与了小胶质细胞的活化[17]。在慢性可待因所致痛觉敏化模型中,发现小胶质细胞活化标志物CD11b 分化簇扩增,而星形胶质细胞活化标记物GFAP 表达不受影响[18]。通过对Oprm1/OPRM1 基因转录组学研究发现,小胶质细胞表达μ 阿片受体[19],吗啡可能通过该受体激活PKCε-Akt-ERK1/2 信号通路,刺激活化的小胶质细胞释放促炎症细胞因子及一氧化氮[20],同时小胶质细胞P2X4 嘌呤受体 (P2X4R) 上调,释放脑源性神经营养因子,激活神经元上的TrkB 受体,并下调了K-Cl协同转运体KCC2,增加神经元内Cl-浓度,引起γ 氨基丁酸能神经元的脱抑制及痛觉敏化[12]。此外小胶质细胞内磷酸化p38 丝裂原活化蛋白激酶(p-p38 MAPK) 通路可能是痛觉敏化的另一机制[21]。通过评估p-p38 MAPK 抑制剂SB 203580 在腹外侧中脑导水管周围灰质内的作用,发现该治疗消除了小胶质细胞的激活,减少痛觉敏化,但此作用不存在于星形胶质细胞和神经元中[22]。
概括认为两种胶质细胞在阿片物质暴露下均出现活动性变化,并诱发了神经元敏化(见图1),慢性暴露时小胶质细胞活动更加活跃,二者在OIH的发展过程中很可能发生交互作用。由于OIH 与OT 是慢性阿片使用后可能出现的两种相反的神经元对阿片物质的敏感性变化,诸多研究往往将二者同时讨论,但也有研究强调了其结果与OIH 相关却与OT 不相关,暗示了二者在机制上仍有待细致区分。
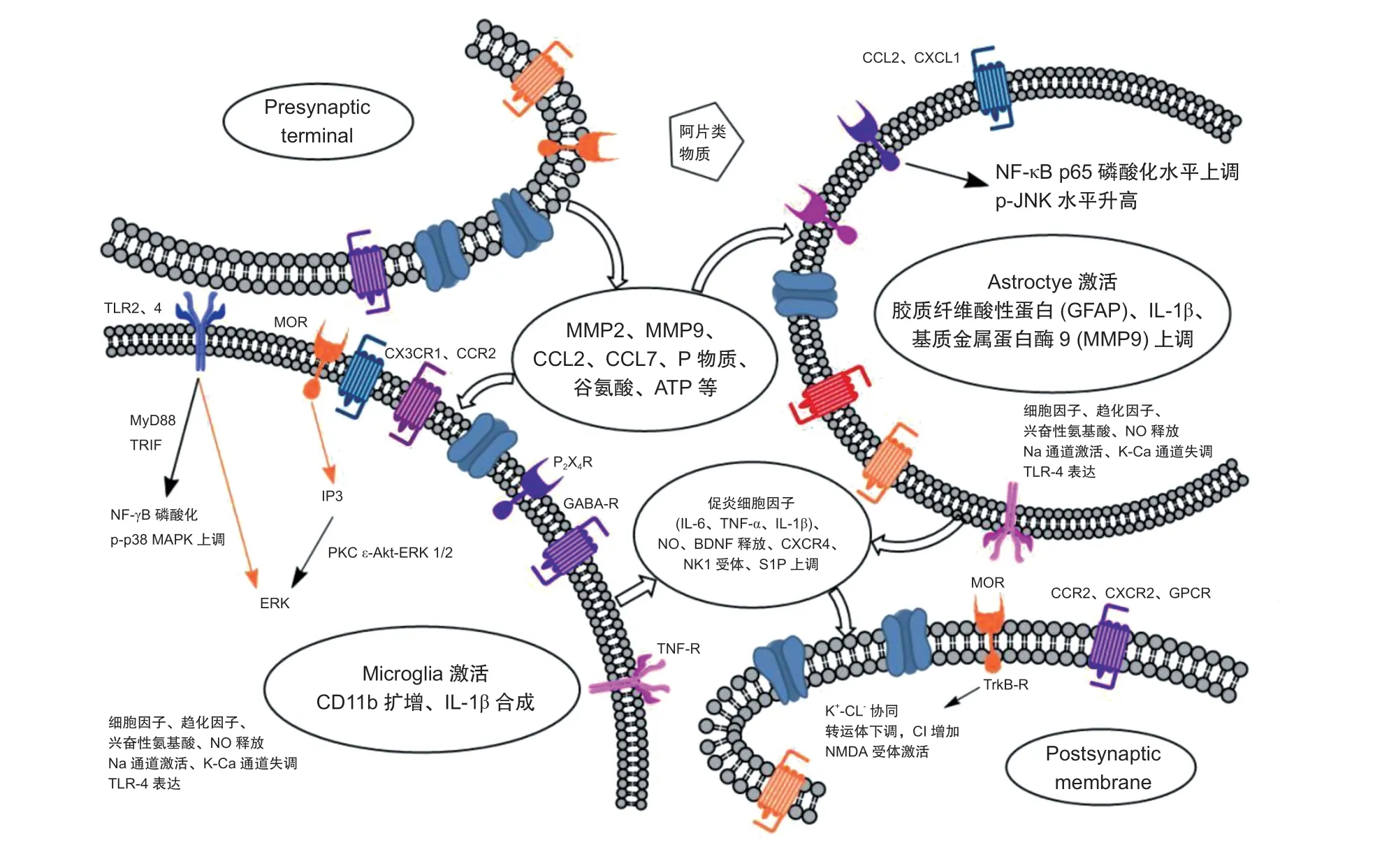
图1 OIH 中可能存在的神经元与胶质细胞间分子交互及相关通路示意图
二、免疫受体及炎症因子参与OIH 的相关证据
胶质细胞与其他神经、免疫细胞的信息交互和功能实现离不开细胞表面负载的多种受体位点及内部分子通路。在OIH 的机制讨论中,论述较多的包括Toll 样受体 (Toll like receptor, TLR),尤其是TLR4、细胞因子、趋化因子等几大类。TLRs 是一组启动内源性和适应性免疫通路的识别受体家族,在识别病原分子模式和易化促炎症细胞因子产生方面发挥着重要作用。细胞因子与趋化因子作为神经元与胶质细胞互动中传递信息的重要物质,是强大的神经功能调节剂。随着研究细化及反复验证,各因子亚型的作用权重也在不断变化。
1. Toll 样受体 (TLRs)
TLR 主要分布在小胶质细胞、三叉神经节和背根神经节的感觉神经元上,最早认为长时间暴露于吗啡会通过激活中枢神经系统中的先天性免疫受体TLR4 来加剧疼痛。TLR4 是13 个单跨膜受体家族之一,是对阿片刺激做出应答的重要位点[23]。TLR4 是吗啡诱导的小胶质细胞活化和IL-1β 释放的主要机制[24],一旦识别出某种刺激模式,TLR4就会与共受体CD14 和髓样分化蛋白 (myeloid differentiation protein, MD2) 发生二聚化,并通过包括MyD88 和TRIF 在内的衔接蛋白进行信号传导,从而使MAPK 和NFκB 磷酸化[25],促发炎症介质的产生。目前几乎每个被临床筛选的阿片类药物都可以与TLR4/MD2 异二聚体结合[12],包括吗啡的非阿片类代谢物吗啡-3-葡糖醛酸 (M3G)。阻断TLR4的活化、TLR4 基因敲除、鞘内注射TLR4 拮抗剂等相应方式均可改善触摸痛等痛觉敏化[26]。
但有研究对TLR4 激活在OIH 发生发展中的必要性提出了挑战,认为吗啡通过TLR4 的活化导致了镇痛剂耐受和痛觉增敏有待进一步研究。TLR4途径并非产生OIH 的决定性途径。系统性低剂量吗啡诱导的OIH 和敏化启动与TLR4 及蛋白激酶Cε(PKCε) 相关,而大剂量吗啡诱导的镇痛和敏化启动既不是TLR4 也不是PKCε 依赖性的[23]。长期暴露于阿片类药物必然导致伤害性感受器上的MORs长时间激活,并诱发自适应,触发疼痛通路的下游事件发生,导致OT 和OIH,以及小胶质细胞的激活和长时程增强[27]。因此认为TLR4 对于小胶质细胞对吗啡的应答不是必须的,其他的调控因子如TLR2、TLR5、TLR8 也参与了过程,且TLR2、ATP 受体P2X4、CSF1R 可能在小胶质细胞激活中起到更重要作用[27]。当然这种冲突性结果可能是由于实验设置不一致,在不同程度上影响TLR4 活性所致,包括实验动物种系不同、饲养卫生条件不同、阿片给药策略不同、OIH 界定方法不同等。因此,TLRs 到底以何种形式参与到OT 及OIH 的过程中仍需要进一步深入的分析。
2. 抗炎症性细胞因子
多种细胞因子可能影响前炎症介质的产生,在慢性吗啡作用下,通过TLR4 途径可诱导IL-1β 的合成,P2X4R 途径则负责诱导的IL-1β 释放[24]。小胶质细胞通过促炎和感受性介质的分泌来增强疼痛状态,常见的包括IL-6、TNF-α[28]及IL-1β,这些介质显示出可增强疼痛回路中的兴奋性突触传递并抑制抑制性突触传递的作用[29]。它们在脊髓内通过激活各自在胶质细胞上的受体,导致进一步抗炎产物释放(如IL-4、IL-6、IL-10,IL-11、IL-13、IL-18和TGF-β),影响突触的长时程增强,促进神经元N-甲基-D-天冬氨酸受体的激活,而神经元兴奋性改变是OIH 的主要病理机制之一[17]。相应地,IL-1受体拮抗剂IL-1ra(一种针对IL-1、TNF-α 及IL-6的综合阻断剂)及抗炎性细胞因子可对OIH 产生预防作用。IL-1ra 可逆转可待因诱导的痛觉敏化[18]。通过鞘内转染IL4/IL10 融合蛋白可引起有效而持续的抗痛觉敏化的作用[30]。鞘内注射重组IL-4 可抑制机械性痛觉敏化,并增加脊髓小胶质细胞内pSTAT6 的表达[31]。
3. 趋化因子 (CxCL) 及趋化因子受体 (CxCRs)
CX3CL1 作为脊髓及初级传入神经元上表达的趋化因子,可通过其小胶质细胞上的CX3CR1 受体引起小胶质细胞的活化,实现神经元到小胶质细胞的信号传导,而通过鞘内注射单核细胞化学引物蛋白1 (monocyte chemical primer protein, MCP-1) 或CX3CR1 的中和抗体可减少OT 或OIH[32]。此外,表达在脊髓星形胶质细胞上的CCL2 和CXCL1 可与脊髓神经元上相应的受体CCR2 及CXCR2 结合,从而增加兴奋性突触信号的传递,实现从星形胶质细胞到神经元的信号转导增强[33]。CCL3、CCL2、CCL5 及CXCL8 可能通过激活它们各自的G 蛋白偶联受体降低了MOR 的敏感性,从而改变了MOR的功能。既往有研究认为SDF1/CXCL12-CXCR4 系统可以看作是慢性疼痛的总调控[34],慢性吗啡上调了基质衍生因子1 (stroma-derived factor, SDF1)/CXCL12 及CXCR4,通过激活Src 家族激酶趋化因子受体CXCR4 可诱导神经元中的μ 阿片受体异源脱敏,而对CXCR4 的阻断可逆转OIH。最近一项研究通过神经损伤模型诱导上述细胞因子在脊髓的高表达并激活两种胶质细胞,对比发现,并非CCL12,而是趋化因子CCL2 和CCL7 在阿片诱导的麻醉中起到了相对重要的作用,并通过鞘内注射相应的中和抗体增强了吗啡的镇痛效果[35]。趋化因子各亚型的作用权重仍需探讨。
4. 其他相关的炎症免疫分子
小胶质细胞表达的ATP 受体也可能参与了OIH,其中嘌呤能P2X4 受体(由胞外ATP 激活的非选择性阳离子通道)的过表达对痛觉唤起非常重要。吗啡通过MOR 依赖的P2X4 受体信号系统,在趋化因子受体CCR2 作用下,促使小胶质细胞发生位移,脊髓内P2X4 受体上调,而通过抑制小胶质细胞上P2X4 受体的活性可预防吗啡耐受。小胶质细胞表达的与疼痛相关的其他ATP 受体亚型还包括P2X7、P2Y6 和P2Y12 等[9]。
脊髓速激肽NK1 受体与OIH 过程中的胶质细胞激活相关。持续性吗啡使用导致P 物质释放增加,小胶质细胞和星形胶质细胞也表达有功能活性的速激肽NK 1(P 物质)受体。吗啡诱导的痛觉敏化可以通过速激肽NK1 受体拮抗剂L-732,138 弱化,说明速激肽NK1 受体系统的激活在OIH 过程中起到一定作用[10]。
在慢性吗啡灌注下,OIH 还可能与鞘脂类神经酰胺在小鼠脊髓星形胶质细胞和小胶质细胞中的上调相关。神经鞘氨醇-1-磷酸盐及其G 蛋白偶联受体表达于脊髓和背根神经节等已知与痛觉加工相关的脑结构中,该鞘磷脂通路目前也被认为是慢性疼痛控制靶点之一[36]。
三、结论
OIH 机制复杂,胶质细胞及相关炎症免疫机制的研究是目前现有神经元机制的重要补充。大多数现有研究以动物模型为主要研究对象,仅少数试验探讨了人类在体的OIH 现象。概括起来在阿片类物质刺激下,中枢胶质细胞被激活,以星形胶质细胞及小胶质细胞为主要载体,通过结合于表面受体并激活细胞内分子的信号级联反应,继而释放各种促炎症因子(如细胞因子)及趋化因子,并与神经元突触前后膜上的相关受体关联导致神经元-神经胶质回路的敏化。性别因素、阿片类药物不同种类、情感特征或应对方式等混杂因素也可能影响疼痛传导的神经-内分泌-免疫网络,应在未来的研究中严格控制潜在干扰因素,并对OIH 的机制进行细化探讨。
