基于核酸适配体-SYBR GreenⅠ快速检测金刚烷胺的荧光传感技术
2021-11-29吕辰李钰金宋明燕吴世嘉段诺王周平
吕辰,李钰金,宋明燕,吴世嘉,段诺*,王周平*
1(江南大学 食品学院,江苏 无锡,214122)2(中国海洋大学 食品科学与工程学院,山东 青岛,266003)
金刚烷胺是母体结构为饱和三环癸胺的氨基衍生物,常以盐酸盐形式存在,能在较低浓度下抑制甲型流感病毒的复制[1]。长期服用金刚烷胺类抗病毒药物易导致流感类病毒产生抗药性,且增加流感类病毒变异的可能性[2-3]。残留在畜禽动物体内的金刚烷胺可通过食物链损伤人体健康[4]。中国农业部于2005年12月、美国食品药品监督管理局于2006年先后禁止对禽畜使用金刚烷胺类抗病毒药物。但仍有小部分养殖户为经济利益而向饲料中非法添加此类药物,严重威胁了消费者的健康和畜牧业的发展[5-6]。
我国对金刚烷胺的检测方法包括色谱分析法、酶免疫法、分子印迹电化学传感器技术、荧光探针技术等。其中,色谱分析法和酶免疫法较为典型[7]。色谱法包括高效液相色谱法、气相色谱法、高效液相串联质谱法、气相色谱串联质谱法等[8-10];酶免疫法包括酶联免疫吸附测定法和化学发光免疫分析法等[11-13]。这2类方法虽然常用,但也存在一定的弊端:色谱分析法样品处理繁琐耗时,检测设备昂贵,需要专业的技术人员操作,现场检测中具有局限性;酶免疫法灵敏度和准确度较低,过程繁琐、耗时,成本高,制备出的抗体也易受温度等环境因素的影响。
核酸适配体是与靶标具有高亲和力、高特异性的RNA或单链脱氧核糖核酸(ssDNA)[14],可经设计后通过体外筛选技术得到[15],它可与靶标通过非共价键作用相互结合,形成复杂的三维结构从而特异性识别靶标[16]。核酸适配体相对分子质量小、性质稳定,本身不带有信号,需经过化学修饰后通过信号转换使得结果可视化。利用筛选得到的核酸适配体构建生物传感器,可广泛应用于安全检测领域[17-21]。目前,基于核酸适配体进行金刚烷胺检测的方法未见报道,本文利用SYBR Green I(SGI)荧光染料结合适配体传感技术,将适配体与金刚烷胺的识别过程转化为荧光信号,建立基于核酸适配体-SYBR Green I快速检测金刚烷胺的荧光传感技术。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
氯化钠、氯化钾、三氯乙酸,均为分析纯,国药集团化学试剂有限公司;适配体ssDNA序列,上海生工生物工程技术服务有限公司;盐酸金刚烷胺(分析纯),美国Sigma-Aldrich公司;SGI赛默飞世尔科技(中国)有限公司;超纯水,18.2 mΩ,由美国Millipore超纯水仪制备;牛奶样品,购于无锡欧尚超市。
1.1.2 仪器与设备
Synergy H1型多功能酶标仪,美国伯腾公司;Centrifuge 5424R台式高速冷冻离心机,德国艾本德公司;KQ-800DE超声波清洗仪,昆山市超声仪器有限公司;AR224CN型电子天平,奥豪斯仪器中国有限公司。
1.2 实验方法
1.2.1 检测原理
SGI是一种荧光染料,游离状态下在497 nm光的激发下,在530 nm处可发射出微弱的荧光[22],当体系中有DNA适配体存在时,SGI可嵌入DNA折叠结构从而使得荧光发射强度扩大1 000倍,而当向体系中加入目标物金刚烷胺后,金刚烷胺与适配体的特异性结合会导致SGI染料脱离适配体的嵌合,从而引起体系中荧光强度的降低,其原理如图1所示。因此,可以利用SGI作为信号指示剂,通过荧光的强度变化实现对金刚烷胺的定量检测。

图1 基于适配体-SGI染料检测金刚烷胺原理图
1.2.2 SGI-适配体结合时间的优化
向1×SGI溶液中加入终浓度为0.1 μmol/L的适配体,将SGI与适配体的结合时间分别设置为2、4、6、8、10 min,保持其他条件不变,利用多功能酶标仪在497 nm下,测定不同结合时间下SGI-适配体溶液在530 nm处的荧光强度。
1.2.3 适配体-金刚烷胺孵育时间的优化
将1×SGI及终浓度为0.1 μmol/L适配体混合溶液均匀分装至2组:A组为含有1 μmol/L金刚烷胺的实验组;B组为加入结合缓冲液替代A组中金刚烷胺的空白对照组。实验组与对照组均在常温下进行孵育,并将孵育时间设置为2、5、10、15、20、25 min,孵育结束后分析不同孵育时间下对照组与实验组的荧光强度差值。
1.2.4 金刚烷胺的定量检测
将1×SGI染料及终浓度为0.1 μmol/L适配体溶液混合均匀后分为2组:A组为加有金刚烷胺的实验组;B组为加入结合缓冲液替代金刚烷胺的空白对照组。将适配体-SGI混合溶液均匀分装至2组后,向实验组适配体-SGI混合体系中加入金刚烷胺配制成一定的质量浓度梯度(0.000、1.000、10.000、50.000、75.000、100.000 ng/mL),将对照组和实验组在室温下孵育10 min后测定荧光强度。以金刚烷胺的浓度为横坐标,以对照组与实验组的荧光强度差值为纵坐标绘制标准曲线。
1.2.5 加标回收实验
利用实验设计方法对动物源食品牛奶进行加标回收实验,将2 mL的牛奶样品稀释后加入标准品金刚烷胺,并设置以结合缓冲液替代标准品为空白对照组。分别加入1%(质量分数)的三氯乙酸后涡流混合均匀,将混合体系超声、离心、去沉淀后用0.22 μm的滤膜进行过滤收集。用实验设计方法进行检测,将对照组和实验组的荧光强度差值带入标准曲线得到检测值并计算回收率。
2 结果与分析
2.1 可行性验证
为了验证该检测方法的可行性,分别测定SGI溶液、SGI-适配体溶液、SGI-金刚烷胺溶液、SGI-适配体-金刚烷胺溶液的荧光光谱,结果如图2所示。可见,SGI本身发射的荧光非常微弱;当溶液中只存在SGI和金刚烷胺时,也几乎不发射荧光,说明金刚烷胺不会导致溶液荧光强度的变化;在SGI-适配体复合体系中,溶液在530 nm处荧光强度发生显著升高;当SGI-适配体复合体系中加入金刚烷胺后,由于适配体对于金刚烷胺的特异性识别作用,导致整个体系的荧光强度发生明显降低。因此表明,SGI对适配体和金刚烷胺有着较好的响应,可以引起溶液的荧光强度发生较大幅度的变化,方法可行。

图2 检测方法的可行性验证
2.2 SGI-适配体结合时间的优化
SGI和适配体结合会显著增强荧光强度,但是SGI-适配体能否充分结合以及结合后的荧光稳定性仍未可知,为了探究SGI-适配体结合时间对实验的影响,对SGI与适配体的结合时间进行优化。由图3可知,当向SGI溶液中加入适配体2 min后即可观察到荧光信号发生较强响应,并且随着时间的增加,荧光强度基本无变化,表明SGI和适配体的结合几乎是即时发生的,较为快速和稳定,因此选用2 min为SGI与适配体的最佳结合时间,并用于后续实验。
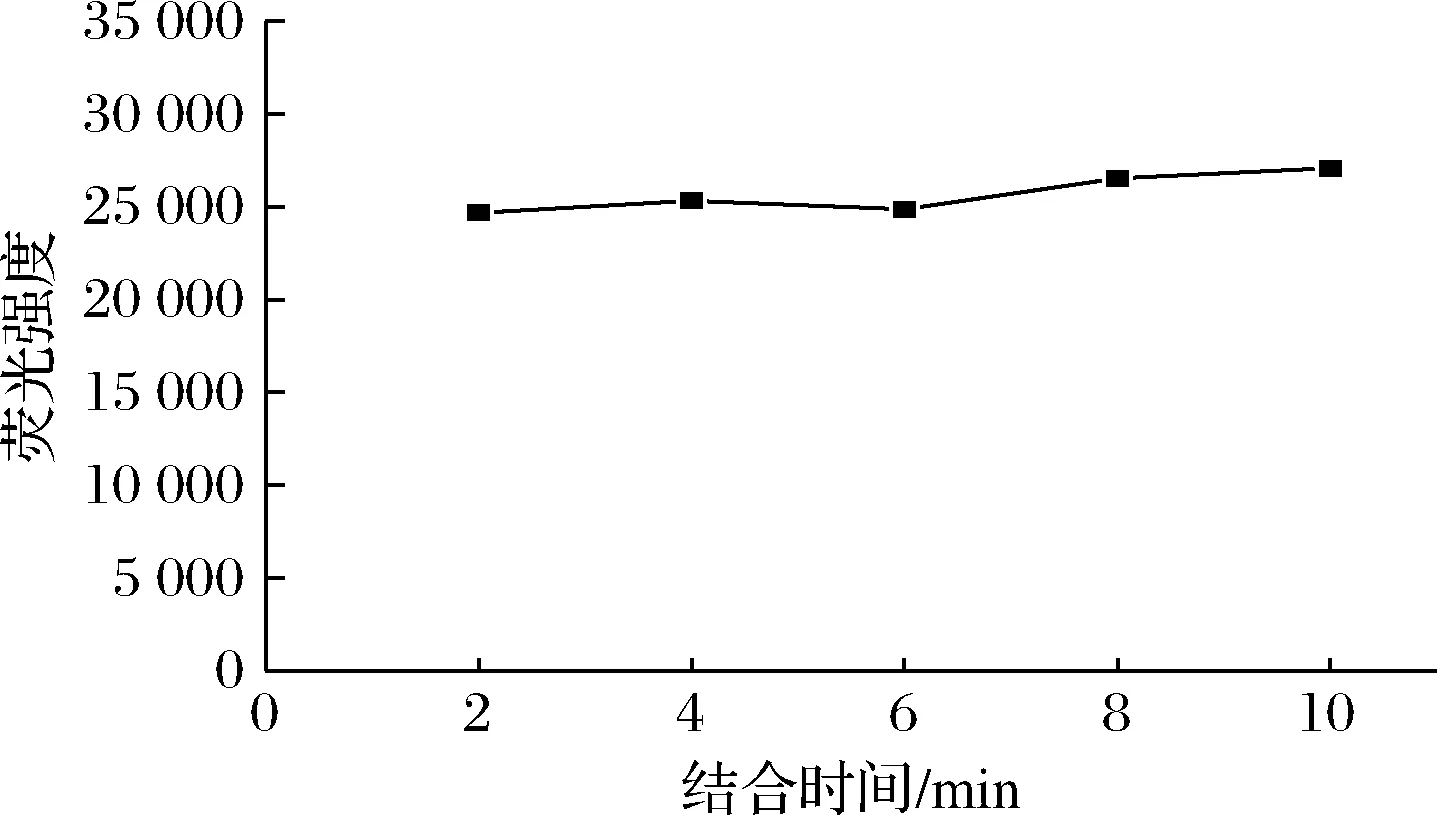
图3 结合时间的优化
2.3 适配体-金刚烷胺孵育时间的优化
适配体和金刚烷胺孵育时间的长短会影响检测的效率,因此需对适配体-金刚烷胺孵育时间进行优化。结果如图4所示,孵育0~10 min时,随着时间的延长,对照组与实验组在530 nm处荧光强度的差值逐渐上升,在孵育时间为10 min时,荧光强度的差值达到最大,并且随着时间的延长荧光强度的差值不会继续增加。说明10 min时金刚烷胺引起的荧光变化已达到饱和,而且孵育时间过长会降低检测的效率,因此10 min为适配体和金刚烷胺的最佳孵育时间。

图4 孵育时间的优化
2.4 金刚烷胺的定量检测
在优化的最佳实验条件下,利用SGI荧光染料的特性,探究不同浓度金刚烷胺与荧光强度变化之间的关系。由图5可知,金刚烷胺质量浓度在1~100 ng/mL 时,荧光强度的差值(y)与金刚烷胺质量浓度(x)呈良好的线性关系,随着金刚烷胺浓度的增加,体系荧光强度差值也同比增加,校正后的线性方程为:y=51.31x+156.75(R2=0.992 5),最低检出限(S/N=3)为0.84 ng/mL。
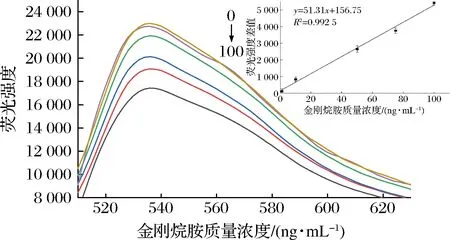
图5 不同质量浓度金刚烷胺荧光光谱图及金刚烷胺浓度与荧光强度差值的关系曲线
2.5 加标回收实验
为探究该方法在实际样品检测中的实用性,对牛奶样品进行了加标回收实验,结果如表1所示,加标回收实验的回收率在93.22%~104.86%,说明该方法较好的准确性,因此可用于实际样品的检测。
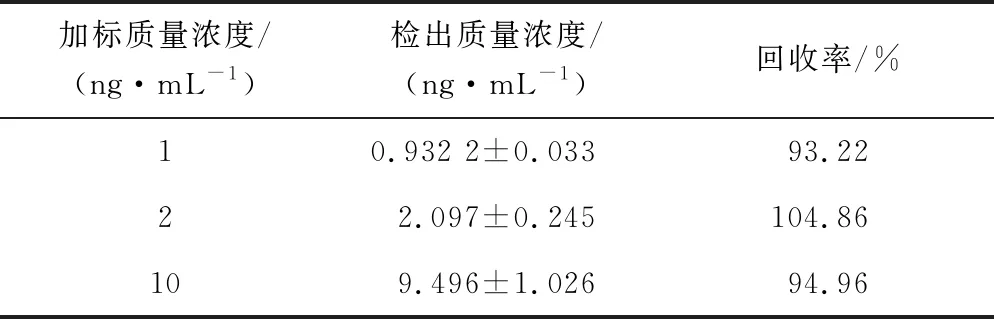
表1 牛奶样品的加标回收率
2.6 特异性验证
为验证该方法对于金刚烷胺的特异性,向检测体系中加入相同浓度的金刚烷胺结构类似物及共存物(金刚乙胺、美金刚胺、阿昔洛韦、利巴韦林以及吗啉双胍),在最优条件下进行实验,并对各个物质引起的荧光强度的差值与金刚烷胺引起的荧光强度差值的比率进行比较,如图6所示,金刚烷胺引起的荧光强度变化远远高于其他5种物质,表明该检测方法对于金刚烷胺具有良好的特异性。

图6 检测方法特异性
3 结论
利用SYBR Green I荧光染料与核酸适配体构建了一种快速检测金刚烷胺的荧光传感技术。相对于传统的色谱分析法和酶免疫法,该方法无需化学标记,选用的适配体易于制备,检测过程操作简便、耗时短、效率高,检测方法特异性强,且在实际样品的检测中表现出较高的灵敏度,说明其在食品安全检测中具有实用性。本研究方法为食品中金刚烷胺兽药残留的检测提供了参考,同时也为构建食品中其他小分子危害物的检测方法提供了思路。