基于COF@CNTs/Bi修饰玻碳电极的电化学法测定水中痕量Pb2+和Cd2+
2021-11-29贾旭峰吴晓红程欲晓
贾旭峰,张 多,吴晓红,程欲晓,谢 韬,许 贺*
(1.东华大学 环境科学与工程学院,上海 201620; 2.上海海关工业品与原材料检测中心,上海 200002)
Pb2+和Cd2+是典型的重金属元素,具有可积累性,在生态系统中会随着食物链的作用进入到人体[1]。高浓度的Pb2+和Cd2+会损害神经细胞、肝脏、肾脏和生殖系统等[2],对人体健康产生严重危害。国家标准GB 5749-2006《生活饮用水卫生标准》规定饮用水中Pb2+和Cd2+的限值分别为10μg·L-1和5μg·L-1。因此,建立一种快速、灵敏、操作简便的痕量Pb2+和Cd2+的测定方法,对于环境保护和人类健康具有重要意义。
目前,Pb2+和Cd2+的测定方法有光谱法[3]、质谱法[4]、分光光度法[5]以及电化学法[6]等。光谱法选择性强、灵敏度高,但是样品前处理过程复杂,且线性范围窄;质谱法虽然检出限低、灵敏度高,但是成本高,检测时间较长;分光光度法灵敏度高、仪器设备简单,但是结果准确度较低;而电化学法不仅具有灵敏度高、检出限低的优点,同时还具有快速准确、成本低廉、操作简便和微型化的优势,弥补了上述几种方法的不足[7]。因此,电化学法在检测重金属离子领域具有良好的发展前景。
共价有机骨架(COFs)材料是一类新型的环境修复吸附材料[8],它由轻质元素组成的有机单元通过共价键连接而成[9]。特别是含有氨基(-NH2)的COFs具有优异的吸附和螯合性能,在气体吸附存储[10]、光催化[11]、传感[12]和多相催化[13]等方面应用广泛。根据酸碱理论,Pb2+、Cd2+与COFs上氧原子或氮原子可通过配位键[14]形成稳定的金属复合物,同时引入高电导率材料,有利于构建重复性和重现性良好的COFs电化学传感器[12]。碳纳米管(CNTs)也被称为圆柱形富勒烯,是一种具有极薄管状结构的纳米材料,具有稳定性高、电导率高、比面积大等优点,可用作灵敏传感材料,在电化学分析检测方面应用广泛[15]。另外,Bi3+是一种环境友好型电极材料,能够与Pb2+、Cd2+同时电沉积,形成二元“合金”,提高了溶液中Pb2+和Cd2+的富集效率,对检测痕量Pb2+和Cd2+表现出优异的电化学性能。本工作通过制备COF、COF@CNTs,采用阳极溶出伏安法得到COF@CNTs/Bi修饰的玻碳电极,建立了基于COF@CNTs/Bi修饰玻碳电极的电化学法测定水中痕量Pb2+和Cd2+的方法。该电极合成方法简单、成本低、灵敏度高、重现性好,能够实现对Pb2+、Cd2+的同时检测,在电化学传感器领域内具有一定的应用价值。
1 试验部分
1.1 仪器与试剂
CHI760E型电化学工作站;JP-008型超声波清洗仪;S-4800型扫描电子显微镜(SEM)和能量色散X射线光谱(EDS)仪;X85-2S型磁力搅拌器。
乙酸-乙酸钠缓冲液(p H 4.5):称取8.200 0 g无水乙酸钠,加入10 mL乙酸,用水稀释并定容至1 L容量瓶中,配制成0.1 mol·L-1的乙酸-乙酸钠缓冲液。
Pb2+标准储备溶液:0.1 g·L-1,称取16.00 mg硝酸铅,用0.1 mol·L-1乙酸-乙酸钠缓冲液稀释并定容至100 mL容量瓶中,配制成质量浓度为0.1 g·L-1的 Pb2+标准储备溶液。使用时,用0.1 mol·L-1乙酸-乙酸钠缓冲液稀释至所需质量浓度。
Cd2+标 准 储 备 溶 液:0.1 g· L-1,称 取27.40 mg四水合硝酸镉,用0.1 mol·L-1乙酸-乙酸钠缓冲液稀释并定容至100 mL容量瓶中,配制成质量浓度为0.1 g·L-1的Cd2+标准储备溶液。使用时,用0.1 mol·L-1乙酸-乙酸钠缓冲液稀释至所需质量浓度。
Bi3+标准储备溶液:1 g·L-1,称取116.06 mg五水合硝酸铋,用0.1 mol·L-1乙酸-乙酸钠缓冲液稀释并定容至50 mL容量瓶中,配制成质量浓度为0.1 g·L-1的 Bi3+标准储备溶液。使用时,用0.1 mol·L-1乙酸-乙酸钠缓冲液稀释至所需质量浓度。
Bi3+、Pb2+、Cd2+混合 标 准溶液 系 列:移取0.1 mol·L-1乙酸-乙酸钠缓冲液10 mL,加入4μL Bi3+标准储备溶液和适量的Pb2+、Cd2+标准储备溶液,配制成Bi3+质量浓度为400μg·L-1,Pb2+、Cd2+质量浓度均为1,5,10,20,40,50,100,200,300,400,500μg·L-1的混合标准溶液系列。
[Fe(CN)6]3-/4-溶 液:称 取 亚 铁 氰 化 钾0.528 0 g、铁氰化钾0.411 6 g和氯化钾1.864 0 g,用水稀释,并定容至250 mL容量瓶中,配制成5 mmol·L-1的[Fe(CN)6]3-/4-溶液(其中,氯化钾的浓度为0.1 mol·L-1)。
硝酸、乙酸、无水乙酸钠、铁氰化钾、亚铁氰化钾、氯化钾、四水合硝酸镉、硝酸铅、五水合硝酸铋、三氧化二铝粉末、二甲基亚砜(DMSO)、对苯二甲酸二醛(TPA)、1,3,5-三(4-氨基苯基)苯(TAPB)、N,N-二甲基甲酰胺(DMF)、单壁CNTs、无水乙醇均为优级纯;试验用水为去离子水。
1.2 仪器工作条件
1.2.1 循环伏安法
以不同材料修饰的玻碳电极为工作电极,Ag/AgCl为参比电极,铂丝为辅助电极;电解质为5 mmol·L-1的[Fe(CN)6]3-/4-溶液;扫描范围-0.2~0.8 V。
1.2.2 阳极溶出伏安法
富集过程:以COF@CNTs修饰的玻碳电极为工作电极,Ag/AgCl为参比电极,铂丝为辅助电极;电解质为含Bi3+、Pb2+、Cd2+的混合标准溶液;沉积电位-1.4 V;富集时间360 s。
溶出过程:富集Pb2+和Cd2+结束后,静置20 s,在电压范围-0.8~-0.2 V内进行扫描,记录Pb2+和Cd2+的溶出峰电流;再于0.2 V下,清洗电极30 s,除去电极表面残留的物质。
1.3 试验方法
1.3.1 COF、COF@CNTs的制备
称取 CNTs 0.1 g,加入25 mL DMSO,超声10 min;再加入 TPA 0.02 g和 TAPB 0.035 g,超声5 min;接着加入2 mL 12 mol·L-1乙酸溶液,超声10 min。收集绿色固体,加入10 mL DMF和10 mL无水乙醇,以转速500 r·min-1离心5 min,重复洗涤3次,干燥,得到COF@CNTs。同法制备COF,只是不加入CNTs。
1.3.2 玻碳电极的预处理
将玻碳电极在 W7金相砂纸上磨平后,用0.05μm Al2O3悬浊液在麂皮上打磨抛光,并依次用20 mL的50%(体积分数)硝酸溶液、无水乙醇和水超声5 min,晾干后待用。
1.3.3 COF、COF@CNTs工作电极的制备
称取1 mg COF或COF@CNTs,分别加入5 mL DMF,超声10 min,得到悬浮液。移取5μL悬浮液,滴涂在处理后的玻碳电极表面,置于红外灯下,使溶剂挥发[16],得到COF、COF@CNTs工作电极。
1.3.4 COF@CNTs/Bi工作电极的制备
按1.2.2节富集过程进行试验,得到COF@CNTs/Bi工作电极。
1.3.5 Pb2+和Cd2+的测定
取待测水样5 mL,加入5 mL乙酸-乙酸钠缓冲液和4μL Bi3+标准储备溶液,再用乙酸将溶液p H调至4.5。以COF@CNTs为工作电极,Ag/AgCl为参比电极,铂丝为辅助电极,将该三电极体系置于上述溶液中,按照1.2.2节进行试验,得到Pb2+、Cd2+的溶出峰电流[17]。
2 结果与讨论
2.1 COF、COF@CNTs和COF@CNTs/Bi的形貌表征
COF、COF@CNTs、COF@CNTs/Bi的SEM图以及COF@CNTs/Bi的EDS图见图1。
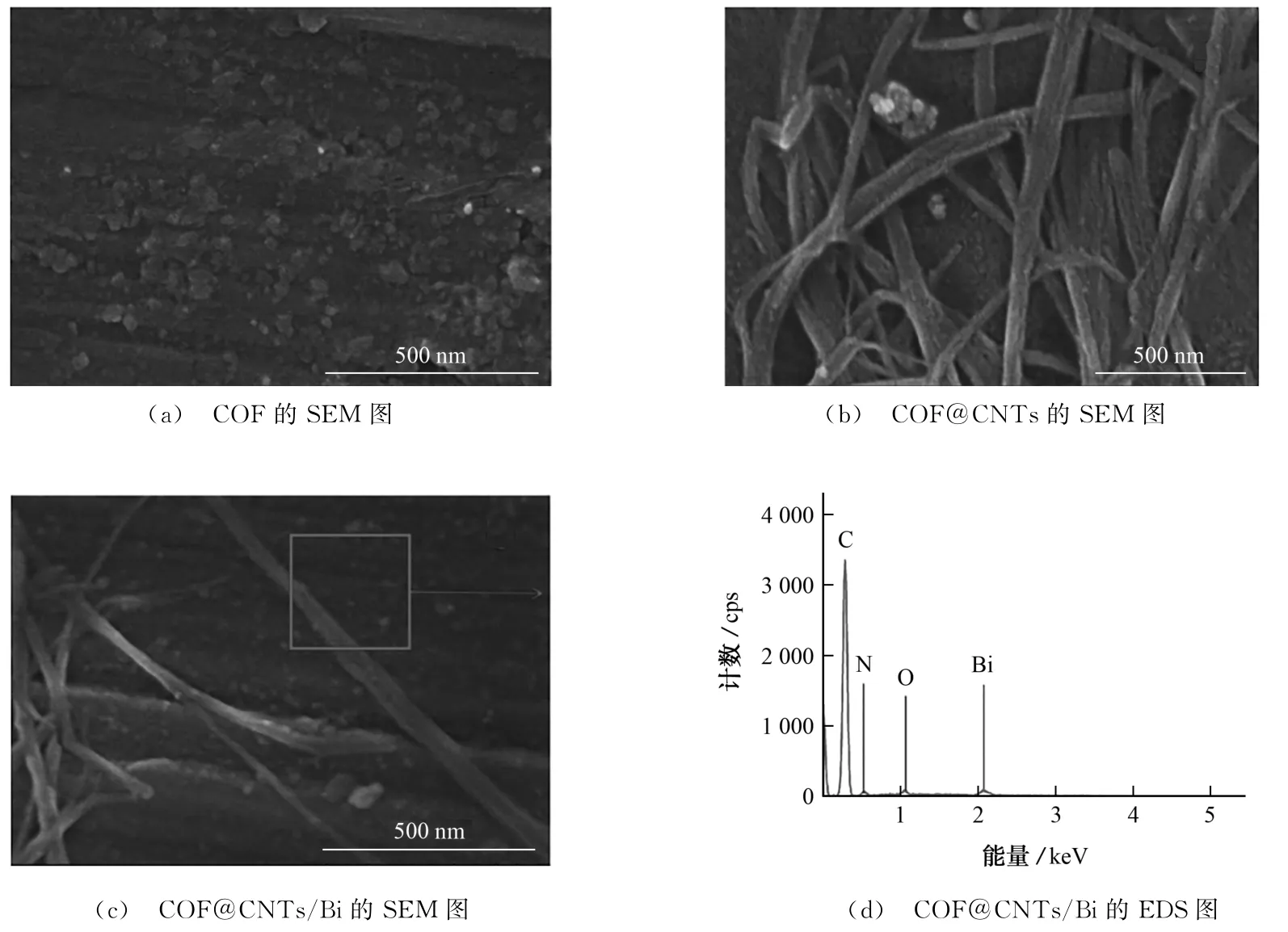
图1 COF、COF@CNTs和COF@CNTs/Bi的形貌表征Fig.1 Morphology characterization of COF,COF@CNTs and COF@CNTs/Bi
图1(a)显示,COF表面较为粗糙;图1(b)显示,COF中成功掺入CNTs,形成了COF@CNTs;图1(c)显示,Bi均匀分布在COF@CNTs表面,形成COF@CNTs/Bi复合材料,并且图1(d)进一步证明Bi成功沉积于COF@CNTs表面上。
2.2 COF、COF@CNTs和COF@CNTs/Bi电极的电化学表征
按照 1.2.1 节 考 察 了 5 mmol· L-1[Fe(CN)6]3-/4-溶 液 在 COF、COF@CNTs 和COF@CNTs/Bi电极上的循环伏安曲线,结果见图2。
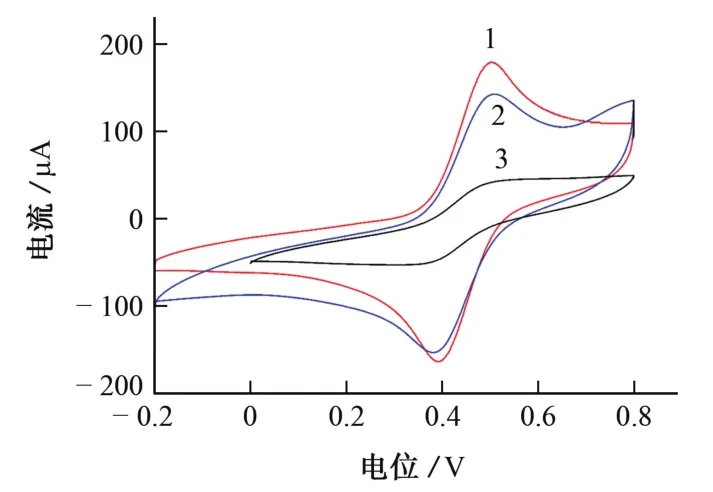
图2 不同电极的循环伏安曲线Fig.2 Cyclic voltammetry curves on different electrodes
由图2可知:COF电极的峰电流较小,表明COF导电性较差,抑制了电子转移;COF@CNTs电极的峰电流明显增大,在0.4,0.5 V附近观察到Fe2+/Fe3+的氧化还原峰,表明CNTs的加入提高了COF电极的电子转移能力,改善了其电化学性能;修饰Bi后,增强了电极的表面活性,COF@CNTs/Bi电极的氧化还原峰电流明显增大。根据Randles-Sevcik公式ip=2.69×105AD1/2n3/2γ1/2C计算3个电极的活性面积。式中,A为电极面积,cm2;D为扩散系数,cm2·s-1;γ为扫描速率,V·s-1;n为氧化还原中的电子转移数;C为溶液浓度,mol·L-1。
结果显示,COF、COF@CNTs、COF@CNTs/Bi电极的活性面积分别为1.26×10-2,4.28×10-2,5.39×10-2cm2,表明COF@CNTs/Bi电极具有更大的活性面积和更好的电化学性能,有利于痕量Pb2+和Cd2+的测定。
2.3 Pb2+和Cd2+的电化学行为
移取适量的Bi3+、Pb2+、Cd2+标准储备溶液,用0.1 mol·L-1乙酸-乙酸钠缓冲液稀释,配制成Bi3+质量浓度为400μg·L-1,Pb2+、Cd2+质量浓度均为100μg·L-1的混合标准溶液。按照1.2.2节溶出过程进行试验,考察了不同电极在上述溶液中的溶出峰电流,结果见图3。

图3 不同电极的溶出伏安曲线Fig.3 Stripping voltammetry curves on different electrodes
由图3可知:COF、COF@CNTs电极对Pb2+和Cd2+的溶出峰电流较弱;Bi、CNTs/Bi电极对Pb2+和Cd2+的溶出峰电流明显提高;COF@CNTs/Bi电极对Pb2+和Cd2+的溶出峰电流提高幅度更大,溶出电位分别为-0.34,-0.57 V。表明 COF、CNTs、Bi3+三者协同作用,提高了COF@CNTs/Bi电极对Pb2+和Cd2+的富集效果和溶出电流。
2.4 富集时间的优化
以Bi3+质量浓度为400μg·L-1,Pb2+、Cd2+质量浓度为100μg·L-1的混合标准溶液为电解质,按照1.2.2节,试验考察了富集时间分别为180,240,300,360,420 s时对Pb2+和Cd2+溶出峰电流的影响,结果见图4。
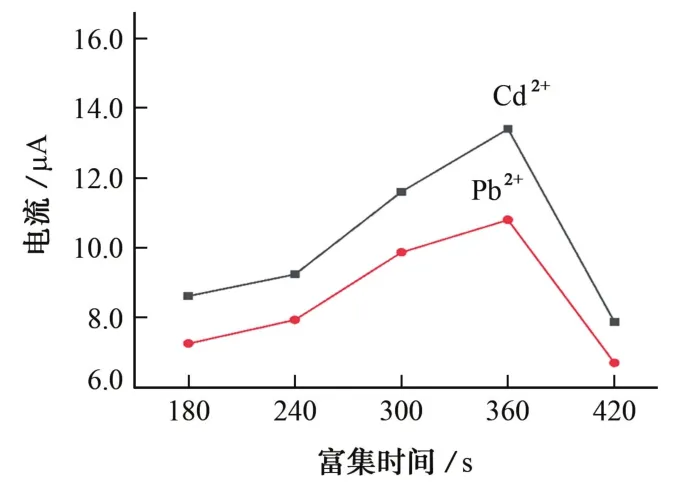
图4 富集时间对Pb2+和Cd2+溶出峰电流的影响Fig.4 Effect of preconcentration time on stripping peak currents of Pb2+and Cd2+
由图4可知:当富集时间为180~360 s时,随着富集时间的延长,Pb2+和Cd2+的溶出峰电流逐渐增大;当富集时间为360 s时,Pb2+和Cd2+均达到较大的溶出峰电流;继续延长富集时间,Pb2+和Cd2+的溶出峰电流急剧下降,说明富集一定时间后,COF@CNTs/Bi对Pb2+和Cd2+的吸附达到饱和,富集时间过长,Bi3+会抑制COF@CNTs对Pb2+和Cd2+的吸附,导致电极上的活性位点减少,从而影响Pb2+和Cd2+的溶出峰电流。因此,试验选择富集时间为360 s。
2.5 沉积电位的优化
以Bi3+质量浓度为400μg·L-1,Pb2+、Cd2+质量浓度为100μg·L-1的混合标准溶液为电解质,按照1.2.2节,试验考察了沉积电位分别为-1.5,-1.4,-1.3,-1.2,-1.1 V 时对 Pb2+和Cd2+溶出峰电流的影响,结果见图5。
由图5可知,当沉积电位为-1.4 V时,Pb2+和Cd2+的溶出峰电流较大。这可能是由于沉积电位较小时,有其他离子干扰,而沉积电位较大时,Pb2+和Cd2+还原不彻底,导致溶出峰电流明显减弱,因此试验选择沉积电位为-1.4 V。
2.6 标准曲线和检出限
按照1.2.2节对Bi3+、Pb2+、Cd2+混合标准溶液系列进行测定。以Pb2+或Cd2+的质量浓度为横坐标,其对应的溶出峰电流为纵坐标绘制标准曲线。结果显示,Pb2+和Cd2+的质量浓度均在500μg·L-1以内与其对应的溶出峰电流呈线性关系,线性回归方程分别为y=5.120×10-2x+3.099和y=5.160×10-2x+3.506,相关系数分别为0.996 6和0.995 1。
以3倍信噪比(S/N)计算检出限(3S/N),结果得Pb2+和Cd2+的检出限均为0.33μg·L-1,低于GB 5749-2006中Pb2+和Cd2+的限值。
2.7 精密度试验
按照1.3.4节制备6个相同的COF@CNTs/Bi电极,并对100μg·L-1的Pb2+和Cd2+混合标准溶液进行测定,测定值的相对标准偏差(RSD)为4.5%,表明COF@CNTs/Bi电极的再现性较好。
按照1.2.2节,用 COF@CNTs/Bi电极对100μg·L-1Pb2+和Cd2+的混合标准溶液平行测定5次,测定值的RSD为3.9%,表明该方法的重现性较好。
2.8 稳定性试验
按照1.2.2节,用储存7,10 d的COF@CNTs/Bi电极对100μg·L-1Pb2+和Cd2+混合标准溶液进行测定。结果显示,Pb2+和Cd2+的溶出峰电流保持在原来的95%,93%左右,表明COF@CNTs/Bi电极具有较好的稳定性。
2.9 干扰试验
在50μg·L-1的Pb2+、Cd2+中加入一定量的Na+、K+、Ag+、Ca2+、Cu2+、Ni2+、Hg2+、Zn2+混合标准溶液,按照1.2.2节,用COF@CNTs/Bi电极进行测定,考察上述离子对Pb2+和Cd2+测定结果的影响。结果表明,100倍的Na+、K+、Ag+、Ca2+、Ni2+、Zn2+,90倍的 Cu2+、Hg2+对 Pb2+和 Cd2+的测定不产生干扰,加入干扰离子前后所得测定值的相对误差在±6%内,表明COF@CNTs/Bi电极具有一定的抗干扰能力。
2.10 回收试验
按照1.3.4节对自来水和湖水样品进行3个浓度水平的加标回收试验,计算回收率,结果见表1。
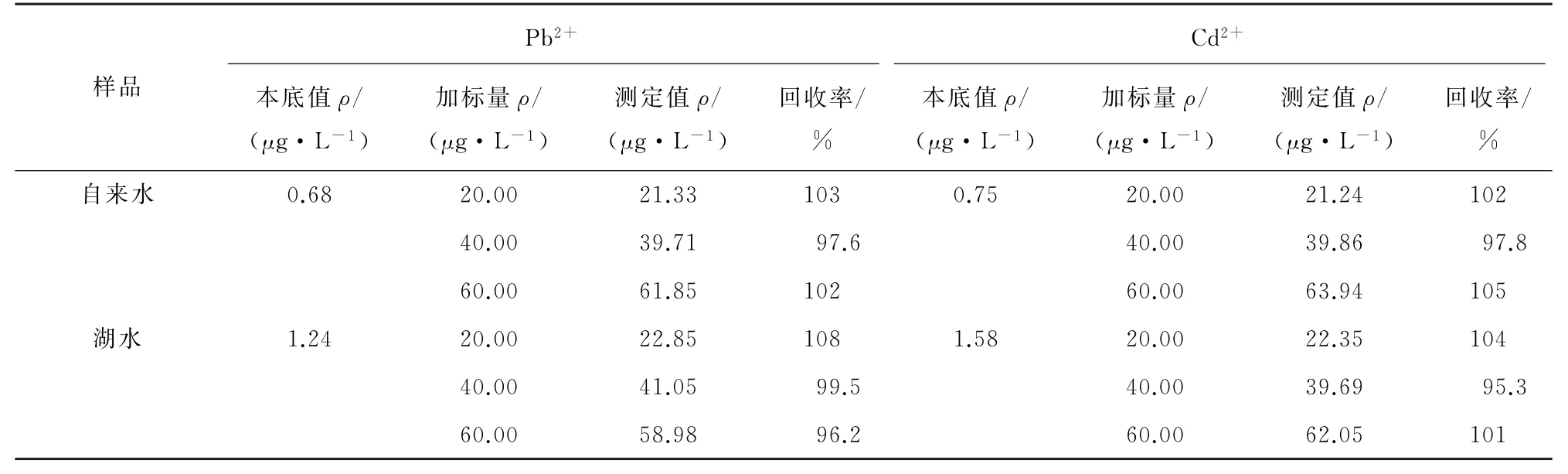
表1 回收试验结果Tab.1 Results of test for recovery
由表1可知,Pb2+的回收率为96.2%~108%,Cd2+的回收率为95.3%~105%,表明该方法准确可靠,能够测定实际水样中的痕量Pb2+和Cd2+。
2.11 方法比对
将本法所得的线性范围和检出限与文献报道采用其他电极所得参数进行对比,结果见表2。

表2 不同电极对比结果Tab.2 Comparison of results by the different electrodes μg·L-1
结果表明,COF@CNTs/Bi电极具有更宽的线性范围和更低的检出限,对于测定痕量Pb2+和Cd2+具有一定的应用价值。
本工作采用“一锅法”快速合成COF,并掺杂导电性良好的CNTs,通过同位镀铋的方式电沉积Bi3+,制备了COF@CNTs/Bi修饰的玻碳电极,基于COF@CNTs/Bi电极对Pb2+、Cd2+的电化学响应,建立了电化学法测定Pb2+、Cd2+含量的方法。该方法具有较宽的线性范围、较低的检出限、良好的稳定性和抗干扰能力,适用于实际水样中Pb2+和Cd2+的痕量分析。
