金钱鱼(Scatophagus argus)体色发育及黑斑的形成过程*
2021-11-27林晓展张俊鹏石红娟李广丽田昌绪
林晓展 张俊鹏 黄 洋, 2 石红娟, 2 李广丽, 2 田昌绪, 2
金钱鱼()体色发育及黑斑的形成过程*
林晓展1张俊鹏1黄 洋1, 2石红娟1, 2李广丽1, 2田昌绪1, 2①
(1. 广东海洋大学水产学院 广东省名特优鱼类生殖调控与繁育工程技术研究中心 湛江 524088; 2. 南方海洋科学与工程广东省实验室(湛江) 湛江 524088)
鱼类的体色图案作为外部形态最显著的特征之一, 在动物生存与物种间的交流中起着重要作用。为探究金钱鱼()体色发育及黑斑的形成过程, 首先对成年金钱鱼鳍条中色素细胞进行显微观察, 采用Olympus体视解剖镜观察了金钱鱼从胚胎色素形成期到仔鱼后期体表色素细胞的种类与分布特征, 并跟踪观察了金钱鱼从稚鱼期到成鱼期主要图案黑斑的形成过程, 同时对成年金钱鱼的黑斑和非黑斑皮肤进行透射电镜切片观察。结果显示, 构成金钱鱼体色共四种色素细胞, 分别为: 黑色素细胞、黄色素细胞、虹彩色素细胞和红色素细胞, 黑色素细胞在胚胎发育阶段最早发生, 黄色素细胞和红色素细胞次之, 而虹彩色素细胞发生最晚, 直到仔鱼后期阶段才观察到。金钱鱼体色仔鱼期(0—24 dph)出现了有趣的变化过程: 在0 dph (day post hatching)仔鱼体色较浅到1 dph仔鱼体色明显加深, 而2—7 dph仔鱼的躯干部体色出现明显的褪黑现象, 在8—24 dph阶段金钱鱼体色又出现了明显的复黑现象, 并且在24 dph时通体发黑, 在30 dph时虹彩色素细胞在皮肤中的大量出现并形成隐约可见的色素条带, 直到幼鱼阶段(50 dph)形成清晰的黑色纵带条纹后不断演变成多个黑斑并在成年金钱鱼中稳定沉积的过程。透射电镜结果发现皮肤中黑色素细胞和虹彩色素细胞数量最多, 分布最广。黑斑形成的关键原因是黑素小体和黑色素细胞大量聚集, 虹彩色素细胞在其周围大量聚集并形成明显的包围界限。追踪观察了金钱鱼从胚胎色素发育、前期仔鱼、后期仔鱼、稚鱼、幼鱼和成鱼共六个阶段的色素沉积和体色变化过程, 为金钱鱼野生群体的年龄鉴定提供了参考, 并为进一步的金钱鱼体色改良提供理论指导。
金钱鱼; 体色发育; 褪黑现象; 复黑现象; 黑斑形成
鱼类的体色模式因功能而异, 主要表现为具有同类相互识别的集群行为, 产生婚姻色的繁殖行为和产生模拟色或保护色以躲避敌害或捕食等行为(Randall, 2005)。鱼类体色受众多因素的影响, 其中最重要的是自身遗传的影响。鱼类的色素细胞由神经嵴细胞分化而来, 随着胚胎的发育以及神经嵴细胞在神经管封闭后, 迁移到鱼类的皮肤、眼睛等感光器官处并形成前色素细胞, 最后分化为不同种类的色素细胞(Kelsh, 2004; 于道德等, 2012)。而色素细胞是鱼类体色模式形成的决定性因素, 并取决于皮肤、鳞片和鱼鳍中色素细胞的种类、数量、密度、分布以及排列方式。另外, 鱼类在不同的发育时期拥有不同的体色模式, 例如早期仔鱼阶段具有明显的种属特征, 可帮助对鱼类的分类; 而幼体色素和成体色素替换阶段称为变态发育阶段, 为鱼类体色模式正式步入成鱼期做准备。虽然体色主要由基因遗传决定, 通常在环境稳定的情况下不会轻易发生变化, 但只要鱼类感受到环境的变化及压力, 其体色同样发生生理性改变(杨纪明, 2000)。另外, 许多鱼类的图案都倾向于背部色素深而腹部色素浅, 这种反隐蔽图案使鱼类完美的隐藏在较明亮的下辐射光与较暗的上辐射光之间, 有利于鱼类适应海洋环境并保护鱼类种群的顺利繁衍(Ruxton, 2004)。
金钱鱼(Linnaeus 1766)隶属鲈形目(Perciformes)、金钱鱼科(Scatophagidae)、金钱鱼属(), 俗名金鼓鱼(黄宗国, 1994)。金钱鱼分布及生存水域极其广泛, 在印度-太平洋区的淡水、咸淡水和海水均有分布, 在我国主要分布于东南沿海(Barry, 1992; 杨尉等, 2018)。该物种体型优美, 性情温顺, 是一种兼具观赏性和食用价值的名贵海水经济鱼类。与其他鱼类相比, 金钱鱼外形有很多独特之处, 其身体左右两侧对称分布有大小不一的黑色斑点, 特别像金钱状, 故被称为金钱鱼(Lin, 2021)。不同发育阶段的金钱鱼体色差异较大, 可作为判断其生长年龄的依据, 特别是对自然河口及海岸口捕捞到的鱼苗跟成鱼的鉴定, 有利于判断该水域金钱鱼种群所处的发育阶段。因此, 研究金钱鱼的不同发育阶段系统的体色变化过程及黑斑的形成显得尤为重要。目前有关金钱鱼受精卵胚胎发育和胚后不同发育阶段的形态特征已有学者进行了初步观察和描述(蔡泽平等, 2014; 徐嘉波等, 2016), 但对金钱鱼的不同发育阶段体色变化尚未见系统研究。
本研究观察了金钱鱼从胚胎色素形成期到仔鱼后期体表色素细胞的种类与分布特征, 以及从稚鱼期到成鱼期主要图案黑斑的形成过程, 同时对成年金钱鱼的黑斑和非黑斑皮肤进行透射电镜切片观察, 探索金钱鱼从胚胎到成鱼阶段色素沉积及黑斑模式形成的规律。
1 材料与方法
1.1 亲鱼来源
金钱鱼亲鱼饲养于广东海洋大学生物研究基地(湛江), 2—3龄, 繁殖群体为30尾, 雌、雄各占一半, 成对的亲鱼放在500 L的塑料桶中。通过投喂肥满度较高的生蚝进行营养强化培育, 并通过人工生殖调控促性腺发育, 直到自然产卵。
1.2 金钱鱼成体鳍条的显微观察
实验取样前先采用MS-222麻醉剂对金钱鱼进行麻醉, 待金钱鱼不继续跳动后再用高压蒸汽灭菌锅消毒过的剪刀、镊子分别剪取金钱鱼的背鳍鳍条、胸鳍鳍条、腹鳍鳍条、臀鳍鳍条和尾鳍鳍条, 放在滴有浓度为0.1 mol/L磷酸盐缓冲液(PBS, pH=7.4)的载玻片上进行显微观察。
1.3 受精及孵化与培育
取受精卵放入500L持续充氧的塑料桶中孵化和培育, 作为胚胎发育过程和后期仔鱼不同发育阶段的活体观测材料。金钱鱼的受精卵孵化期间及胚后发育阶段, 每天的换水量在20%—50%之间, 水温29.0—32.0 °C, 盐度28—31, pH 8.0—8.5。金钱鱼仔鱼在开口时主要以小型轮虫幼体为食, 并随着其生长发育及时调整饵料个体的种类、大小和投放密度。待金钱鱼仔鱼生长发育到5日龄时将它们整体转移到室内池塘中培养, 后期的稚鱼和幼鱼作为观察体色变化时随机采取的活体样本, 每个阶段的样本数量为15尾。
1.4 观察方法
定期取样, 使用适量MS-222麻醉后观察。使用Olympus体视显微镜(奥林巴斯, 日本)观察个体发育情况, 记录发育各时期的形态特征、色素细胞的形态及分布规律。用Nikon专业显微数码CCD DP72 (日本电子株式会社, 日本)进行显微拍照观察。
1.5 皮肤组织的透射电镜切片的制作
成年1龄金钱鱼用MS-222麻醉安乐死, 分别撕取背部黑斑和非黑斑皮肤组织, 取体积小于1 mm3皮肤组织, 快速放入2.0%戊二醛中, 4 °C固定10 h以上。0.2 mol/L PBS (pH=7.2)清洗三次, 10 min/次。1%锇酸固定液固定2 h后, 0.2 mol/L PBS清洗三次, 每次10 min。经10%、20%、30%、50%、70%、90%、100%丙酮梯度脱水, 环氧丙烷置换10 min后, 环氧树脂Epon812浸透包埋。EMUC6超薄切片机切片, 醋酸双氧铀染色2 h或过夜。用日本电子JEM-1400透射电子显微镜观察并拍照。
1.6 数据与图像处理
使用Excel 2016对形态学数据进行统计分析, 所得数据以平均值±标准差(mean±SD)表示。用Photoshop 2020和Adobe Illustrator CS6对拍摄的照片进行裁剪、拼接和编排。
2 结果与分析
2.1 金钱鱼鱼鳍色素细胞的观察
金钱鱼的五种鱼鳍(背鳍、胸鳍、腹鳍、臀鳍和尾鳍)中都观察到黑色素细胞、黄色素细胞和虹彩色素细胞, 说明这三种色素细胞在金钱鱼的体色形成中占据主导地位, 而发现背鳍中红色素细胞带明显, 其他鳍中没有观察到红色素细胞, 只有背鳍中同时具有四种色素细胞类型, 如图1 (1a, 2a)。金钱鱼的五种鱼鳍中的黑色素细胞主要有以下两种不同的形态: 其中, 一种体积较大, 且细胞的分枝状突起向四周发散; 而另一种体积较小, 呈收缩型团块状, 很少看到分枝状突起。金钱鱼的胸鳍和腹鳍中的黑色素细胞都沿着鳍条与鳍条之间相对有规律的排列着, 背鳍、臀鳍和尾鳍的黑色素细胞体积相对较大, 与分枝状凸起较多且长也存在一定关系, 这类黑色素细胞比起团块状类型要成熟得多, 所处位置颜色较深。其中, 数尾鳍中的黑色素细胞分枝状凸起最丰富, 如图1 (1e, 2e); 黄色素细胞和红色素细胞体积较黑色素细胞小, 处于黑色素细胞底下或者间隙中, 但颜色较鲜艳, 显微镜下发光发亮的部位是虹彩色素细胞明显聚集的地方, 呈现出银白色和淡蓝色, 如图1 (1a, 2a)。金钱鱼的背、臀、尾鳍中的黑色素细胞和黄色素细胞相对于胸鳍和腹鳍而言, 数量更多, 密度更大, 这也更好地解释了金钱鱼体色的主色调为黑色和黄色。

注: 1a, 2a. 背鳍; 1b, 2b. 腹鳍; 1c, 2c. 臀鳍; 1d, 2d. 胸鳍; 1e, 2e. 尾鳍。M. 黑色素细胞; Ir. 虹彩色素细胞; X. 黄色素细胞; E. 红色素细胞
2.2 金钱鱼胚胎发育过程色素变化
金钱鱼受精卵的直径为(0.55±0.03) mm, 受精卵孵化水体的温度为(30.0±0.5) °C、盐度28—31、pH 8.0—8.5。胚后发育约7.5 h, 受精卵胚体开始出现黑色素细胞, 呈点状(图2a)。胚后发育约9.0 h, 胚胎发育至眼囊期, 此时胚体上黑色素细胞的数量增加, 主要分布在躯干部、油滴和卵黄囊膜上, 少部分游离到细胞液中; 此时的黑色素细胞形态多以点状为主, 未见任何分枝状(图2b)。胚后发育约13.0 h, 黄色素细胞和红色素细胞出现在躯干腹侧, 无论在数量上还是位置上皆无明显变化, 而此时黑色素细胞已经从点状发展为分枝状, 且其在油球上轮廓清晰(图2c)。胚后发育约14.0 h能明显观察到尾芽, 有规律的振动(图2d)。胚后发育约14.5 h, 初孵仔鱼完成出膜。
2.3 前期仔鱼色素细胞发育与体色变化
0 dph: 刚破膜孵出的仔鱼全长(1.52±0.02) mm (图3, 0 dph), 卵黄囊较大, 呈椭圆形, 长度超过体长的1/2; 油滴位于卵黄囊中间。此时仔鱼最明显的特点是除了尾部之外通体发黑, 黑色素细胞主要分布于眼囊、脊索、腹部和油滴上, 黑色素细胞呈较明显的分枝状, 且油滴上的黑色素细胞均匀的向四周伸展, 像雪花状。黄色素细胞和红色素细胞在身体的头部和躯干部有零星分布, 但不是很明显, 基本被黑色素细胞遮挡。卵黄囊仔鱼基本没有游泳能力, 只能通过尾巴摆动做身体旋转(图4, 0 dph-1, 0 dph-2, 0 dph-3)。
1 dph: 仔鱼全长(2.13±0.04) mm (图3, 1 dph), 此时仔鱼头部上抬, 卵黄囊和油滴明显吸收后变小紧贴仔鱼腹部, 发育出较明显的头部, 躯干部和尾部, 躯干其他部位的色素开始密集化, 且黑色素细胞和红色素细胞的数量明显增多, 颜色加深, 尾部跟头部的红色素细胞呈分枝状。仔鱼腹鳍芽基出现, 背鳍膜大大增高, 胸鳍芽基隐约出现, 有一定游动能力, 肛门前端移动且形状清晰。
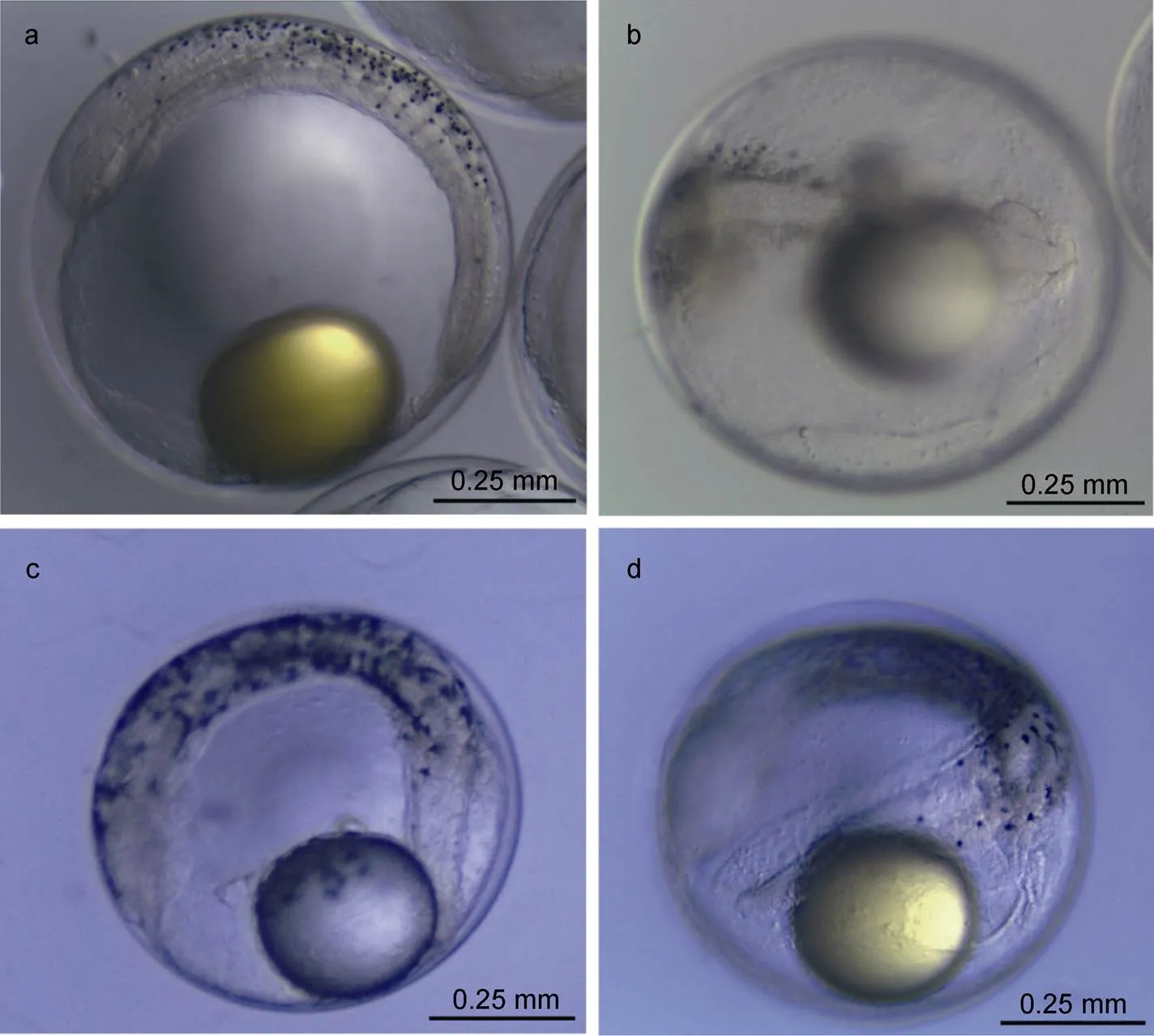
图2 金钱鱼胚体黑色素细胞显微图
注: a. 胚后发育7.5 h; b. 胚后发育9.0 h; c. 胚后发育13.0 h; d. 胚后发育14.0 h
2 dph: 仔鱼全长(2.35±0.05) mm (图3, 2 dph), 卵黄囊大大减少, 油滴体积显著缩小。此时尾部依旧透明, 头部和躯体部大部分已经覆盖着黑色素细胞, 眼球呈深黑色, 口开始作小幅度开合。胸鳍张开, 游动力慢慢增强。仔鱼肠道加粗, 消化腔明显, 肛门周围及腹部开始聚集黑色素细胞, 鱼体形状分区逐渐明显。
4 dph: 仔鱼全长(2.42±0.04) mm (图3, 4 dph), 多数卵黄囊消失, 油球几近残存, 背部肌肉逐渐向头部方向生长, 背鳍膜进一步增高, 头部有隆起状突起, 黑色素细胞向腹部方向延伸, 腹腔与头部色素连接成片, 背腹两侧黑色素开始退化, 大部分在背腹两侧分别残留点状的黑色素细胞, 而眼后头部和尾巴基底部下开始出现点状黑色素细胞, 眼球轮廓逐渐清晰呈圆形, 颜色进一步加深。

图3 金钱鱼前期仔鱼体色发育过程
2.4 后期仔鱼色素细胞发育与体色变化
5 dph: 仔鱼全长(2.52±0.08) mm (图4, 5 dph-1,5 dph-2,5 dph-3), 卵黄囊和油滴吸收基本完全, 肠道蠕动频率增加, 胸鳍呈扇型, 腹鳍呈深黑色, 活动能力进一步加强, 头部和腹部颜色逐渐加深, 摄食能力明显增强, 主要以轮虫幼体为食。此时仔鱼身体整体的色素模式出现较大的变化, 背侧色素的消失很快, 即躯干部色素很少或无色素分布, 能清晰的看到肌节,在肛门上方仅剩少数几个雪花状的黑色素细胞, 背部的大部分色素细胞都往腹部和头部聚集, 可能有利于眼球发育及保护发育早期较脆弱的肠胃免受紫外线的伤害。

图4 金钱鱼仔鱼色素沉积和体色发育图
注: 自上而下分别为0 dph仔鱼, 5 dph仔鱼, 8 dph仔鱼, 11 dph仔鱼, 13 dph仔鱼和15 dph仔鱼
8 dph: 仔鱼全长(3.23±0.07) mm (图4, 8 dph-1, 8 dph-2, 8 dph-3), 此时的仔鱼摄食能力大大加强, 体型开始出现较大的变化, 头后方出现结节突起, 能明显观察到发亮的虹彩色素细胞和少量红色素细胞。头部发育进一步完善, 其中眼睛跟颅骨发育最为明显, 颅骨后方开始产生大量的点状黑色素细胞, 从脊椎向尾巴方向产生与聚集, 并且出现不同发育阶段的细胞。腹部颜色进一步加深, 黑色素细胞的数量显著增多, 主要呈分枝型雪花状, 腹鳍基部突起处有体积较大的分枝状黑色素细胞, 腹腔色素在腹两侧从后向前扩散、密集, 往下颌骨方向发展。躯干中心只有少数几个黑色素细胞, 躯干其他部位仍透明。
11 dph: 仔鱼全长(3.86±0.14) mm (图4, 11 dph-1, 11 dph-2, 11 dph-3), 仔鱼各器官发育更加完善, 摄食及游泳能力增强, 体型上更趋近于稚鱼, 头大身子小, 整体呈三角形, 嘴巴颜色变黑, 更加厚实。此时躯干部色素沉着明显, 身体躯干部的黑色素细胞密度增多, 大都呈分枝状, 逐渐往尾部覆盖。尾巴也出现零星的几个色素细胞, 眼后头部黑色素细胞、虹彩色素细胞和红色素细胞数量急剧增多。红色素细胞主要聚集在结节突起与背鳍棘鳍基部的位置。
13 dph: 仔鱼全长(5.12±0.09) mm (图4, 13 dph-1, 13 dph-2, 13 dph-3), 各器官发育进一步完善, 头腹部的黑色沉着程度加深, 黑色素细胞从脊椎处向前向后快速生长并聚集, 使头部和躯干部的颜色加深, 透光性减弱, 特别是下颌部黑色素沉积速度加快, 有利于其提高摄食的能力。躯干部的黑色素细胞不断向尾部方向生长, 大都呈分枝型雪花状。此时仔鱼的体色模式还在加快演变中。
15 dph: 仔鱼全长(5.87±0.13) mm (图4, 15 dph-1, 15 dph-2, 15 dph-3), 头腹部乌黑, 显微镜下其身体透光性极弱。尾部依然呈透明状, 只能依稀见到少数几个黑色素细胞, 背侧亦开始形成背鳍的支鳍骨。头部形状更加立体, 颅骨和鳃盖骨矿化程度较高, 头大身子小。此时色素沉积模式逐渐往背鳍基部、臀鳍基部和尾鳍基部延伸覆盖。
2.5 稚鱼体色变化
24 dph: 稚鱼全长(8.67±0.21) mm (图5, 24 dph), 随着稚鱼身体器官发育的进一步完善, 仔鱼的幼鳍鳍膜开始消失并被稚鱼鳍膜替代, 预示着仔鱼进入到稚鱼期。此时鱼体的色素模式是鱼体全身为深黑色, 头部、腹部和躯干部被大量黑色素细胞覆盖。而最明显的特征是头部颅骨后方出现了一对特异形骨结节突起, 跟躯干部形成明显的头部和躯干部界限, 且十分坚硬。
30 dph: 稚鱼全长(1.36±0.05) cm (图5, 30 dph), 此时稚鱼从外观上看最明显的是全身色素模式发生了改变, 从全身的深黑色褪变成了腹部的亮黄色和亮浅蓝色, 同时呈现四条黑色纵带。此阶段腹部皮肤虹彩色素细胞大量产生。此现象说明虹彩色素细胞在皮肤中产生的时间较黑色细胞晚很多, 而一旦在腹部大量产生就改变原来的黑色素沉积模式, 将整片黑色体色分割成不同的颜色部分。
2.6 幼鱼和成鱼体色变化
50 dph: 幼鱼全长(2.58±0.03) cm (图5, 50 dph), 此阶段幼鱼身体侧扁, 口小而牙齿整齐, 喜水藻丰富的阳光水域, 啃食藻类和水草, 侧线明显。背鳍隆起明显, 呈鲜艳的橘红色。身体有五到六条纵带条纹, 且有些条纹已经演变成斑点, 有些则正处在演变阶段。第二背鳍、臀鳍和尾鳍仍然呈透明状。
90 dph: 幼鱼全长(4.98±0.07) cm (图5, 90 dph), 体表颜色鲜艳, 全身的构成色主要有黑色、黄色、红色和绿色。皮肤中没有纵带条纹, 只有黑色斑点, 特别是侧线下方的斑点状已经跟成年鱼基本相同。侧线上方背鳍基部则黄绿色斑纹明显, 第一背鳍则呈鲜红色, 第二背鳍、臀鳍和尾鳍已经逐渐由原来的透明变为浅黄色, 而它们的基部也开始产生黑色斑纹的体色模式。
120 dph: 金钱鱼全长(7.46±0.12) cm (图5, 120 dph), 整体体型已经跟成年鱼无异, 身体两侧的黑斑数量更多, 黑色更加集中。不同的是侧线上方的黄绿色斑纹被黑斑代替, 且第一背鳍红色颜色较浅, 黑色颜色增多, 第二背鳍的黑色斑纹沉积更多, 其基部聚集有黑斑, 有不断向上迁移的趋势, 臀鳍和尾鳍基部也有同样的趋势。
1龄成年鱼: 金钱鱼全长(17.41±0.18) cm (图5, 1 year), 体色模式基本发育完全, 躯干部皮肤呈现明显的背腹式体色模式, 背部皮肤上黑斑数量多, 颜色深, 腹部皮肤上黑斑数量少, 颜色浅, 整体呈现出背部体色颜色深而腹部体色浅, 而且腹部颜色较亮, 在阳光的照射下有反光现象。金钱鱼第一背鳍上的红色颜色褪去, 呈黑色, 第二背鳍、臀鳍和尾鳍呈现相同的颜色模式, 即黄黑相间的颜色模式, 黄色明显加深, 而其黑色条纹的颜色同皮肤中的黑斑颜色基本一致, 可以推定这些黑斑条纹是皮肤中的黑斑在鳍中的分散分布。

图5 金钱鱼稚鱼期到成鱼期的整个体色变化过程
2.7 金钱鱼的皮肤组织中色素细胞超微结构观察
金钱鱼黑斑皮肤和非黑斑皮肤的透射电镜如图6。在电镜下, 细胞内部充满大量的高电子密度大小不一的黑色颗粒, 且可明显观察到有很多颜色不均匀的管状结构(图6, 1a), 这些结构表面有明显的界限感, 每个界限是一个黑素小体(图6, 4a)。大量黑素小体堆叠挤压形成管状结构, 黑色小体有4个不同的发育时期, 颜色的深浅代表不同发育阶段成熟度的高低, 其中, 颜色最深的黑素小体成熟度最高。金钱鱼的皮肤中黑色素细胞呈分枝状(图6, 2b), 黑色素细胞周围及底下布满大大小小不同形状的反射小板, 这些反射小板的数量之多, 因为虹彩色素细胞就由大量的反射小板所构成, 这说明非黑斑皮肤中虹彩色素细胞的数量之多(图6, 1b)。从金钱鱼黑斑皮肤和非黑斑皮肤的透射电镜切片对比发现黑斑皮肤中主要含有大量的黑色素细胞和黑素小体, 而非黑斑皮肤中含有大量的虹彩色素细胞, 黑色素细胞相比较少, 且非黑斑皮肤中虹彩色素细胞相互聚集在一块从而跟黑色素细胞和黑素小体形成明显的界限(图6, 3b), 而在黑斑皮肤和非黑斑皮肤的交界处形成了一道天然的分界线(图6, 4b), 这较好地解释了金钱鱼黑斑形成的作用机理。
3 讨论
3.1 鱼类色素发育
本研究对金钱鱼的早期体色发育过程和后期体色模式整个形成过程进行拍照追踪与分析, 了解金钱鱼的完整生命发育过程中体色的沉积特点。从金钱鱼的胚胎发育中最早观察到黑色素细胞的发生, 之后陆续观察到黄色素细胞和红色素细胞, 虹彩色素细胞是在孵化出膜后的仔鱼期才发生的, 这种出现的先后顺序跟大部分硬骨鱼类相同, 例如牙鲆、大菱鲆、圆斑星鲽等(Bolker, 2000; 严俊丽等, 2017)。哺乳类和鸟类的色素体可以在不同的细胞内转移, 从而达到改变身体功能跟体色的目的。而鱼类等变温脊椎动物的色素体只在色素细胞内发生移动, 使色素细胞的形态发生改变, 达到形成某些体色模式的目的(Mills, 2009)。因此, 鱼类早期体色发育过程中色素细胞的形态变化在一定程度上代表了鱼类色素细胞的整个发展史, 其中, 黑色素细胞发生最早, 呈现两种细胞形态, 从最初的团块状发育为体积较大的分枝型雪花状。金钱鱼从胚胎期的第一次出现点状的黑色素细胞, 在8 dph仔鱼时躯干部又一次出现点状的黑色素细胞, 之后又变化成分枝型雪花状。从这一变化可以看出点状的黑色素细胞可能是未成熟的色素母细胞或者未成熟的黑色素细胞, 随着进一步的分化或发育为分枝状的黑色素细胞, 数量越来越多, 分布范围更广, 一直到24 dph稚鱼全身变黑。金钱鱼30 dph稚鱼的皮肤中出现大量的虹彩色素细胞, 从皮肤中出现的纵带条纹可以推测出虹彩色素细胞的生长方向是纵向的, 从幼鱼期体表出现的斑点推测随着鱼的成长虹彩色素细胞开始沿着横向生长。虽然虹彩色素细胞在皮肤中的分化最晚, 但其出现使金钱鱼幼鱼期阶段到成年期的金钱鱼体色发生重大改变。虹彩色素主要集中于鱼体的腹部, 呈现出颜色较浅的白色或者银色, 在光照条件下反光现象明显, 而虹彩色素细胞与其他色素细胞(黑色素细胞和红黄色素细胞等)相互作用, 可以表现为更加丰富的体色模式, 包括银白色、绿色等(Doucet, 2009), 说明虹彩色素细胞对于鱼类体色的形成具有重要的作用。
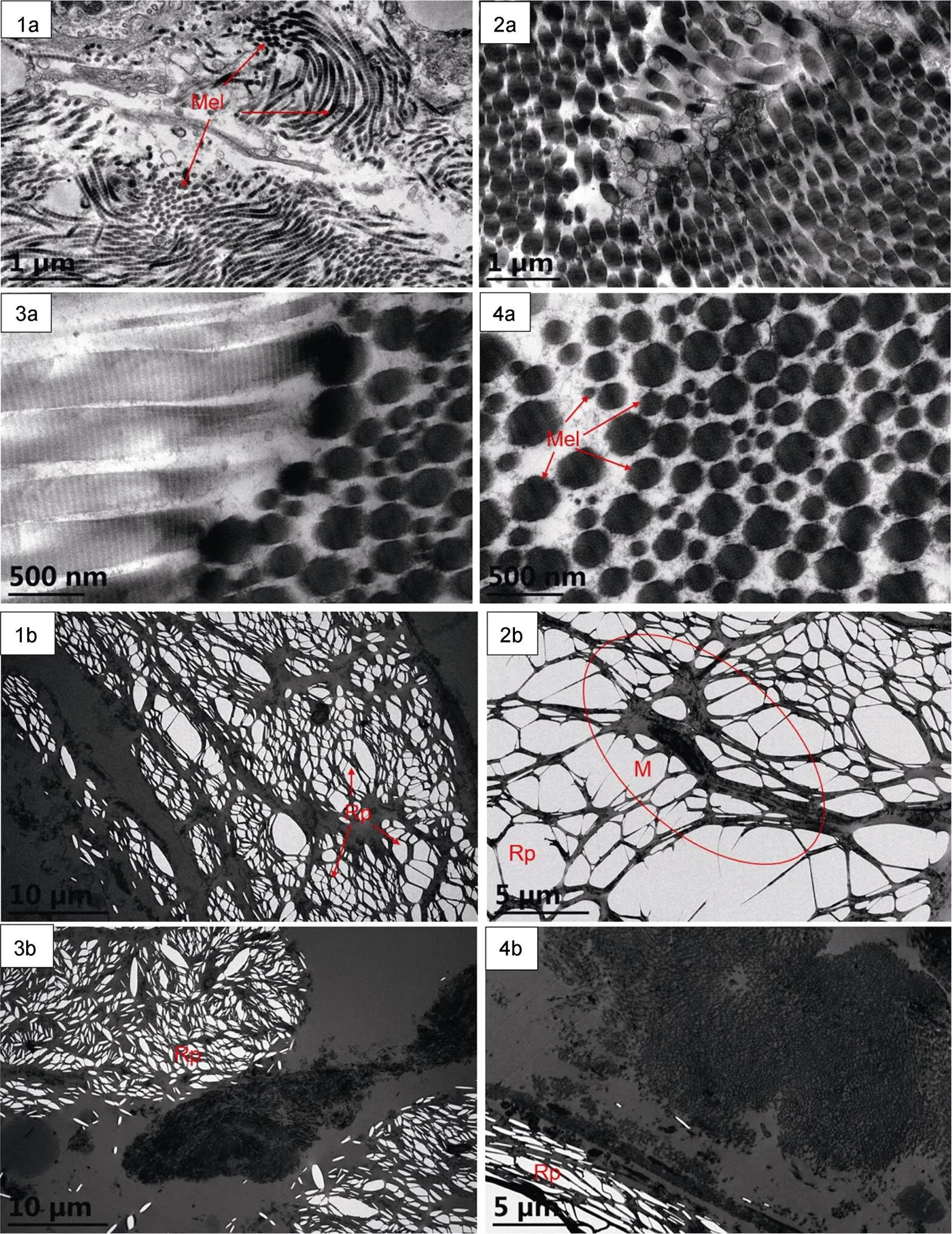
图6 金钱鱼黑斑和非黑斑皮肤色素细胞的亚显微结构
注: 1a—4a. 黑斑皮肤; 1b—4b. 非黑斑皮肤。M. 黑色素细胞; Mel. 黑素小体; Rp. 反射小板
金钱鱼早期体色发育中可观察到4种色素细胞, 其中黑色素细胞最明显, 数量多, 体积占比最大, 黄色素细胞和红色素细胞主要分布在头部和尾部, 数量少, 虹彩色素细胞出现最晚, 在金钱鱼仔鱼的脑后头部突起处跟红色素细胞几乎同时出现, 直到稚鱼的中后期在皮肤中大量出现, 为幼鱼期金钱鱼黑斑体色的形成奠定基础。本次研究中, 金钱鱼的皮肤透射电镜结果显示: 黑色素细胞内部含有大量大小不一的黑色颗粒, 称为黑素小体, 细胞大小的差别取决于黑素小体的多寡, 皮肤颜色的深浅取决于黑素小体聚集位置与细胞中心的距离, 距离越远, 树突状分枝越长, 颜色越深; 距离越近, 树突状分枝越短, 颜色越浅。而金钱鱼的非黑斑皮肤中大量聚集形状不规则且致密的反射小板, 而在黑斑皮肤中则几乎观察不到反射小板, 说明黑斑皮肤中没有虹彩色素细胞, 虹彩色素细胞集中在黑斑皮肤周围的非黑斑位置, 将黑色素细胞和黑色小体包围形成明显的界限。总之, 金钱鱼早期的色素细胞发育与分布可以为后期成熟的体色模式打下基础, 成鱼的透射电镜结果有利于我们对成熟黑斑体色模式的形成有更深入的认识。
3.2 鱼类颜色图案形成与生物学意义
本研究中, 金钱鱼的颜色图案形成经过以下四个阶段, 过程较为复杂, 包括仔鱼前期躯干部先颜色加深后“体色褪黑”至透明的现象、仔鱼后期躯干部黑色素的向前向后发育过程、稚鱼期体色全黑变化为幼鱼期的纵带条纹和幼鱼期至成年期体色黑斑和黄黑鳍斑的形成等变化阶段。此现象不仅仅只存在于金钱鱼中, 多数鱼类从仔鱼到幼鱼阶段都存在一个重要的“体色褪黑”生物学现象(蒋燕玲等, 2016; 刘伟等, 2019), 出膜后, 鱼体黑色素细胞分化速度加快、数目逐渐增加, 体表主要呈黑色, 然后在不同部位不同程度的褪去黑色, 形成跟早期体色极其不同的颜色图案, 如橘色双冠丽鱼、日本锦鲤等。鱼类不同阶段的体色变化由色素细胞的种类、数量、密度、位置和排列方式共同决定的, 不同色素细胞之间的相互吸引与排斥作用是形成特定体色图案的根本性原因(Hirata, 2003; Nakamasu, 2009)。
鱼类的颜色图案丰富多彩, 不同阶段的颜色图案往往对应不同的功能作用。例如, 比目鱼()在众多鱼类中伪装能力最强, 当其所处的环境发生改变时, 可在2—8 s内快速的改变身体颜色, 能够相当逼真地与多种环境相匹配从而达到彻底伪装自己的目的(Ramachandran, 1996)。而一些生活在近岸杂草丛生的鱼类则通过展现其重复的颜色图案, 达到与周围环境相融合的目的, 当其快速游泳时其他敌害鱼类看到的是模糊的身体形状, 导致其他鱼类产生视觉错乱并达到成功保护自己的目的。相反, 一些生活于无背景的海洋上层鱼类, 大部分身体颜色较浅, 且呈现较亮的银色反光色, 可直接反射太阳光, 在周围没有背景或遮蔽物的开放水体中迷惑捕食者。金钱鱼喜欢在河流入海口杂草和垃圾较多的地方产卵, 为了跟环境融合, 刚孵出的仔鱼身体一般呈黑色, 有利于保护自己; 另一可能原因是金钱鱼仔鱼早期的食物轮虫和藻类基本生活在光照充足的水域, 金钱鱼仔鱼身体呈黑色有利于感受太阳光的温度而容易找到食物。而成年金钱鱼喜欢栖息在河流入海口及近海岸植物较多的水域, 其体表圆黑斑和黄黑条纹鳍条图案可以使其更好的隐蔽于周围环境, 达到躲避敌害的目的, 并且成年金钱鱼喜欢啃食水草和藻类, 经常受到阳光的直射, 黑斑图案可能有利于降低紫外线对身体的损伤, 具体的生物学意义有待进一步研究。
4 结论
本文研究发现构成金钱鱼体色共四种色素细胞, 分别为黑色素细胞、黄色素细胞、虹彩色素细胞和红色素细胞, 不同色素细胞在金钱鱼体色形成中的占比不同。金钱鱼的颜色图案形成主要经过四个变化阶段, 包括仔鱼前期躯干部颜色先加深至“体色褪黑”再到透明的现象、仔鱼后期躯干部黑色素的向前向后发育过程、稚鱼期体色全黑变化为幼鱼期的纵带条纹以及幼鱼期至成年期体色黑斑和黄黑鳍斑的形成等变化阶段。进一步观察发现, 金钱鱼的皮肤中黑色素细胞和虹彩色素细胞数量最多, 分布最广, 黑斑形成的关键原因是大量的虹彩色素细胞将聚集的黑素小体和黑色素细胞形成明显包围界限, 从而导致金钱鱼黑斑体色模式的形成。本研究将为金钱鱼的不同发育阶段体色鉴定提供基础性研究, 对金钱鱼的种质改良及解析体色形成的生物学意义提供科学理论指导。
于道德, 刘洪军, 关 健等, 2012. 黑棘鲷早期色素细胞发育与体色变化. 渔业科学进展, 33(5): 1—7
刘 伟, 赵金良, 魏 磊等, 2019. 鳜早期色素发育和色彩图案的形成. 动物学杂志, 54(2): 236—244
严俊丽, 陈四清, 常 青等, 2017. 圆斑星鲽仔稚鱼色素细胞发育和体色变化. 水产学报, 41(5): 678—686
杨 尉, 陈华谱, 江东能等, 2018. 金钱鱼生物学及繁养殖技术研究进展. 生物学杂志, 35(5): 104—108
杨纪明, 2000. 未见记载的真鲷变色. 海洋科学, 24(6): 51
徐嘉波, 施永海, 谢永德等, 2016. 池塘养殖金钱鱼的胚胎发育及胚后发育观察. 安徽农业大学学报, 43(5): 716—721
黄宗国, 1994. 中国海洋生物种类与分布. 北京: 海洋出版社, 1—764
蒋燕玲, 宋红梅, 刘 奕等, 2016. 橘色双冠丽鱼TYR基因的克隆及其发育时序和组织表达分析. 农业生物技术学报, 24(5): 697—707
蔡泽平, 胡家玮, 王 毅, 2014. 金钱鱼早期发育的观察. 热带海洋学报, 33(4): 20—25
Barry T P, Fast A W, 1992. Biology of the spotted scat () in the Philippines. Asian Fisheries Science, 5: 163—179
Bolker J A, Hill C R, 2000. Pigmentation development in hatchery-reared flatfishes. Journal of Fish Biology, 56(5): 1029—1052
Doucet S M, Meadows M G, 2009. Iridescence: a functional perspective. Journal of the Royal Society Interface, 6(Suppl 2): S115—S132
Hirata M, Nakamura K I, Kanemaru T, 2003. Pigment cell organization in the hypodermis of zebrafish. Developmental Dynamics, 227(4): 497—503
Kelsh R N, 2004. Genetics and evolution of pigment patterns in fish. Pigment Cell Research, 17(4): 326—336
Lin X Z, Tian C X, Huang Y, 2021. Comparative transcriptome analysis identifies candidate genes related to black-spotted pattern formation in spotted scat (). Animals, 11(3): 765
Mills M G, Patterson L B, 2009. Not just black and white: pigment pattern development and evolution in vertebrates. Seminars in Cell & Developmental Biology, 20(1): 72—81
Nakamasu A, Takahashi G, Kanbe A, 2009. Interactions between zebrafish pigment cells responsible for the generation of Turing patterns. Proceedings of the National Academy of Sciences of the United States of America, 106(21): 8429—8434
Ramachandran V S, Tyler C W, Gregory R L, 1996. Rapid adaptive camouflage in tropical flounders. Nature, 379(6568): 815—818
Randall J E, 2005. A review of mimicry in marine fishes. Zoological Studies, 44(3): 299—328
Ruxton G D, Speed M P, Kelly D J, 2004. What, if anything, is the adaptive function of countershading?. Animal Behaviour, 68(3): 445—451
DEVELOPMENT OF BODY COLOR AND FORMATION PROCESS OF BLACK SPOTS IN SPOTTED SCAT ()
LIN Xiao-Zhan1, ZHANG Jun-Peng1, HUANG Yang1, 2, SHI Hong-Juan1, 2, LI Guang-Li1, 2, TIAN Chang-Xu1, 2
(1. Fisheries College, Guangdong Ocean University, Guangdong Research Center on Reproductive Control and Breeding Technology of Indigenous Valuable Fish Species, Zhanjiang 524088, China; 2. Southern Marine Science and Engineering Guangdong Laboratory (Zhanjiang), Zhanjiang 524088, China)
The body pigmentation on fish is one of the prominent features of their external morphology, and plays an important role in the survival and the communication among aquatic animals. To explore the development of pigmentation of black spots in spotted scat (), microscopic observation on pigment cells in the fin rays of the adult spotted scat was conducted with Olympus stereoscopic dissecting microscope. Types and distribution of pigment cells on surface of spotted scat from the embryonic pigmentation stage to the late larval stage were analyzed. The progress of main black spots of the fish from juvenile to adult stages was observed. In addition, spotted and non-spotted skins of the fish were examined in transmission electron microscopy. Four types of pigment cells were recognized, including melanocytes, xanthophores, iridophores, and erythrophores. Melanocytes occurred first in the embryonic development stage, followed by xanthophores and erythrophores, and iridescent pigment cells came last and disappeared in the late stage of larvae. Interesting variation occurred in the larvae (0—24 dph): in 0—1 dph, body color changed from light to dark, the trunk color of the larvae was obviously depigmented in 2—7 dph; and the pigment restored in 8—24 dph and the whole body became black in 24 dph. At 30 dph, many iridophores appeared in skin and formed dim pigment bands, clear dark vertical stripes started to show in the juvenile stage (50 dph) and finally they turned steadily into multiple black spots in the adult stage. As shown in transmission electron microscopy, most melanocytes and iridophores were widely deposited in the skin as the results of bulky accumulation of melanosomes and melanocytes, around which iridophores deposited and encircled. The course of pigment deposition and body color changes of the spotted scat could be recognized in six stages: embryonic pigment development, early larvae, late larvae, juveniles, juveniles, and adult fish. This study provided a reference for the age identification of wild populations of spotted scat and a theoretical guidance for the manipulation of body color of the spotted scat.
spotted scat (); body color development; melatonization phenomenon; blackening phenomenon; black spot formation
* 国家“蓝色粮仓科技创新”重点项目, 2018YFD0901200号; 广东省自然科学基金资助项目, 2019A1515010958号, 2019A1515110619号, 2021A1515010733号; 广东省普通高校特色创新类项目, 2019KTSCX060号; 广东海洋大学博士启动项目, R19026号。林晓展, 硕士研究生, E-mail: linxiaozhan@stu.gdou.edu.cn
田昌绪,博士, E-mail: tiancx@gdou.edu.cn
2021-05-24,
2021-07-15
S917.4; Q954.6
10.11693/hyhz20210500121