重组人白细胞介素-1 受体拮抗剂生物学活性检测方法的建立及验证
2021-11-26俞露王莹张宇刘莹刘景会刘玉林
俞露,王莹,张宇,刘莹,刘景会,刘玉林
长春生物制品研究所有限责任公司细胞因子室,吉林长春 130012
白细胞介素-1 受体拮抗剂(interleukin-1 receptor antagonist,IL-1Ra)是人体内一种天然的蛋白质分子,为IL-1 家族成员,本身无激动剂的作用,但能与IL-1 特异性结合,从而拮抗IL-1 介导的各种炎症效应[1-2]。由于人体内天然的IL-1Ra 含量较少,而临床研究表明,患者病灶处分泌的IL-1 需大量的IL-1Ra才能有效抑制[3],众多研究者将应用基因工程技术表达该药物作为研究方向。目前上市的产品只有Sobi公司的Kineret,中文名称为阿那白滞素,广泛应用于炎症反应的治疗,对痛风、类风湿性关节炎等疾病效果显著,且无药典及专利等参考资料,因此,对于该药物工艺及质量分析方法的研究依然是热点。
生物学活性是反映生物制品有效性的关键质量属性。本实验依据IL-1Ra 可中和重组人IL-1β 对人黑色素瘤细胞A375. S2 的杀伤抑制作用,活细胞内脱氢酶类可将MTS 转化为液态可溶性橙色甲臜化合物[4-5],后者产量与活细胞数和细胞活力呈正比,反应完成后测定其在波长490 nm 处的吸光度[6-9],可得到重组人IL-1Ra 浓度对吸光度值的效应曲线,从而建立IL-1Ra 体外生物学活性检测方法,并对方法进行验证。
1 材料与方法
1. 1 样品 Kineret 为安进公司产品;IL-1Ra 原液(批号为S20191004、S20200401、S20200402、S20200-403)及成品(批号为S20190303、S20200201、S2020-0702、S20200803)为长春生物制品研究所有限责任公司制备。
1. 2 细胞 人黑色素瘤A375. S2 细胞系由上海百迈博制药有限公司惠赠(ATCC®Number:CRL-1872TM)。
1. 3 主要试剂及仪器 活性标准品为安进公司原研药(批号:3529201A,比活性:1 × 105U / mg);IL-1α和IL-1β 购自美国R&D 公司;DMEM 和RPMI1640培养基购自美国Gibco 公司;胎牛血清购自浙江天杭生物科技公司;细胞增殖检测试剂盒购自美国Promega 公司;酶标仪及SoftMax 分析软件为美国Molecular Devices 公司产品。
1. 4 细胞培养 A375. S2 细胞复苏后,用完全培养基45% RPMI1640 + 45% DMEM + 10% FBS 培养,每3 ~4 d 按1 ∶4 传代1 次,取传代3 次后,处于对数生长期,细胞汇合度为50% ~80%的稳定细胞作为活性检测用细胞。
1. 5 方法的建立 取安进公司Kineret 作为样品,用完全培养基逐级稀释(每次稀释不超过10 倍)至一定浓度。向96 孔板中每孔各加入100 μL 培养基,于第2 ~11 列第1 排每孔加入50 μL 样品,每个浓度设2 个复孔,其中6、7 列为标准品,依次进行3 倍系列稀释,最后1 排弃去50 μL 液体。取贴壁培养的A375.S2 细胞,胰蛋白酶消化后,制成4.0×104个/mL的细胞悬液,加入适量IL-1β,混匀后加至稀释好样品的细胞板中,100 μL / 孔,于第12 列设置阴性对照(不加入IL-1β)。将细胞培养板置于37 ℃,5%CO2培养箱中孵育72 h 左右,显微镜下观察阴性对照细胞基本死亡后,加入单溶液细胞增殖检测试液,20 μL / 孔,在CO2培养箱中继续孵育3 ~4 h,用酶标仪测定吸光度值,检测波长为490 nm,参考波长为700 nm。数据处理:利用SoftMaX Pro 7. 1 软件进行4 参数Logistic 回归,拟合曲线,计算活性标准品与待检样品的半数有效浓度(ED50),按下式计算待测样品原液的比活性。
待测样品原液比活性(U/mg)=理化对照品比活性(U/mg)×理化对照品ED50(ng / mL)/ 待测样品ED50(ng / mL)
1. 6 方法的优化 初步建立检测方法后,在IL-1β终浓度为8 ng / mL 条件下,对样品起始浓度进行优化(8、10、12、14 μg / mL);确定样品最佳起始浓度后,对IL-1β 加入量进行优化(终浓度分别设为2、4、6 ng / mL),最终确定实验参数。
1. 7 方法的验证
1. 7. 1 专属性 分别用优化的方法对IL-1Ra 原液中含有的缓冲液成分(柠檬酸三钠、乙二胺四乙酸二钠、氯化钠)和成品中含有的辅料成分(聚山梨酯80)进行活性测定,分析两种成分对检测结果的影响,验证该方法的专属性。
1. 7. 2 线性范围 取标准品,分别稀释至6、8、10、13. 2 μg / mL,即8 μg / mL 的75%、100%、125%及165%作为供试品,每份样品分别重复测定6 次。以不同效价水平理论值几何均值的对数为横坐标,相应效价测定值的对数为纵坐标做图,采用最小二乘法进行线性回归,并计算相关系数(R2),R2应不低于0. 98。
1. 7. 3 准确度 试验方法同1. 6. 2 项。计算每个效价水平相对效价测定值的相对偏差及直线回归方程斜率,验证该方法的准确度。每个效价水平相对效价测定值的相对偏差应在± 12%范围内,回归方程的斜率应在0. 80 ~1. 25 范围内。
1. 7. 4 中间精密度 由两名试验员对1 批原液(批号为S20191004)、1 批成品(批号为S20190303)在不同时间各检测3 次,计算6 次相对效价测定值的几何变异系数(geometric coefficient of variation,GCV),验证该方法的中间精密度。GCV 应不高于20%。
1. 7. 5 耐用性 采用第10、20 代细胞,分别按3. 5×104、4 × 104个/ mL 的密度铺板进行检测,计算效价测定值的GCV,应不高于20%。
1. 8 方法的初步应用 用建立的方法分别检测3 批原液(批号分别为S20200401、S20200402、S202004-03)、3 批成品(批号分别为S20200201、S20200702、S20200803)的生物学活性。
2 结 果
2. 1 方法的优化 在IL-1β 终浓度为8 ng / mL 条件下,样品起始浓度为8 μg / mL 时,曲线呈较明显的S 型,不同稀释点的值分布在曲线上较均匀,见图1。在样品起始浓度为8 μg/mL 条件下,不同IL-1β 终浓度(2、4、6 ng/mL)曲线无明显区别,R2分别为0.989 67、0. 990 34、0. 979 44,终浓度为4 ng / mL 时,曲线R2较高,形态稍好,见图2。最终确定样品起始浓度为8 μg / mL,IL-1β 终浓度为4 ng / mL。
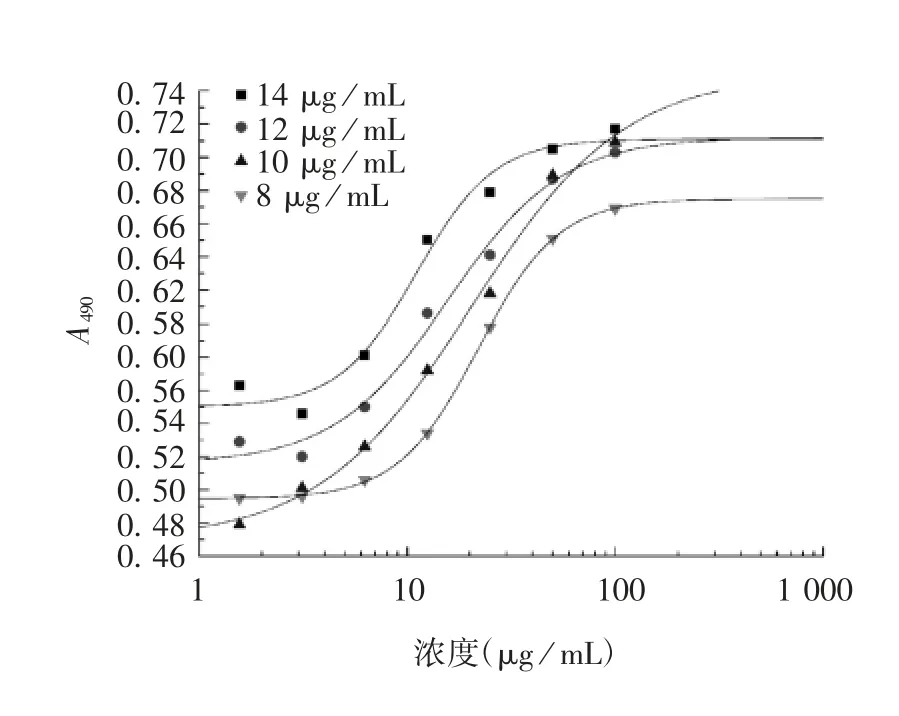
图1 不同样品起始浓度的回归曲线Fig. 1 Regression curves of developed method at different initial sample concentrations

图2 不同IL-1β 终浓度的回归曲线Fig. 2 Regression curves of developed method at different final IL-1β concentrations
2. 2 方法的验证
2. 2. 1 专属性 IL-1Ra 原液缓冲液成分及成品中辅料成分无效应曲线,与样品及标准品曲线具有明显差异,表明两种成分对检测结果无影响,该方法专属性良好,见图3。原液比活性为1. 14 × 105U / mg,成品比活性为9. 33 × 104U / mg。

图3 方法的专属性验证结果Fig. 3 Verification for specificity
2. 2. 2 线性范围 在6 ~13 μg/mL 范围内,直线回归方程的R2为0. 992 1,表明该方法线性较好。该方法同时满足准确度、线性要求时的效价水平范围为75%~165%,涵盖了其质量标准范围(80%~150%),表明检测范围能够满足要求。见图4 和表1。
2. 2. 3 准确度 每个效价水平相对效价测定值的相对偏差均在± 12%范围内,直线回归方程斜率为0. 975 8,符合要求,表明该方法准确度良好。见图4和表1。

图4 线性回归曲线Fig. 4 Linear regression curve

表1 方法的线性范围验证结果Tab. 1 Verification for linear range
2. 2. 4 中间精密度 两名试验员对1 批原液、1 批成品6 次相对效价测定值的GCV 分别为13. 895%和8. 670%,均<20%,符合要求,表明该方法中间精密度良好,见表2。

表2 方法的中间精密度验证结果Tab. 2 Verification for intermediate precision
2. 2. 5 耐用性 不同细胞代次、不同细胞密度下相对效价测定值的GCV 为5. 595%,<20%,符合要求,表明该方法耐用性良好,见表3。
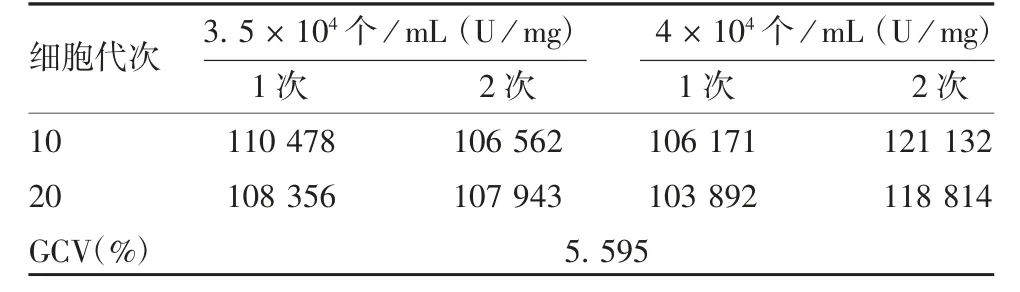
表3 方法的耐用性验证结果Tab. 3 Verification for durability
2. 3 方法的初步应用 检测结果显示,S20200401、S20200402、S20200403 批原液的比活性分别为1. 1、1. 3、1. 2 U / mg,S20200201、S20200702、S20200803批成品的比活性分别为1. 1、1. 1、1. 0 U / mg,产品生物学活性批间差异较小,表明该方法检测结果稳定,可行性较高。
3 讨 论
生物学活性作为生物制品质量控制的最重要指标,其检测方法的可行性及准确度尤为重要[10-11]。本方法建立初期对起始细胞密度、细胞培养天数、IL-1的型别(IL-1α、IL-1β)及加入量、细胞增殖检测试剂盒的厂家等均进行了考察,最终确定了实验参数。有研究发现,虽然IL-1α 与IL-1β 均能与A375. S2 细胞膜上的IL-1R 结合从而杀伤细胞,且IL-1Ra 均能阻断这种结合作用,但IL-1R 与IL-1β 的亲和力远远高于IL-1α[12-15]。这在我们的前期实验中也得到了证实,实验中发现,96 孔板中细胞是否均匀以及细胞状态是否在增殖期对实验结果影响较大。
方法的验证主要依据《生物制品生物活性/ 效价测定方法验证指导原则》进行,在专属性验证中分别分析了原液中缓冲液成分及成品中辅料成分对检测结果的干扰,结果表明均无干扰;线性范围验证与准确度验证共同进行,需设3 个以上的起始浓度点,且应包含质量标准的范围[16],综合药典对生物制品生物学活性的要求,一般均为80% ~150%,又因为一块96 孔细胞板只能平行检测4 个样品的局限性,因此设置了起始浓度的75%、100%、120%、165%这4 个点作为起始浓度,线性回归R2、斜率及各起始浓度相对效价测定值的相对偏差均符合验证要求;由于细胞计数板或细胞计数仪对细胞密度的定量均有一定误差,且细胞固有的增殖方式需3 ~4 d 进行传代,无法保证每次试验细胞处于同一代次,因此,试验对不同细胞代次和密度这两个参数进行了耐用性验证,结果显示,该方法具有较高的耐用性。使用该方法对多批在研产品进行检测,结果显示,该方法可行性较强,检测效率高,操作简便,且检测结果稳定。
综上所述,本实验成功建立了重组人IL-1Ra 生物学活性检测方法,该方法准确度高,精密度好,耐用性强,检测结果稳定可靠,可用于产品的生物学活性评价和质量控制。
