藏紫草醇提物的抗炎作用及其机制
2021-11-26周子琪刘益波郭珊珊索朗欧珠
周子琪, 刘益波, 郭珊珊, 索朗欧珠
(西藏职业技术学院,西藏 拉萨 850030)
藏紫草为紫草科植物长花滇紫草OnosmahookeriClarke.var.longiforumDuthie及细花滇紫草OnosmahookeriC.B.Clarke的根,主要分布在西藏东部和南部,含有β-谷甾醇、紫草素、齐墩果酸、阿魏酸、山柰酚等活性成分[1-2]。它作为藏医习用药材,有38个藏药方剂将其入药,常用于皮肤病、肺炎、结核空洞、高山多血症、烧烫伤的治疗[3-4],但尚缺乏关于抗炎作用及机制的基础研究。因此,本实验探究藏紫草醇提物抗炎作用及其机制,以期为该药用植物进一步开发应用提供依据。
1 材料
1.1 仪器 SW-CJ-2FD型超净工作台(苏州安泰空气技术有限公司);RE-5299型旋转蒸发仪(巩义市宇翔仪器公司);CCL-170B-8型二氧化碳恒温培养箱(新加坡艺思高科技有限公司);XSP-17CV型倒置生物显微镜(上海巴拓仪器有限公司);AP-0650010型细胞计数板(德国Marienfeld公司);Infinite M200 PRO型多功能酶标仪(瑞士Tecan公司);Mini P-4型小型垂直电泳系统(北京凯元信瑞仪器有限公司);Tanon-4600型化学发光成像仪(上海天能科技有限公司);TDZ5-WS型冷冻离心机(湖南湘仪实验室仪器开发有限公司)。
1.2 药材 藏紫草于2017年8月采自西藏林芝地区,经西藏职业技术学院丁云春教授鉴定为紫草科植物长花滇紫草OnosmahookeriClarke.var.longiforum Duthie的根。
1.3 试剂 脂多糖(lipopolysaccharides, LPS,美国Sigma-Aldrich公司,批号L2630MSDS);DMEM高糖培养基、胎牛血清(fatal bovine serum, FBS)、0.25%胰蛋白酶、青霉素/链霉素双抗(美国Gibco公司,批号2081863、11041-8612、90326-2、91018-3);地塞米松(上海麦克林生化科技有限公司,批号D829854-5g);肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、白细胞介素-6(interleukin-6, IL-6)、前列腺素E2(prostaglandin E2, PGE2)、白细胞介素-1β(interleukin-1β, IL-1β)试剂盒(武汉博士德生物工程有限公司,批号98329-1、96021-0、90324-1、91019-1);Griess、BCA蛋白浓度测定试剂盒和RIPA裂解液(北京索莱宝生物科技有限公司,批号20190908、20190405、R0010);一氧化氮合酶(inducible nitric oxide synthase, iNOS)抗体、环氧合酶-2(cyclo oxygen ase-2, COX-2)抗体、β-actin抗体、Lamin B抗体、p65抗体、IκBα抗体、p-IκBα抗体、辣根过氧化物酶(HRP)标记山羊抗兔(美国Affinity公司,鼠源,批号AF0199、AF7003、AF7018、DF7356、AF5006、AF2002、AF2002、S0001);MTT试剂盒(南京建成生物工程研究所,批号905W0989);异硫氰酸荧光素(fluorescein isothiocyanate, FITC)染液、4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染液、2′,7′-二氯荧光黄双乙酸盐探针(2 ′, 7′-dichlorofluorescein diacetate,DCFH-DA)(英国Abcam公司,批号ab188286、ab228550、ab113852)。其余试剂均为分析纯;水为超纯水。
1.4 细胞及动物 小鼠巨噬细胞株RAW264.7细胞,购于中国科学院典型培养物保藏委员会细胞库。清洁级雄性昆明小鼠 60只,体质量22~26 g,购于西安交通大学,动物使用许可证号SYXK(陕)2014-003。
2 方法
2.1 藏紫草醇提物制备 称取药材500.00 g,75%乙醇加热回流提取2次(料液比1∶10),每次2 h,抽滤,合并滤液,旋转蒸发,浸膏冷冻干燥,即得(92.85 g,提取率为18.57%),置于-20 ℃冰箱中保存,备用。
2.2 ELISA法检测小鼠急性腹膜炎腹腔灌洗液中炎症因子水平 60只小鼠随机分为空白组、LPS组、地塞米松组及藏紫草醇提物低、中、高剂量组(0.39、0.78、1.17 g/kg),每组10只,藏紫草醇提取组灌胃给予藏草醇提物(蒸馏水溶解),其余组大鼠灌胃给予0.9%生理盐水,每天2次,连续7 d。禁食过夜后,地塞米松组小鼠腹腔注射地塞米松(0.5 mg/kg),1 h后除空白组外的小鼠腹腔注射1 mg/kg LPS,4 h后处死小鼠,打开腹腔,用含肝素(25 U/mL)的无菌磷酸盐缓冲液冲洗,无菌注射器收集腹腔灌洗液。按ELISA说明书方法测定腹腔洗液中TNF-α、IL-6、IL-1β水平。
2.3 RAW264.7细胞培养 将小鼠巨噬细胞(RAW264.7)培养于含10%胎牛血清、1%双抗(青霉素100 U/mL、链霉素100 μg/mL)的DMEM高糖培养液中,在37 ℃、5% CO2培养箱中温育生长融合到80%~90%时进行传代。
2.4 MTT法检测藏紫草醇提物的细胞毒性 将对数生长期的RAW264.7细胞以1×105/mL接种于96孔板中,过夜,藏紫草醇提物(100、200、300、400、800 μg/mL)孵育24 h后,每孔加入50 μL MTT(5 mg/mL),37 ℃孵育4 h,吸弃孔内的培养液,每孔加入150 μL二甲亚砜,振荡至板底的紫色结晶完全溶解,酶标仪于450 nm波长处测定光密度(OD)值,以空白组为100%,计算细胞存活率,公式为细胞存活率=OD给药/OD空白×100%
2.5 ELISA法检测RAW264.7细胞上清液的炎症因子水平 将对数生长期的RAW264.7细胞以5×104/mL接种于24孔板中,过夜,按“2.4”项下方法分组给药,其中藏紫草醇提物100、200、300、400 μg/mL为“2.4”项下筛选出无细胞毒性的质量浓度,除空白组外其余各组加入1 μg/mL LPS。18 h后,取各组细胞培养上清液,采用Griess试剂检测各组细胞上清液NO水平,按照ELISA说明书测定TNF-α、IL-6、PGE2水平。
2.6 Western blot法检测RAW264.7细胞中iNOS、COX-2蛋白表达 将对数生长期的RAW264.7以1×105/mL接种于6孔板中,过夜,分为空白组、LPS组(1 μg/mL)、藏紫草醇提物(100、200、300、400 μg/mL)组,每组设3个复孔,给药24 h后,除空白组外其余各组加入1 μg/mL LPS,置于培养箱中孵育18 h。总蛋白提取试剂盒提取细胞总蛋白,BCA法检测其浓度,取30 μg加入上样缓冲液充分变性后,进行SDS-PAGE电泳,湿转法将胶中蛋白转到NC膜上,含5%脱脂奶粉的TBST封闭2 h,含3%脱脂奶粉的TBST稀释相应一抗(iNOS、COX-2和β-actin)后孵育1.5 h,TBST洗膜,加入含1%脱脂奶粉TBST稀释的HRP二抗孵育1 h,ECL试剂显影,采用化学发光成像仪分析。通过Gel-Pro Analyzer软件对蛋白条带灰度进行定量分析,以目标条带灰度值与内参β-actin条带灰度值之比表示目标蛋白表达。
2.7 Western blot法检测RAW264.7细胞中NF-κB通路相关蛋白表达 细胞造模及给药方法同“2.6”项,收集细胞,按照核蛋白提取试剂盒说明书分别提取细胞浆蛋白及细胞核蛋白。BCA测定蛋白浓度后,按“2.6”项下方法检测细胞浆中的IκBα、p-IκBα及细胞核中的p65蛋白表达,并进行定量分析。
2.8 免疫荧光法检测RAW264.7细胞中p65的核易位 细胞造模及给药方法同“2.6”项,吸弃培养基,磷酸盐缓冲液洗3次,4%多聚甲醛在室温固定20 min,0.1% Triton ×100 孵育10 min,1% FBS脱脂奶粉封闭30 min,p65一抗(1∶200)孵育过夜,PBS冲洗,FITC标记的二抗(1∶2 000)避光孵育1 h,PBS洗3次,DAPI(0.5 mg/mL)孵育5 min,PBS洗3次,将细胞爬片取出,封片,在荧光显微镜下观察拍照。
3 结果
3.1 藏紫草醇提物对LPS诱导小鼠急性腹膜炎的作用 与空白组比较,LPS组小鼠腹腔灌洗液中炎症因子IL-1β、IL-6、TNF-α水平均升高(P<0.01);与LPS组比较,藏紫草醇提物组及地塞米松组小鼠腹腔灌洗液中炎症因子水平均降低(P<0.05,P<0.01),见表1。
表1 藏紫草醇提物对小鼠腹腔灌洗液中炎症因子水平的影响
3.2 藏紫草醇提物对细胞活性的影响 如图1所示,当藏紫草醇提物质量浓度在100~400 μg/mL范围内时,对RAW264.7的细胞活性无明显影响(P>0.05);在800 μg/mL时,细胞存活率降低(P<0.05),故本实验选择100~400 μg/mL。
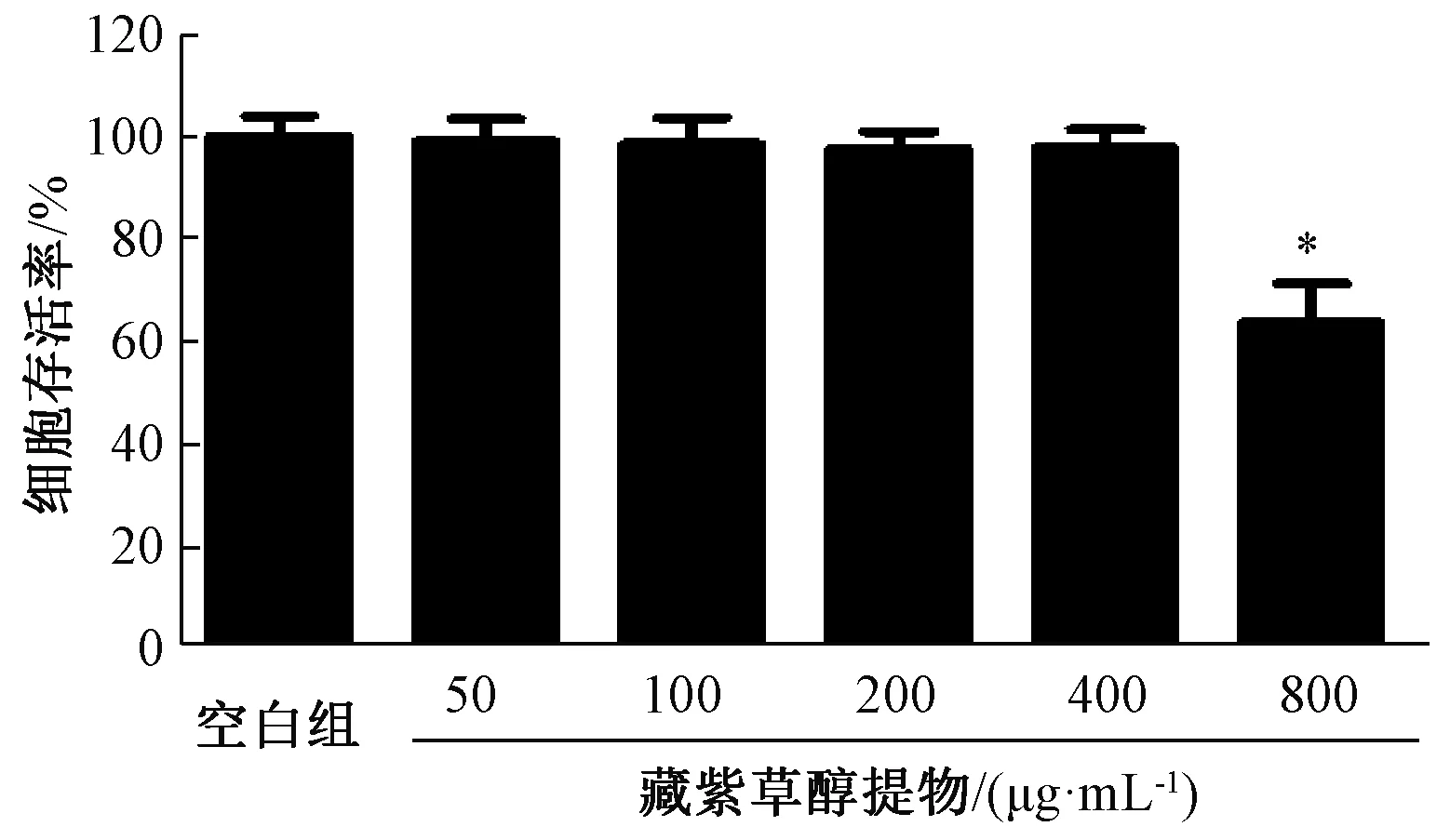
注:与空白组比较,*P<0.05。
3.3 藏紫草醇提物对LPS诱导巨噬细胞炎症的作用 如表2所示,与空白组比较,LPS组细胞上清液NO、TNF-α、IL-6及PGE2水平升高(P<0.01);与LPS组比较,藏紫草醇提物组细胞上清液上述炎症因子水平降低(P<0.05,P<0.01)。

表2 藏紫草醇提物对细胞中炎症因子表达的影响
3.4 藏紫草醇提物对细胞中iNOS和COX-2表达的影响 如图2、表3所示,与空白组比较,LPS组细胞iNOS、COX-2表达升高(P<0.01);与LPS组比较,藏紫草醇提物组iNOS、COX-2表达降低(P<0.05,P<0.01)。
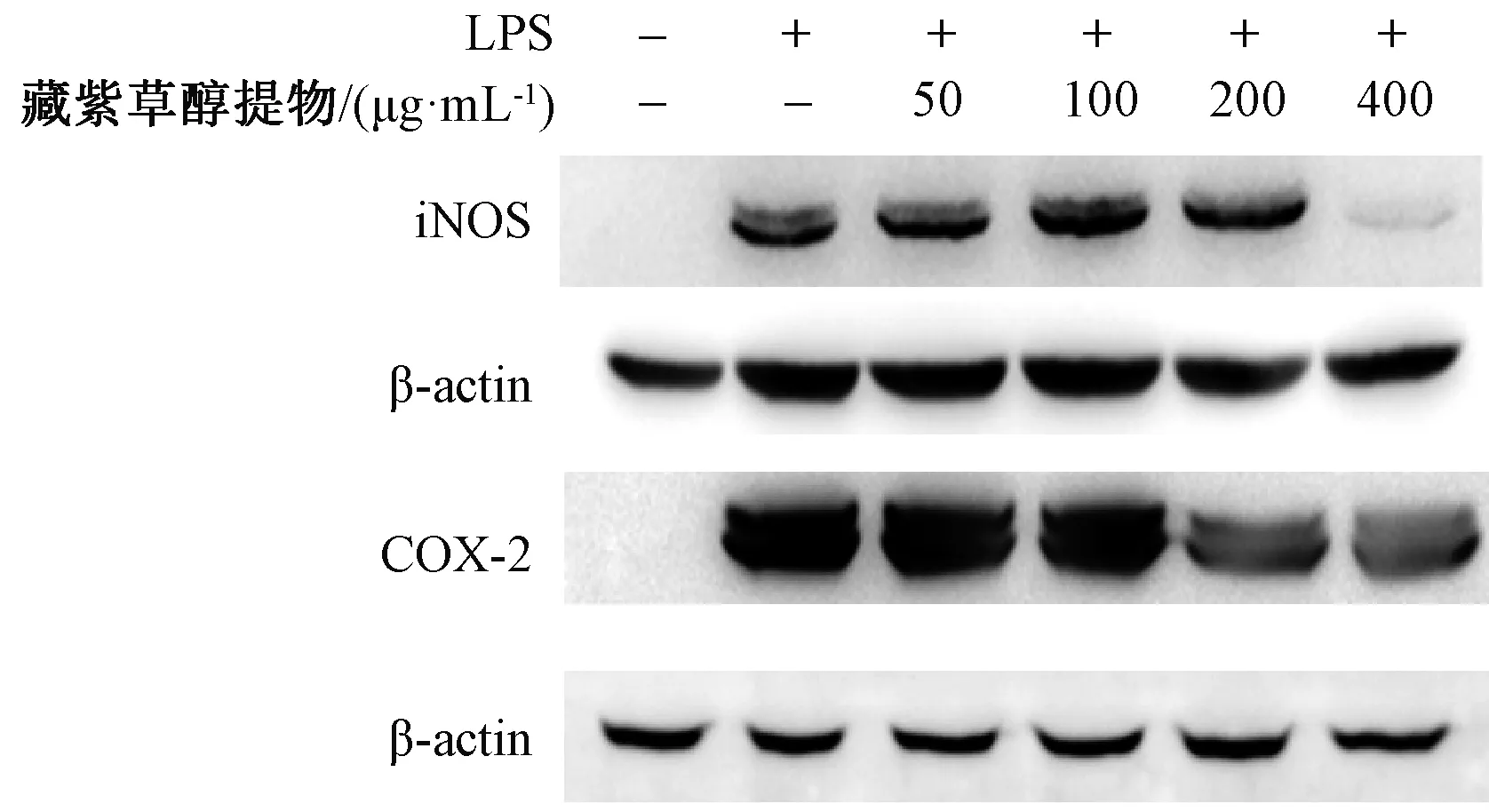
图2 藏紫草醇提物对细胞中iNOS、COX-2表达的影响

表3 各组iNOS、COX-2蛋白表达
3.5 藏紫草醇提物对LPS诱导巨噬细胞中NF-κB活化的作用 如图3、表4所示,与空白组比较,LPS组NF-κB(p65)表达升高(P<0.01);与LPS组比较,藏紫草醇提物组p65表达降低(P<0.05,P<0.01)。与空白组比较,LPS组p-IκBα表达升高,IκBα的表达降低,p-IκBα与IκBα比值升高(P<0.01);与LPS组比较,藏紫草醇提物组能抑制p-IκBα表达,促进IκBα表达,p-IκBα与IκBα比值呈剂量依赖性降低(P<0.05,P<0.01)。如图4所示,与空白组比较,LPS组p65表达升高;与LPS组比较,藏紫草醇提物组p65表达降低。

图3 藏紫草醇提物对巨噬细胞中NF-κB活化的影响

表4 各组细胞NF-κB蛋白表达

注:绿色为p65阳性染色,蓝色为DAPI细胞核阳性染色。
4 讨论
炎症反应是一种重要的机体防御过程,涉及机体活动的多个环节,其中免疫细胞激活是炎症反应的启动环节。巨噬细胞作为机体内重要的非特异性免疫细胞,是机体抵抗外界侵染的重要防线[5]。
LPS水平的升高可以刺激巨噬细胞中iNOS和COX-2蛋白表达增加。其中iNOS催化L-精氨酸产生NO,COX-2则能催化花生四烯酸代谢转化为前列腺素产物如PGE2,参与炎症反应[6-8]。实验结果表明,藏紫草醇提物能够抑制体内外炎症因子PGE2、TNF-α和IL-6等的异常上升,同时可以抑制巨噬细胞中炎iNOS和COX-2的蛋白过表达。
此外,LPS还能激活巨噬细胞中的NF-κB信号通路[9-10]。NF-κB是一种重要的转录因子,在机体的免疫应答及炎症反应中具有十分重要的地位[11-12]。在静息状态下,NF-κB(p65)与 IκBα 结合,以无活性的复合物形式存在于细胞浆中;当细胞受到LPS等刺激时,IκBα就会磷酸化降解,使NF-κB与其解离后由细胞浆转移到细胞核中,与κB位点结合,调控下游炎症基因的转录,导致多种细胞因子及趋化因子的表达,进而加重炎症[13-14]。实验结果显示,藏紫草醇提物能够浓度依赖性的抑制细胞核中p65和胞浆中p-IκBα的表达,促进胞浆中IκBα的表达。说明藏紫草醇提物能够抑制LPS诱导的巨噬细胞中NF-κB的异常活化。
综上所述,本课题组研究发现藏紫草醇提物可有效抑制LPS诱导的RAW264.7细胞炎症以及小鼠急性腹膜炎,验证了藏紫草的体内外抗炎效果,并发现其机制可能是通过抑制NF-κB信号通路异常活化进而发挥抗炎活性。此研究为藏紫草保护作用提供了理论依据,为综合开发利用藏紫草资源奠定了基础。
