Pb和Cd对森林土壤细菌功能多样性及群落结构的影响
2021-11-26李大乐陈建文李君剑
李大乐,陈建文,张 红,李君剑
山西大学黄土高原研究所, 太原 030006
在2014年的全国土壤污染调查报告中显示,重金属Cd、Pb严重超标[1]。Cd以移动性大、毒性高、污染面积大被称为“五毒之首”,并且被国际癌症研究机构列为第一类致癌物[2]。Pb可通过空气、水、土壤和食物等多种途径进入人体,严重影响人体的中枢神经系统、肾脏和血压[3]。为了评估Pb、Cd对生物的生态风险,必须建立一套生态有效的指标体系,从而准确量化重金属在环境污染治理中的毒性[4]。瑞典科学家Hakanson提出的潜在生态危害指数法(The Potential Ecological Rick Index,RI)[5]是目前最常用的评价重金属污染程度的方法之一,它可以用来表征生态系统所面临的由多种重金属引起的整体生态风险。因此,被广泛应用在生物毒理学、环境化学和生态学等多个研究领域[6]。
毒性系数(The Toxic Factor,TF)作为RI中的关键参数,是Hakanson利用工业化前火成岩、土壤、淡水和陆生动植物中重金属的浓度所建立。但由于微生物中重金属浓度难以获取,Hakanson并没有将其考虑其中。微生物作为土壤的重要组成部分,在分解有机质、养分循环和改变养分对植物的可利用性方面发挥着至关重要的作用[7]。许多研究表明土壤中Cd和Pb含量达到一定浓度时,会导致微生物群落的变异性增大,降低群落稳定性[8- 9]。Schneider等[10]研究结果表明随着土壤Pb浓度升高疣微菌门的丰度降低,Li等[11]研究结果表明硫杆菌属、Bellilinea和Gp16与土壤Cd含量呈显著正相关,而Longilinea、Gp2和Gp4呈显著负相关。并且在Pb和Cd复合污染下细菌丰富度和多样性均显著低于未污染土壤[12]。因此,探究Pb、Cd的TF值是否适用于评估重金属对微生物的生态风险具有重要的意义。
本研究在相同生态风险水平下设计Pb污染和Cd污染,构建微宇宙实验,利用Biolog-ECO板和高通量测序技术分析Pb和Cd对微生物功能多样性和群落结构的影响,对比两者之间的差异性,探究Pb和Cd的TF值是否适用于评估重金属污染微生物的潜在生态风险,为重金属生态风险评价提供新的科学依据。
1 材料与方法
1.1 样品采集及理化性质的测定
土壤样品采集地位于山西省天龙山自然保护区的一处油松林(37°42′N,112°27′E),清除表面覆盖物,采集0—10 cm处表层土壤,类型为褐土。土壤去除根系、枯落物,过2 mm筛后分为两份,一份用于微宇宙实验,一份自然风干后用于理化性质的测定。土壤总氮(TN)、总碳(TC)和总硫(TS)由元素分析仪(vario macro cube, elementar, Germany)测定,采用电感耦合等离子体质谱仪(ICP-MS, Thermo Elemental, X7系列)测定砷(As)、镉(Cd)、铬(Cr)、铜(Cu)、镍(Ni)、铅(Pb)和锌(Zn)的浓度(表1)。

表1 土壤理化性质
1.2 潜在生态危害指数法(RI)
潜在生态危害指数法(RI)的计算公式:
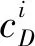
1.3 微宇宙实验
微宇宙实验的建立:称取相当于40 g干重的土壤置于150 mL的培养杯中,以原始土壤中的重金属含量为背景值,根据上述的潜在生态危害指数(RI),通过向培养杯中添加不同浓度的Pb (CH3COO)2和CdCl2,获得强(H,RI=400)、中等(M,RI=200)和轻微(L,RI=100)3种生态风险水平,原始土壤作为空白对照(CK),分别记作H-Pb、H-Cd、M-Pb、M-Cd、L-Pb、L-Cd和CK,各3个重复。土壤样品中Pb和Cd的含量及生态风险如表2所示,由于Pb和Cd的毒性系数分别为5和30,所以CK的RI水平为35。调节土壤样品的充水孔隙度(WFPS)为60%,置于恒温培养箱中25℃黑暗条件下培养,每2 d打开一次保证其有氧条件,45 d后破坏性取样进行后续分析。

表2 微宇宙培养土壤处理
1.4 土壤微生物功能多样性的测定
利用Biolog-ECO板对微生物群落功能多样性进行分析。称取相当于5 g干重的土壤置于三角瓶中,加入45 mL无菌0.9% NaCl溶液,振荡30 min(转速200 r/min)后,静置30 min后吸取土壤样品上清液并稀释到0.1%,再用8通道加样器将稀释液接种到Biolog-ECO生态测试板上,接种量为150 μL,每样1板,每板3个重复。将接种好的测试板加盖,在25℃下连续培养10 d,每隔24 h用Infinite 200 PRO(TECAN, Sweden)在590 nm下测定其吸光度。土壤细菌群落利用碳源的整体能力用平均颜色变化率(Average well color development,AWCD)表示,选择细菌群落生长平台初期的AWCD值进行碳源利用功能多样性分析,土壤细菌群落功能多样性指数分析采用Shannon指数(H)、Simpson指数(D)和McIntosh指数(U),AWCD值和指数的计算公式详见文献[14]。
Biolog-ECO平板技术测定的群落功能多样性指数是利用不同种类的微生物对碳源的利用能力不同而产生的不同碳源利用模式来表征微生物群落差异。其中,Shannon指数(H)可以表征土壤中细菌群落丰富度,McIntash指数(U)则可反映土壤中细菌群落均匀度,Simpson指数(D)可以评估土壤中细菌群落优势度(指数越高,微生物多样性越低),以上3种指数表征细菌群落的功能多样性。
1.5 DNA提取、定量PCR及高通量测序
使用Ultra-cleanTM土壤DNA分离试剂盒(MoBio Laboratory,USA)从0.25 g土壤中提取各生态风险水平下土壤的DNA。通过定量PCR测定土壤细菌丰度,引物为338F(5′-ACTCCTACGAGGAGCA- 3′)和534R(5′-TTACCGCGGCTGCTGGCAC- 3′),反应体系为20 μL:7.6 μL ddH2O,10 μL SYBR® Premix Ex TaqTM Ⅱ,2.0 μL样本DNA,条件为: 95℃变性10 min, 95℃变性30 s,53℃退火45 s,72℃延伸90 s,35个循环。
采用338F(5′-ACTCCTACGGGAGGCAGCAG- 3′)和806R(5′-GGACTACHVGGGTW-TCTAAT- 3′)引物对16S rRNA基因的V3—V4可变区域进行PCR扩增。扩增体系为20 μL,扩增条件为:95 ℃预变性3 min,循环条件为:95℃变性30 s,53℃退火30 s,72℃延伸45 s,29个循环,72℃终延伸10 min。扩增产物纯化并利用NanoDrop 2000测定DNA纯度和浓度。在Illumina公司的MiSeq PE300平台上进行测序。
1.6 生信分析
首先使用fastp软件对原始测序序列进行质控,过滤去除低质量序列。使用Uparse软件根据97%的相似度对序列进行OTUs聚类,在聚类过程中去除嵌合体。在Silva 16S rRNA数据库(v138)中对基因序列进行比对,采用RDP classifier方法(置信阈值为0.7)对每条序列进行物种分类注释,得到的OUTs数据按最小样本序列数抽平进行后续统计分析。通过计算获得每个土壤样品中细菌群落的基因多样性指数(ACE、Chao1、Shannon)与上述的功能多样性指数不同,此处的多样性指数是指基于分类学的多样性指标(taxonomic diversity),这些指标在一定程度上反映了群落或生态系统的某些特性,其中,Chao1和ACE指数反应细菌群落的丰富度,指数越大,群落的丰富度越高;Shannon指数综合反应细菌群落的丰富度和均匀度,指数越大,群落的多样性越高。高通量测序和生信分析在美吉生物医药科技有限公司(上海)完成。
1.7 数据分析
采用单因素方差分析(one-way ANOVA)比较相同生态风险水平下土壤的细菌丰度、孔平均颜色变化率(AWCD)、碳源代谢强度、功能多样性指数和基因多样性指数的差异。采用主成分分析(PCA)对土壤细菌群落31种碳源的AWCD值进行分析。数据通过Excel 2013和SPSS 24.0进行处理和分析,作图采用Excel 2018、R 3.5.1及Canoco 5等完成。
2 结果与分析
2.1 土壤细菌丰度的差异

图1 不同处理下的细菌丰度 Fig.1 The bacterial abundance in different treatment不同的小写字母表示有显著差异(P<0.05);L:轻微生态风险水平 Low ecological risk level;M:中等生态风险水平 Moderate ecological risk level;H:强生态风险水平 Hight ecological risk level
本研究采用定量PCR来定量所有土壤样品中细菌群落的DNA拷贝数,用其表征土壤样品中的细菌丰度(图1)。随着RI水平的升高,细菌丰度呈下降的趋势,CK为最大值(3.79×109)拷贝数/g干土。在相同的RI水平下,Pb污染土壤的细菌丰度均显著大于Cd污染(P<0.05)。
2.2 土壤细菌碳源利用的差异性
AWCD值可以判断土壤中细菌群落对碳源的利用能力,是细菌功能性的一项重要指标。随时间的变化不同处理土壤样品的AWCD值逐渐增加,在第168 h时各样品的AWCD值基本达到平台期,因此采用第168 h的AWCD值进行分析(图2)。3种生态风险水平下土壤样品的AWCD值均小于CK,且随着RI水平的升高而降低(图3)。表明重金属污染会对细菌群落的碳源利用率造成不利的影响。在相同RI水平下,不同重金属处理之间的AWCD值也表现出显著差异,无论是轻微、中等还是强风险水平下,Pb污染土壤样品的AWCD值均显著大于Cd污染(P<0.05)(图3)。
功能多样性指数可以反映土壤细菌群落利用碳源类型的差异性。与AWCD值相似,在所有处理中,CK的功能多样性指数均为最大(图4),表明CK土壤细菌种类最多、分布较均匀且对碳源利用程度最高。对比相同RI水平下的Pb污染和Cd污染我们发现,功能多样性指数Shannon指数和McIntash指数均存在显著差异(P<0.05),Pb处理显著高于Cd处理(P<0.05)。而对于Simpson指数则无显著差异,表明相同RI水平下不同重金属处理对土壤细菌群落中的优势种影响不大。
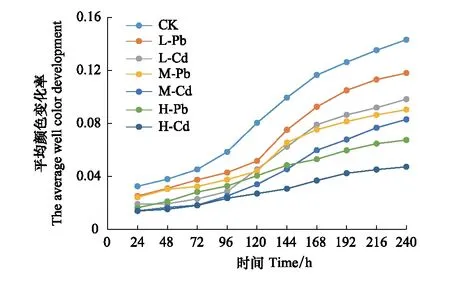
图2 不同处理下细菌培养过程中平均颜色变化率(AWCD)Fig.2 AWCD changes of bacterial communities in different treatments

图3 168h平均颜色变化率(AWCD)Fig.3 Average color change rate (AWCD) at 168h
为了更全面的了解不同处理之间细菌对碳源利用率的差异性,将31种碳源分为6类(糖类、羧酸、氨基酸、酯类、醇类和胺类)进行分析比较(图5)。所有土壤样品对糖类和羧酸的利用率较高。与CK相比,重金属污染土壤样品对6类碳源的利用率均小于CK。在3种相同RI水平下,Pb污染对糖类和羧酸的利用强度均显著大于Cd污染(P<0.05),而对其余4类碳源的利用强度无明显差异。
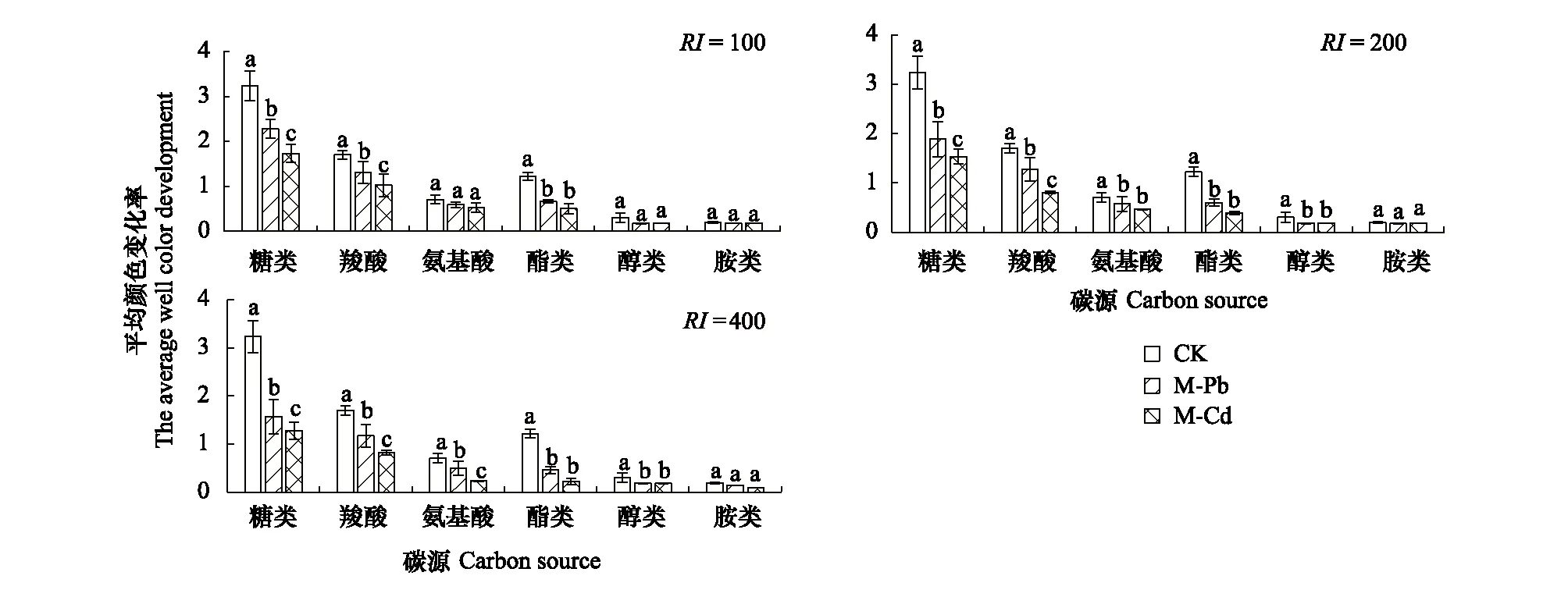
图5 不同处理下细菌群落的碳源代谢强度Fig.5 The carbon utilization intensity of bacterial communities among different treatmentsRI: 潜在生态风险指数
2.3 土壤细菌群落代谢功能分析
应用主成分分析,在31个碳源中共提取7个主成分因子(表3),累积贡献率达到92.27%,从中选取累积贡献率达到49.40%的前两个主成分PC1和PC2(特征根分别为9.20和6.11)来分析细菌群落功能的综合差异和相似状况。如图6所示,不同处理在PC轴出现了明显的分异,在相同RI水平下Pb污染和Cd污染各为一类,可见PC1和PC2能区分不同处理细菌微生物的群落特征。
考虑到各个主成分反应的变异问题,本研究进一步计算了PC1与PC2的综合得分(表4)。CK与其余样品在PC1和PC2上得分系数均表现出显著差异(P<0.05)。在相同RI水平下,Pb污染和Cd污染在PC1轴上得分系数均表现出显著差异(P<0.05)。在PC2轴上,只有强危害水平下的Pb污染和Cd污染之间表现出差异性(P<0.05)。从第一主成分和第二主成分的综合得分来看,不同处理间均有显著性差异(P<0.05)。表明不同处理土壤样品中细菌群落具有不同的碳源利用模式。

表3 主成分特征根
表4 不同处理下主成分得分系数
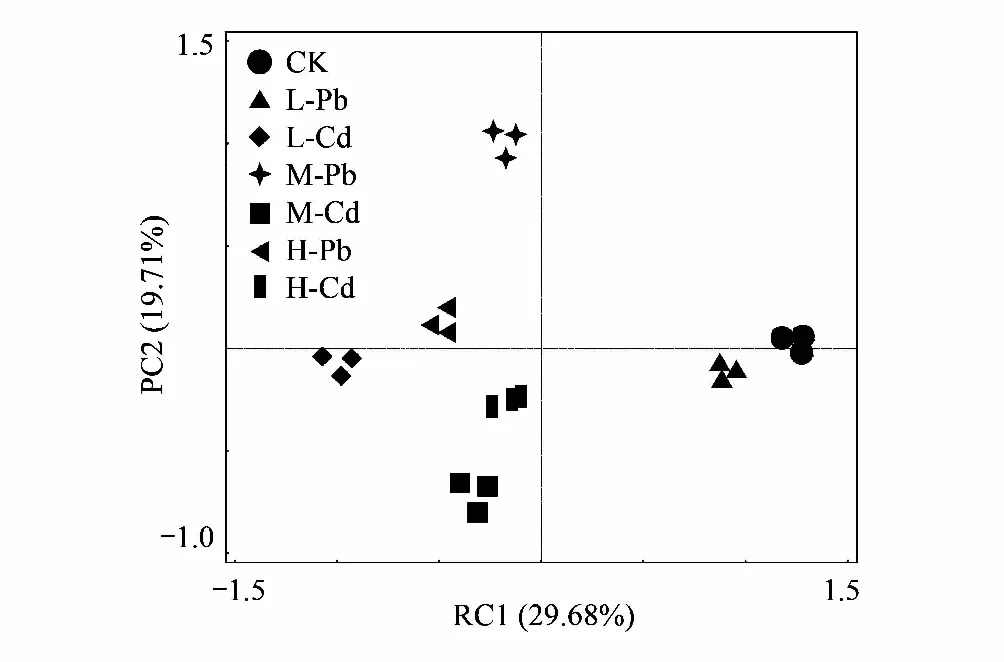
图6 不同处理下细菌碳源利用特性的主成分分析(PCA) Fig.6 Principal component analysis for carbon utilization of soil bacterial community among different treatments
2.4 土壤细菌群落多样性及群落结构
对所有土壤样品的16s rDNA V3—V4可变区域测序,每个样品得到29974个序列,以97%相似度划分,得到4308个OTUs,共30个门,85个纲,230个目,383个科,641个属和1417个种。
通过Venn图可以直观地表现不同土壤样品中OTUs数目组成的相似性及重叠情况(图7)。在RI=100时,OTUs数量为L-Pb(2527)>CK(2497)>L-Cd(1356);RI=200时,CK(2479)>M-Pb(2486)>M-Cd(1711);RI=400时,CK(2479)>H-Pb(1895)>H-Cd(1496)。除了在RI=100时,L-Pb的OUTs数量大于CK,其他RI水平下CK的OUTs数均为最大,在所有RI水平下Pb污染的OUTs数量均大于Cd污染。同时,图8的基因多样性指数ACE指数和Chan1指数也验证了上述物种丰富度的排名,Pb污染均显著大于Cd污染(P<0.05)。而在物种多样性和均匀性上,由Shannon指数可以看出相同RI水平下Pb污染和Cd污染之间无显著差异。
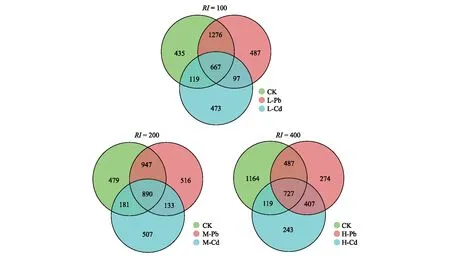
图7 不同RI水平下不同处理OTUs的韦恩图Fig.7 The Venn diagram of OTUs under different treatments at the different RI levels
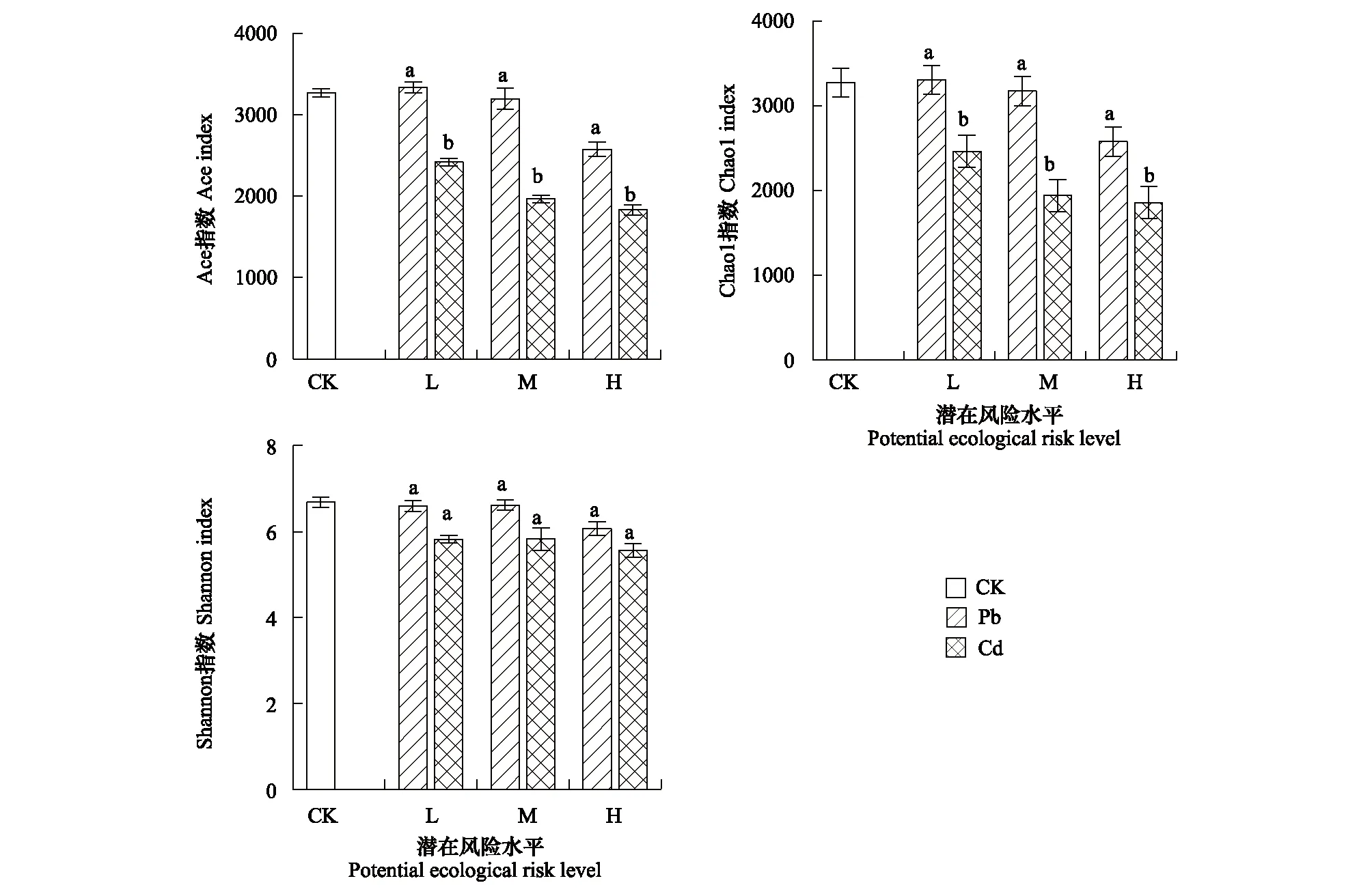
图8 不同处理下细菌的基因多样性指数Fig.8 The gene diversity index of bacteria in different treatments
从细菌群落结构来看,相同RI水平下的Pb污染和Cd污染之间也存在差异性。在门分类水平上,相对丰度大于1%的细菌门共有11个(图9)。变形菌门(Proteobacteria)为主要菌门,在7组样品中占比均在42%以上。其他优势菌门分别为放线菌门(Actinobacteria,12.96%—17.76%)、酸杆菌门(Acidobacteria,8.49%—17.94%)和绿弯菌门(Chloroflexi,2.14%—12.87%),大约占总菌数81%以上。在相同RI水平下,Pb污染土壤样品中变形菌门的相对丰度均小于Cd污染,分别为L-Pb(44.96%)、L-Cd(55.57%)、M-Pb(42.77%)、M-Cd(52.91%)、H-Pb(36.87%)和H-Cd(51.29%)。而绿弯菌门的相对丰度则表现相反的趋势,Pb污染均大于Cd污染,L-Pb是L-Cd的3.6倍,M-Pb是M-Cd的4.8倍,H-Pb是H-Cd的4.5倍。
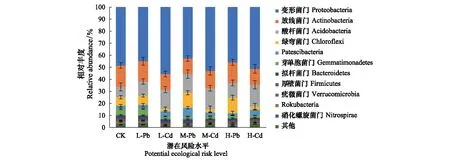
图9 不同处理门水平土壤细菌群落的相对丰度Fig.9 The relative abundance of soil bacterial communities at phylum level in different treatments
将相对丰度前30的属以热图的形式呈现,通过颜色的深浅将数据的大小直观表现出来(图10)。变形菌门有14个属,酸杆菌门有7个属,放线菌门和绿弯菌门各有3个属,芽单胞菌门(Gemmatimonadetes)、Patescibacteria和Rokubacteria各有1个属。在相同RI水平下,大部分属在Pb处理和Cd处理之间也具有不同的相对丰度,如慢生根瘤菌属(Bradyrhizobium)、鞘脂单胞菌属(Sphingomonas)、链霉菌属(Streptomyces)和norank_f__Roseiflexaceae等。
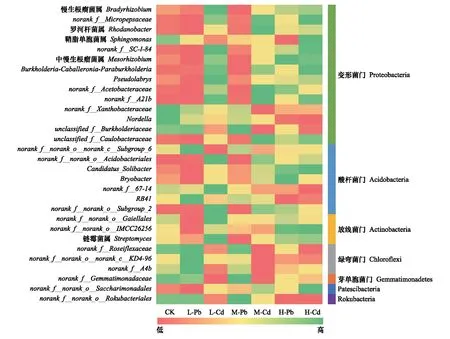
图10 不同处理属水平土壤细菌群落的相对丰度Fig.10 The relative abundance of soil bacterial communities at genus level in different treatments
3 讨论
细菌对重金属的胁迫响应有多种方式,如群落数量的减少、功能多样性的降低以及群落结构的改变等,这些细菌参数通常被用作重金属污染的指示[15]。Pb、Cd污染土壤样品中的细菌丰度均小于CK(图1),并且随着RI水平的升高,细菌丰度呈下降趋势。这表明Pb、Cd污染会降低土壤细菌丰度,污染程度越高对细菌丰度的影响越大,这与李勇等人[8]的研究结果相似。在相同RI水平下,Cd污染土壤中的细菌丰度显著小于Pb污染(P<0.05),表明Cd对细菌丰度的毒害作用大于Pb。这可能是由于Cd对土壤胶体亲和力低,移动性很大[16],重金属对细菌的可利用性大。而Pb在土壤中受各种物理、化学作用的影响,总体上是由不稳定态向稳定态转变,活性和毒性呈降低趋势[17]。
AWCD值是反映土壤微生物代谢活性的一个重要指标,AWCD值越大,表明土壤微生物的活性越高,对碳源利用率越高[18]。CK的AWCD值和功能多样性指数均大于重金属Pb、Cd污染的土壤,表明土壤重金属污染会降低细菌的碳源利用率及功能多样性,Mkhinini等[19]的研究结果也证实了这一点。CK对6大类碳源的利用率均大于Pb、Cd污染的土壤样品,并且在糖类、羧酸和酯类的利用率上存在显著差异(P<0.05)。Gremion等[20]研究表明,重金属污染下的土壤微生物对氨基酸类、胺类以及氨基化合物碳源利用低。张涪平等[21]研究也表明,与对照土壤相比,矿区土壤受重金属污染区的土壤酶活性、基础呼吸和代谢商均受到了一定程度的抑制。因此对比相同RI水平下Pb污染和Cd污染的AWCD值、Shannon指数和McIntosh指数我们发现,Cd污染均显著小于Pb污染(P<0.05),在糖类和羧酸的利用率上存在显著差异(P<0.05),并且主成分分析结果也表示,Pb污染和Cd污染具有不同的碳源利用模式,这表明Cd对细菌功能多样性的胁迫作用大于Pb。
土壤中重金属污染会导致微生物多样性的下降[22]。除了L-Pb,CK的OTUs值均大于Pb、Cd处理的土壤,Chao1指数和ACE指数随着RI水平呈下降的趋势,说明重金属污染降低细菌多样性,污染程度的越高对细菌多样性的影响越大。而L-Pb大于CK可能与中度干扰理论有关,Wakelin等[23]研究表明微生物多样性最初随着重金属浓度的升高而增加,直到达到临界值后多样性急剧下降,Jia等[24]研究也得到相似的结果。相同RI水平下,Pb污染的OTUs数和群落丰富度指数(ACE指数和Chao1指数)均大于Cd污染,而Shannon指数无显著差异(P<0.05),功能多样性的Simpson指数也表现出相同结果,这表明Cd污染对细菌多样性的影响大于Pb污染,而对优势种的影响较小。这是由于重金属污染能降低原有群落的种间竞争关系,具有耐受性的抗性菌种具有更好竞争力而迅速增长成为优势菌种[25],优势菌种可能对Pb和Cd具有相同的耐受性,从而导致优势种无显著差异。重金属污染对微生物群落结构产生较显著的影响,因此我们可以通过对比细菌的相对丰度分析Pb、Cd对细菌群落结构影响的大小。所有土壤样品中的优势菌门均为变形菌门、放线菌门、酸杆菌门和绿弯菌门,这与大部分研究结果相似[26- 27]。相同RI水平下,Pb污染土壤中变形菌门的相对丰度小于Cd污染,而绿弯菌门表现出相反的趋势,属水平上不同菌属也表现出差异性,例如慢生根瘤菌属在Pb污染中相对丰度均大于Cd污染。相关研究表明变形菌门在重金属污染土壤中为最丰富菌门,其相对丰度随重金属污染程度的升高而增加[26],属于变形菌门的慢生根瘤菌属也是在中度和重度重金属污染土壤中比较丰富[28],对比本研究结果说明相对于Pb污染,Cd的污染程度更高。而绿弯菌门的差异可能是其对Pb、Cd耐受性的不同造成的,安凤秋等[29]研究表明土壤中绿弯菌门的相对丰度与Pb浓度呈显著正相关,Feng等[30]研究表明Cd污染土壤中绿弯菌门的相对丰度较低。相同RI水平下细菌群落结构的变化,体现了Pb和Cd对不同细菌菌种的毒性作用不同。腾应等[31]研究也表明在复合重金属污染的土壤中,Cd对细菌群落结构的毒性影响较为明显,Pb的影响最小。
本研究结果显示在相同RI水平下,Pb污染与Cd污染之间的细菌丰度、功能多样性和群落组成结构存在明显差异,可见相对于Cd,Pb的TF值可能被高估。Pb与Cu具有相同的TF值(Pb=Cu=5),而在Chen等[32]研究中发现相同RI水平下,相对于Cd,Cu的TF值可能被低估。因此,在评价重金属对微生物的生态风险时,Pb和Cd的TF值应当进行适当的调整。
4 结论
(1)随着RI水平的升高,Pb污染和Cd污染土壤中细菌的丰度、功能多样性和群落多样性呈下降的趋势。
(2)相同RI水平下,Pb污染土壤中细菌的丰度、AWCD值、Shannon指数、McIntosh指数以及对糖类和羧酸的利用率均显著大于Cd污染(P<0.05),主成分分析也表明Pb污染和Cd污染具有不同的碳源利用模式。
(3)相同RI水平下,Pb污染土壤中细菌的OTUs数、ACE指数和Chao1指数均大于Cd污染,而两者之间的Simpson指数无显著差异(P<0.05)。Pb污染土壤中变形菌门的相对丰度大于Cd污染,绿弯菌门则表现出相反的趋势,在属水平上各细菌的相对丰度也表现出差异性,如慢生根瘤菌属、鞘脂单胞菌属、链霉菌属和norank_f__Roseiflexaceae等。
(4)Hakanson提出的TF值不适用于重金属对微生物的生态风险评价,因此为了更全面评估重金属的生态潜在风险,有必要深入研究重金属对土壤微生物毒性效应特征。
