低碳烷烃烯烃在超微孔柔性Cu(Qc)2上的吸附行为
2021-11-26唐瑜佞王勋彭俊洁吴颖李忠
唐瑜佞,王勋,彭俊洁,吴颖,李忠
(华南理工大学化学与化工学院,广东广州510640)
引 言
发展高效的小分子气体分离技术在化学工业领域有着重要需求,如小分子烯烃烷烃的分离、甲烷氮气分离、N2和O2分离等。吸附分离技术被认为是最具发展和广泛应用前景的技术。吸附剂是吸附分离技术的核心,尤其是超微孔多孔吸附剂在小分子气体分离方面显示出优良的分离特性。金属-有机骨架(MOFs)材料[1-2]具有高比表面积、结构多样、孔道均一可调等特点。这些特征使其在超微孔吸附剂材料中占有非常重要的地位。开放的金属位点易于被客体分子接近,通过后合成修饰可以提高这些功能位点对不同客体分子的识别能力,提高吸附选择性。有机配体能够通过与金属中心多种配位方式形成不同的孔道结构,通过控制配体的种类、比例等有利于精准调控MOFs 的孔结构[3],从而选择性吸附具有不同空气动力学直径的气体分子。
针对烯烃烷烃相似物分离,吸附剂可分为烯烃选择性吸附剂[4-11],烷烃选择性吸附剂[12-17]以及烯烃筛分吸附剂[18-19]。其中烷烃选择性吸附剂能耗较低,更具有发展潜力和应用前景[20],利用烷烃选择性吸附剂,纯净的烯烃可以直接通过简单的吸附过程获得。Liao 等[12]合成了Zn 基MOFs 材料MAF-49,在316 K和1 bar(1 bar=0.1 MPa)下,C2H6/C2H4的IAST选择性为9,高于目前大部分的乙烷选择性材料。Liang等[13]成功制备了双配体MOFs 材料Ni(bdc)(ted)0.5,在273 K 和1 bar时,Ni(bdc)(ted)0.5对C2H6的吸附容量高达6.93 mmol/g。当压力小于1 bar时,其C2H6/C2H4的IAST 选择性为2~7.8。Lin 等[15]报道了超微孔MOFs材料Cu(Qc)2在298 K 和1 bar 下对C2H6/C2H4的IAST选择性高达3.4。Li 等[16]研究发现一种具有高乙烷选择性的MOFs 材料Fe2(O2)(dobdc),在298 K 和1 bar下该材料对C2H6/C2H4的IAST 选择性可达4.4,但该材料的水汽稳定性较差,需要在氮气氛围才能保存。
一般认为,多组分吸附分离通常主要基于三种机制:热力学平衡分离、动力学分离和分子筛分机制。然而,人们在新近的实验研究中曾发现和观察到一些现象,存在一些MOFs,即使孔径小于待分离混合物分子的动力学直径,其仍能有效地将这些混合物进行分离,这类MOFs 被称为柔性MOFs。通过改变温度、压力或者其他物理和化学环境,柔性MOFs 会出现不同程度的结构和形态改变。其具有的“呼吸”和“门控现象”特性使其在气体分离等领域更具优势[21-25]。与刚性材料相比,柔性MOFs 在框架和孔尺寸等方面的设计更加困难,其柔性主要依赖于主体框架、客体、粒子特性或外部的物理环境。有机配体的桥连长度与非配位侧基对MOFs 骨架的柔性起到了重要作用[26-29]。客体分子的类型和数量对柔性MOFs 的结构也有很大程度上的决定作用[30-31]。
Li 等[9]研究发现,二维MOFs 材料ELM-12 的孔径约为4.0 Å(1 Å=0.1 nm),小于丙烯和丙烷的分子动力学直径,但它却能吸附丙烯丙烷,在308 K 下它对C3H6/C3H8的动力学选择性为971。Peng 等[8]研究发现Zn 基MOFs 材料Zn(ox)0.5(trz),孔径约2.9 Å,在323 K 下C3H6/C3H8动力学选择性高达1565。Cu(Qc)2是一种超微孔MOFs材料[15],最稳态结构的贯通孔径为3.38 Å,常压下几乎不吸附N2[32],但能吸附乙烷、乙烯、丙烷和丙烯,在298 K 和1 bar 下其对C2H6/C2H4的IAST 选择性高达3.4,该材料还具有优良的水汽稳定性[33],是目前最好的乙烷选择性吸附材料之一。出现这些现象,应用传统的吸附分离理论是难以解释的,其背后可能隐含着新的分离机理,有待人们认识、开发和利用。
Cu(Qc)2是一种超微孔柔性MOFs 材料,又具有优良的水汽稳定性,在小分子气体分离方面具有很好的应用前景。本文拟采用实验与模拟相结合的方法,研究揭示超微孔柔性Cu(Qc)2分离低碳烷烃烯烃的机制,为开发和利用超微孔柔性MOFs 材料提供有价值的参考和借鉴。工作主要涉及在常温下合成超微孔柔性MOFs 材料Cu(Qc)2,测定部分低碳烷烃烯烃(CH4/C2H4/C2H6/C3H6/C3H8)在该材料上的吸附等温线,计算吸附热并估算吸附选择性,通过吸附动力学曲线计算C2H6/C2H4在材料上的扩散时间常数和扩散活化能,应用分子模拟阐明C1~C3在超微孔柔性Cu(Qc)2上的吸附分离机理。
1 实验材料和方法
1.1 主要试剂和材料
喹啉-5-羧酸(HQc),C10H7NO2,98%,阿拉丁试剂(上海)有限公司提供。六水合四氟硼酸铜水溶液,Cu(BF4)2·6H2O,45%,上海麦克林生化科技有限公司提供。氧化锌,ZnO,99%,天津市大茂化学试剂厂提供。文中所用气体纯度均大于99.99%,广州盛盈气体公司提供。
1.2 Cu(Qc)2的制备
采用羟基复盐作为中间体在常温下合成Cu(Qc)2,然后进行活化,具体步骤如下[33]。
(1)将0.29 mmol 的ZnO 和0.58 mmol 的45%Cu(BF4)2·6H2O 水溶液加入12 ml 无水乙醇(EtOH)中,并在室温下超声10 min 溶解,得到(Zn,Cu)羟基复盐溶液。
(2)将0.58 mmol HQc 溶解于12 ml 的N,N-二甲基甲酰胺(DMF)中。
(3)将步骤(1)所得溶液倒入步骤(2)液体中,所得混合溶液在室温下搅拌12 h 后过滤得到紫色粉末。
(4)纯化:用25 ml 的DMF 洗涤产物三次,再在EtOH中浸泡一天,每隔12 h更换一次溶剂。然后将浸泡后的材料过滤,在60℃下鼓风干燥2 h,最后在120℃下真空干燥8 h得到产物Cu(Qc)2。
1.3 表征测试仪器
扫描式电子显微镜,Hitachi SU8220 型,日本Hitachi 公司;热重分析,STA-200 型综合热分析仪,中国北京恒久科学仪器公司。
1.4 样品吸附等温线测定
采用美国Micromeritics 公司的比表面积和孔径分布分析仪Micromeritics ASAP 2010 测试材料在196 K下对CO2的静态吸附-脱附等温线。采用美国Micromeritics 公司的全功能型多用分析仪3Flex 测定Cu(Qc)2在不同的温度下对C1~C3的静态吸附等温线。测试前,称取80~100 mg样品装填入吸附管中,并在120℃下真空脱气4 h以上进行预处理。
1.5 吸附动力学测定
应用美国TA 公司TGA55 热重分析仪,利用重量法测试Cu(Qc)2对C2H4和C2H6的吸附动力学曲线。测试压力为0.5 bar,温度分别为298、303 和308 K。测试前,称取约10 mg 样品置于天平,在120℃下用流速为40 ml/min 的氩气吹扫样品1 h 以上,以除去样品中的客体分子。
1.6 分子模拟
使用Materials Studio 中的Fortcite 模块进行结构能量最小化(结构优化)计算。首先对材料骨架本身进行结构最优化,得到优化的结构后,再放置不同的吸附质分子分别进行结构优化。其中,吸附剂采用2×2×2 晶胞大小的模拟尺寸,针对不同的吸附质分子,采用单个分子模拟,即控制吸附剂中只吸附一个吸附质分子,以模拟分子对材料结构的影响。优化过程中需保持材料骨架的原子和吸附质原子,以及材料晶胞参数(包括边长和角度)弛豫,以使系统能量能够达到最低(即最稳态)。模拟过程中采用UFF 力场[34]描述原子间的范德华作用力,UFF力场已被证明能够较准确描述MOFs 与轻烃分子之间的范德华作用力[35-36]。库仑力则基于原子的配分电荷用Ewald 加和法描述,其中材料中原子和吸附质中原子的电荷使用QEq 方法计算。范德华力和库仑力的截断半径设为10 Å。结构优化采用Quasi-Newton算法,收敛精度则分别设置能量、作用力、外力和距离为1×10-4kcal/mol(1 kcal=4.18 kJ)、5×10-3kcal/(mol·Å)、5×10-3GPa 和5×10-5Å。优化过程中,若同时达到上述的收敛精度,则认为优化已收敛,计算结束。不同的吸附质分子,收敛所需要的步数各不相同,取决于计算是否已达到收敛精度。其中,甲烷吸附构型需要355 个优化步,乙烷需要770 步,乙烯需要420 步,丙烷需要855 步,丙烯需要365 步。经过优化后,吸附构型的能量最小,即结构达到最稳定状态。
1.7 固定床吸附透过实验
使用固定床吸附透过实验装置测试C2H6/C2H4二元混合气体在Cu(Qc)2固定床上的动态分离效果。不锈钢固定床填充柱长度为20 cm,内径为4 mm,样品质量为1 g。测试过程中进料气体的组成和流量由质量流量计控制。在进行测试之前,需将装有样品的填充柱置于120℃下真空干燥4 h 以上,以保证材料中的客体分子全部脱除,同时,需用待测气体吹扫管道30 min,以保证管道中不含有其他杂质气体。
2 实验结果与讨论
2.1 Cu(Qc)2表征
图1 给出了Cu(Qc)2的SEM 图。从图中可以看出,样品Cu(Qc)2为菱形层状结构,这与报道的晶体结构相同[32](图2)。图3 给出了样品Cu(Qc)2的TGA曲线。结果显示在温度到达260℃前,样品能够保持稳定的骨架结构,具有良好的热稳定性。

图1 Cu(Qc)2的SEM图Fig.1 SEM image of the as-synthesized Cu(Qc)2

图2 Cu(Qc)2的晶体结构Fig.2 Crystal structure of Cu(Qc)2

图3 Cu(Qc)2的热重分析曲线Fig.3 Thermogravimetric analysis curve of Cu(Qc)2
2.2 二氧化碳在Cu(Qc)2上的吸附-脱附等温线
图4 展示了重复测定的样品Cu(Qc)2在196 K 下的CO2吸附-脱附循环等温线以及样品暴露于潮湿空气中1年后的吸附-脱附等温线。经过三次吸附-脱附循环,样品的等温线几乎与新鲜材料的等温线是重合的,说明该材料具有良好的循环性能。同时样品暴露于潮湿空气中1 年后,其仍能保持稳定的吸附容量,例如,196 K 和1 bar 下,新合成的Cu(Qc)2对CO2吸附量为3.53 mmol/g,而暴露在空气中1 年后的样品为3.47 mmol/g,相差不到1.7%,证明了该材料在潮湿的环境中具有优异的水汽稳定性。

图4 Cu(Qc)2对CO2的吸附-脱附等温线(196 K)Fig.4 CO2 adsorption-desorption isotherms at 196 K of Cu(Qc)2
2.3 烷烃烯烃在Cu(Qc)2上的吸附等温线和等容吸附热
图5 展示了Cu(Qc)2对低碳烷烃烯烃的吸附等温线。相同条件下(298 K,1 bar)Cu(Qc)2对低碳烷烃烯烃的吸附容量为C3>C2>C1。这是因为对于同系物,分子量越大,其极化势越大,与吸附剂表面形成的作用力也越大,吸附量也就越高。此外,这些气体的吸附容量均随着温度的升高而降低,说明这些气体在该材料上的吸附均为物理吸附。值得注意的是:对于C2相似物,C2H6的吸附容量明显高于C2H4,属优先吸附乙烷的吸附材料;对于C3相似物,在低压下C3H6的吸附容量高于C3H8,而随着压力逐步增大,C3H8的吸附容量变成略高于C3H6。Cu(Qc)2为二维堆叠结构,无吸附分子的状态下其最稳态结构的贯通孔径为3.38 Å。而乙烷和乙烯的分子动力学直径分别为4.44 和4.16 Å,丙烷丙烯的分子动力学直径分别为5.12和4.68 Å。这些烯烃烷烃的分子动力学直径均大于Cu(Qc)2的贯通孔径,却能吸附在Cu(Qc)2的孔隙结构中,这用传统的吸附理论是难以解释的。出现这种现象应当是与Cu(Qc)2本身的柔性结构以及吸附质的分子动力学直径可变性有关。本文在假设吸附质分子动力学直径不变的前提下,主要从吸附剂材料本身的柔性出发,对该现象进行分析,将在计算模拟部分进行详细的机理研究和讨论。

图5 不同温度下烷烃烯烃吸附等温线Fig.5 Adsorption isotherms of alkanes/alkenes at different temperatures
等容吸附热(ΔHs)通常用于估计吸附剂与吸附质之间的吸附作用力[37]。基于实验测定的不同温度下的吸附等温线,运用Clausius-Clapeyron 方程[38]计算烷烃烯烃的等容吸附热,方程如下:

式中,T为温度,K;p为压力,kPa;R为理想气体常数,J/(mol·K);C为任意常数;ΔHs为在一定的吸附容量下气体的等容吸附热,kJ/mol。
图6 显示乙烷的吸附热明显高于乙烯,丙烷的吸附热略高于丙烯,从热力学上反映了材料对乙烷/乙烯体系的分离能力应该好于丙烷/丙烯体系。

图6 烷烃烯烃在Cu(Qc)2上的等容吸附热Fig.6 Isosteric heats of alkanes/alkenes adsorption on Cu(Qc)2
2.4 C2H6/C2H4在Cu(Qc)2上的选择性
应用理想吸附溶液理论(IAST)[39]模型计算Cu(Qc)2对C2H6/C2H4的吸附选择性。首先需要使用Dual-Site Langmuir-Freundlich (DSLF)吸附等温线模型对单组分气体的吸附等温线进行拟合。DSLF 吸附模型表示如下:

式中,q为平衡吸附量,mmol/g;p为平衡压力,kPa;qm,1、qm,2分别为吸附位点1、位点2 的饱和吸附量,mmol/g;b1、b2分别为吸附位点1、位点2的亲和系数,kPa-1;c=1/n1,t=1/n2,n1、n2为相对于理想均匀表面的偏差。
将DSLF模型与IAST结合以预测混合气体的选择性[40]。含有组分1 和组分2 的二元混合物的吸附选择性[41]定义为:

式中,xi、yi分别为组分i在吸附相、气相中的摩尔分数。
图7 展示了Cu(Qc)2对C2H6与C2H4体积比为1∶1的IAST 模型计算的吸附选择性。结果显示C2H6/C2H4的IAST 选择性随温度的升高而下降。在273 K和1 bar 下,IAST 模型预测的材料对C2H6/C2H4二元混合气体的选择性达到了4.6,高于最近报道的大部分乙烷选择性吸附剂(详见附录)。

附录 部分吸附剂对C2H4/C2H6吸附性能比较(1 bar)

图7 不同温度下Cu(Qc)2对C2H6/C2H4的吸附选择性Fig.7 Selectivity of Cu(Qc)2 for C2H6/C2H4 mixture at different temperatures
2.5 C2H6/C2H4在Cu(Qc)2上的吸附动力学
吸附动力学曲线是用于估算吸附质在微孔材料(例如沸石、活性炭和金属有机骨架)中的扩散速率最可靠的方法之一。通过在动态吸附过程中监测样品室内压力的降低速率或样品质量的增加速率,可以获得吸附质在样品上的吸附动力学曲线。扩散时间常数D/r2(s-1)由扩散方程(qt/qm-t1/2)解得[42-43]。对于球形颗粒,其表面吸附质浓度一开始便会发生阶跃变化,在短时间内,吸附动力学曲线基本上呈线性,扩散方程可以近似为[44]:
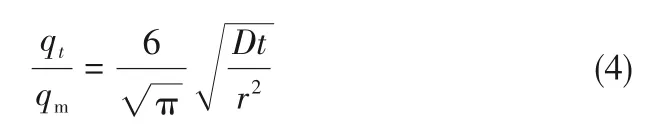
式中,t为时间,s;qt为时间t时气体的吸附量,mmol/g;qm为气体的饱和吸附量,mmol/g;D为扩散速率,cm2/s;r为等效球形粒子半径,cm。
扩散活化能由Arrhenius 公式[45]计算得到,经过变形整理,该公式可以表示为:

式中,Ed为气体分子在材料中的扩散活化能,kJ/mol。
图8 为不同温度和0.5 bar 下Cu(Qc)2对C2H6/C2H4的吸附动力学曲线。图中显示C2H6和C2H4在Cu(Qc)2上的吸附均能快速达到平衡。应用式(4)对动力学曲线进行拟合,可求出C2H6/C2H4在Cu(Qc)2上的扩散时间常数,如表1 所示。结果显示298 K 和0.5 bar 下C2H6/C2H4在Cu(Qc)2上的扩散时间常数分别为1.42×10-3和1.48×10-3s-1,数倍于改性分子筛或改性树脂类吸附剂的扩散时间常数,显示出良好的吸附动力学性能。

图8 不同温度和0.5 bar下Cu(Qc)2对C2H6/C2H4的吸附动力学曲线Fig.8 Experimental kinetic adsorption curves of C2H6/C2H4 in Cu(Qc)2 at different temperatures and 0.5 bar
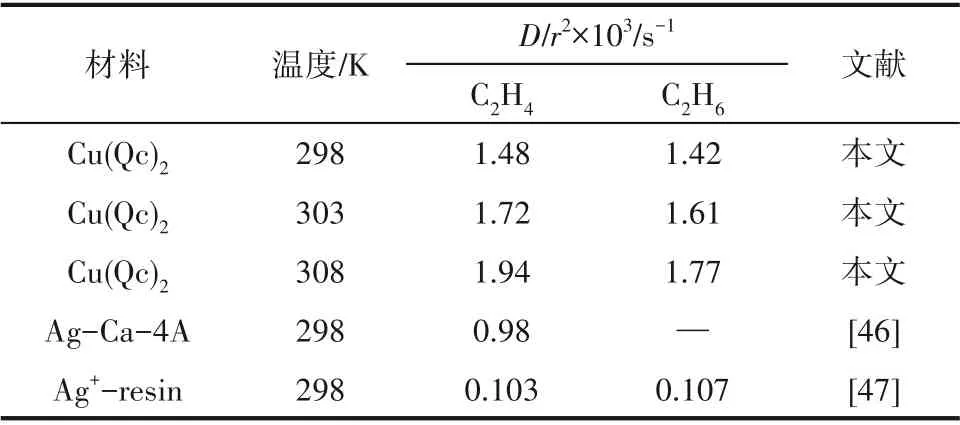
表1 C2H6/C2H4在Cu(Qc)2和其他吸附剂上的扩散时间常数比较Table 1 Comparison of diffusion time constants of C2H6/C2H4 in Cu(Qc)2 and other adsorbents
根据不同温度下吸附质在吸附剂上的扩散时间常数,应用式(5),作ln(D/r2)-(-1/RT)的直线图,从截距可以求出C2H6和C2H4在Cu(Qc)2上的扩散活化能分别为16.62 和16.43 kJ/mol,两者扩散活化能非常相近。
2.6 C2H6/C2H4 在Cu(Qc)2 固定床上的吸附透过实验
图9 展示了C2H6与C2H4体积比为1∶1 的混合气体通过Cu(Qc)2固定床的吸附透过曲线(298 K)。由图可见两种气体的透过时间差较大,应用装有Cu(Qc)2样品的固定床能够在常温下实现C2H6/C2H4二元混合气体的完全分离,表明Cu(Qc)2作为一种具有乙烷选择性的吸附剂,在从裂解气中分离乙烷和乙烯的工业应用中具有很大的潜力。
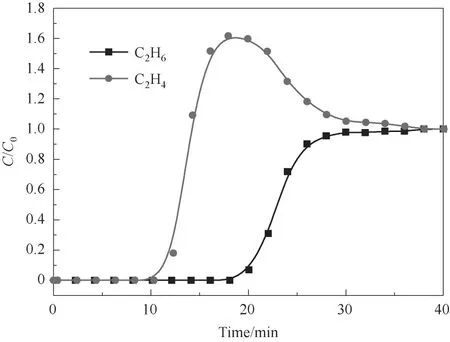
图9 C2H6/C2H4(1∶1)在Cu(Qc)2固定床上的吸附透过曲线(298 K)Fig.9 Breakthrough curves of C2H6/C2H4(1∶1)through the fixed bed of Cu(Qc)2(298 K)
3 烷烃烯烃在Cu(Qc)2上的吸附行为模拟
图10(a)示出了Cu(Qc)2为二维堆叠结构,层间无化学键连接,仅通过π-π 相互作用堆叠而成。在无吸附分子的状态下,其最稳态结构的贯通孔径为3.383 Å,层间距为6.155 Å。吸附不同的客体分子会导致材料出现不同程度的结构形变。图10(b)~(f)示出了当吸附不同分子时,吸附质分子与Cu(Qc)2的吸附构型。可见吸附质分子中碳原子数越多,分子与材料孔道内壁的作用概率越大,其中,吸附质分子中的C—H 主要与材料上的Cu 和芳香配体上的π键产生相互作用。Cu(Qc)2的结构会发生柔性形变,此形变程度与吸附的分子有关。

图10 Cu(Qc)2在不吸附或分别吸附甲烷、乙烷、乙烯、丙烷、丙烯情况下的稳态(总能量最低)结构原子颜色:Cu 橙色,N 蓝色,O 红色,C 灰色,H 白色Fig.10 Optimized structure of Cu(Qc)2 when adsorbing no gas,methane,ethane,ethylene,propane and propene,respectively Color code:Cu orange,N blue,O red,C gray,H white
当Cu(Qc)2吸附甲烷时,材料的层间距离从6.155 Å 增大到6.999 Å,如图10(b)所示;甲烷的吸附热最低(图6),为15 kJ/mol,且分子尺寸最小,易从增大的层间扩散离开,难以稳定吸附在材料中,这又使材料结构的层间距再次减小,使得材料密度出现先变小后有所回升的现象,如图11 所示,展示了Cu(Qc)2吸附不同烃类化合物分子时其密度的变化。
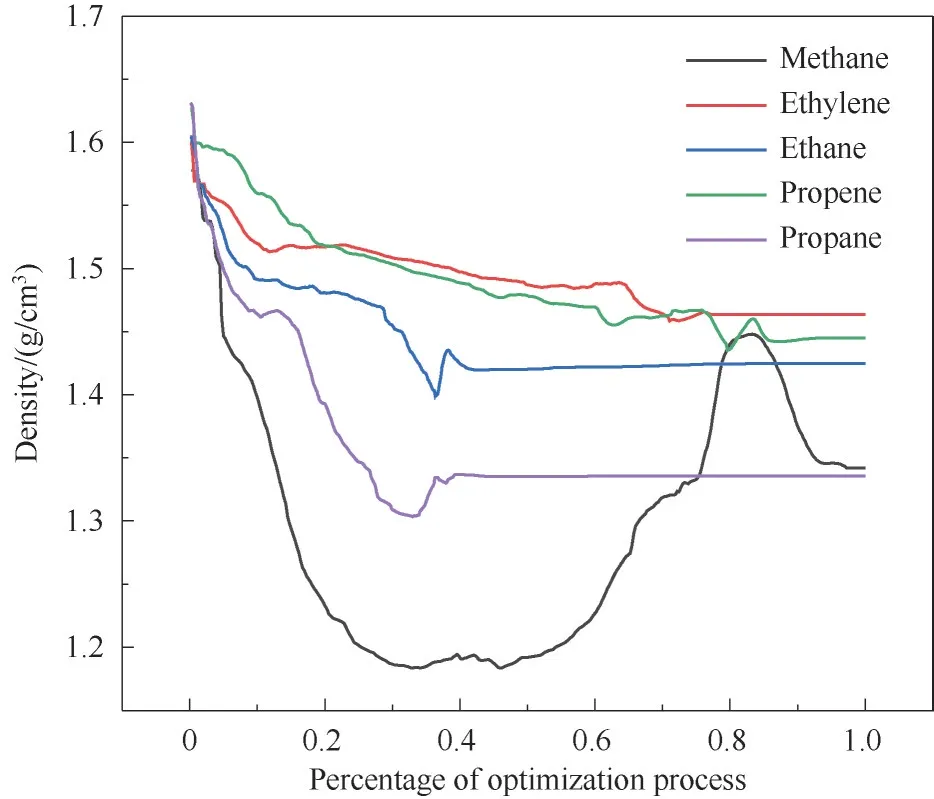
图11 结构优化过程中不同吸附质分子对Cu(Qc)2结构密度的影响Fig.11 Influence of different adsorbates on the density of Cu(Qc)2 during structural optimization
图10(c)、(d)显示,乙烷/乙烯两种分子吸附造成材料孔道变形的尺寸相似(4.444 和4.112 Å),且两者都能稳定吸附在层中的孔道中,在这种情况下,两者的分离推动力主要来源于其吸附热的差异(如图6所示,乙烷和乙烯的吸附热分别为37 和28 kJ/mol)。图10(e)、(f)显示,样品吸附丙烷/丙烯的情况与吸附乙烷/乙烯有所不同。丙烷的分子尺寸最大,其不仅造成材料的孔道尺寸变大,同时还会造成晶胞角度变大,导致两层重叠部分变小,使丙烷只能从9.886 Å×5.433 Å 孔通过[图10(e)],而分子尺寸较小的丙烯仍从6.617 Å×4.443 Å 的层叠孔通过[图10(f)],表明丙烷/丙烯的吸附环境是不同的。在此情况下,小孔径在低压下更利于提供较强的吸附作用,所以低压下材料优先吸附丙烯。当压力升高,丙烷开始进入孔道并导致孔道变大。随着孔道变大,材料能够吸附更多的丙烷,但变大的孔道又只能提供较弱的相互作用力(如图6 所示,丙烷/丙烯吸附热差异较小),最终导致材料对丙烷/丙烯的分离推动力较小,使得材料对丙烷/丙烯的分离性能差于其对乙烷/乙烯的分离性能。值得注意的是,Cu(Qc)2层间通过π-π相互作用堆叠而成,层与层之间张开的空间有限,所以体积较大的分子(乙烷、乙烯、丙烷、丙烯)难以从层间进出,需依靠孔道的柔性变化进行吸附。
4 结 论
(1)Cu(Qc)2对低碳烷烃烯烃的吸附容量为C3>C2>C1。对于C2相似物,C2H6的吸附容量明显高于C2H4,属优先吸附乙烷的吸附材料;对于C3相似物,在低压下C3H6的吸附容量略低于C3H8的,而随着压力逐步增大,C3H8的吸附容量变成略高于C3H6的。在273 K 和1 bar 条件下,IAST 预测的C2H6/C2H4在Cu(Qc)2上的选择性高达4.6,C2H6/C2H4的吸附容量比为1.57,而C3H8/C3H6在Cu(Qc)2上吸附容量差值很小。
(2)C2H6/C2H4在Cu(Qc)2上的扩散时间常数分别为1.42×10-3和1.48×10-3s-1(298 K 和0.5 bar 条件下),数倍于改性分子筛或改性树脂类吸附剂的扩散时间常数,有优良的吸附动力学性能。
(3)应用Cu(Qc)2固定床能够在常温下完全分离C2H6/C2H4二元混合气体。Cu(Qc)2是乙烷选择性吸附材料,易于制备,具有良好的水汽稳定性,是目前综合性能最好的材料之一,具有从工业裂解气中分离乙烯乙烷的良好应用前景。目前仍面临的挑战是如何将这种晶体材料成型为球形颗粒材料,在不降低分离性能的同时确保成型的Cu(Qc)2有足够的机械强度,以满足工业应用的要求。
(4)分子模拟显示,Cu(Qc)2为二维堆叠结构,无吸附分子的状态下其最稳态结构的贯通孔径为3.383 Å,层间距为6.155 Å,吸附不同分子会导致材料出现不同程度的结构形变。吸附甲烷会导致材料层间距离变大,同时由于甲烷分子尺寸最小,吸附热很低,导致甲烷容易从增大的层间扩散离开;乙烷/乙烯分子吸附造成材料孔道变形的尺寸相似,且两者都能稳定吸附在层中的孔道中,两者吸附热的差异是它们分离的主要推动力;丙烷/丙烯是吸附在不同环境,两者吸附热较相近,导致分离推动力很小。
