肢体 ⅡB 期骨肉瘤患者 CT 强化率评价化疗效果的临床研究
2021-11-26杨勇昆徐海荣牛晓辉
杨勇昆 徐海荣 牛晓辉
骨肉瘤是好发于青少年的原发恶性骨肿瘤,肿瘤恶性程度高,具有复发和转移倾向,严重威胁患者的肢体和生命健康[1]。近 20 年来,随着新辅助化疗和辅助化疗的广泛应用,骨肉瘤患者的生存率有显著提高[2-3]。肿瘤对化疗的反应是决定患者预后的重要因素,化疗效果好的患者生存率较高[4]。
如何评价化疗效果,特别是术前新辅助化疗的效果,对于患者的治疗方案的调整和预后判断至关重要。目前,最客观的评价方法是通过肿瘤坏死率判断化疗效果和肿瘤预后[4-5]。但肿瘤坏死率的应用具有一定的局限性:( 1) 临床实践中开展困难,受客观条件限制;( 2) 操作步骤复杂;不均质的肿瘤难以进行;( 3) 需要的时间长,得出结果较晚,不利于后续治疗;( 4) 增加患者经济负担。Huvos 等[6]于 20 世纪 70 年代最早提出骨肉瘤坏死率的组织学评价方法,沿用至今已有近 40 年的历史,希望寻找到新的有效的评价方法。
增强 CT 是骨肉瘤的常规检查项目,操作简便易行,不增加患者的额外负担或损伤,并且具有较好的时效性[7]。增强 CT 包括肿瘤病灶部位的骨窗、软组织窗和软组织增强窗,可显示骨破坏状况和肿瘤内部矿化程度,强化后可显示肿瘤的血运状况、肿瘤与血管的关系、在骨与软组织中的范围 等[8]。骨肉瘤作为高血运肿瘤,在增强 CT 上会表现出较高的强化率[9]。在患者术前化疗前和术前化疗后分别行增强 CT 检查,用以评估化疗效果。本研究目的是分析 ⅡB 期肢体骨肉瘤新辅助化疗前后,以 CT 强化率为代表的基于增强 CT 评价指标的变化情况,及其与肿瘤坏死率的相关性。希望为骨肉瘤的化疗效果提供可量化、客观有效的新的评价方法。
资料与方法
一、纳入标准与排除标准
1. 纳入标准:( 1) 2015 年至 2016 年在我院接受治疗的肢体 ⅡB 期骨肉瘤患者;( 2) 肢体 ⅡB 期骨肉瘤者;( 3) 骨单发肿瘤者;( 4) 化疗前后均有明确的可评价病灶者;( 5) 化疗前后均有明显的软组织包块者;( 6) 化疗前肿瘤有明显强化者;( 7) 按时间完成标准的化疗方案者;( 8) 化疗后手术切除标本行肿瘤坏死率检查者。
2. 排除标准:( 1) 有局部肿瘤放疗史者;( 2) 有栓塞或其它可能影响肿瘤血运的治疗史者;( 3) 化疗前和化疗过程中出现病理骨折或其它导致肿瘤明显出血的情况发生者;( 4) 因各种原因导致术前化疗的药物种类或剂量有调整者;( 5) 因强化造影剂过敏或其它原因导致患者化疗前 / 后未行增强 CT 检查者。
二、基本资料
本组共纳入 77 例,男 52 例,女 25 例。年龄 6~53 岁,平均 18 岁。肿瘤部位如下:股骨 45 例,胫骨 20 例,肱骨 7 例,腓骨 2 例,桡骨 2 例,尺骨 1 例。患者术前均接收甲氨蝶呤、顺铂 + 阿霉素、异环磷酰胺、甲氨蝶呤 4 周期化疗。化疗前和 4 次术前化疗后,均接收相同肿瘤部位的增强 CT 检查。
三、评价方法
患者化疗前在我院接受肿瘤部位的增强 CT 检查,4 周期新辅助化疗后在同一台 CT 再次接受相同部位的增强 CT 检查,两次 CT 检查的注射造影剂的剂量和扫描时间一致。测量 CT 值时,根据肿瘤大小在 CT 中选取 4~8 个层面,每个层面分别选取肿瘤区域测量。将囊性变或骨化的区域排除,选取剩余的实质性肿瘤区域进行测量。化疗前后分别测量肿瘤相同层面的相同区域的平扫和增强 CT 值,计算 CT 强化率:CT 强化率 = 增强 CT 值 / 平扫 CT 值 (图 1)。

图1 CT 强化率的测量和区域选择。在平扫 CT(a) 和增强 CT(b) 的相同层面上,分别选择相同的肿瘤测量区域,得出该区域的平扫 CT 值和增强 CT 值,并计算 CT 强化率。选择测量区域时应以软组织包块为主,将完全囊性变或骨化的区域排除(c 和 d) Fig.1 The CT enhancement rate measurement and region selection. The same tumor area was selected on the same level of plain CT(a) and enhanced CT(b). The plain CT value and enhanced CT value were obtained, and the enhancement rate of CT was calculated. The soft tissue mass should be selected as main measurement area, and the complete cystic or ossified area should be excluded(c and d)
四、统计学处理
采用统计软件 SPSS 20.0 进行数据分析。计算新辅助化疗前后的肿瘤平扫和强化 CT 值、肿瘤的平均 CT 强化率。计量资料采用t检验进行比较,计数资料采用χ2检验或 Fisher 精确概率法进行比较。采用均值t检验比较整体病例新辅助化疗前后的 CT 强化率差异。根据 Huvos 方法[6]计算的肿瘤坏死率大于或小于 90% 分为两组,比较分组及其化疗前后的 CT 强化率差异。P< 0.05 为差异有统计学意义。
结 果
一、基线测量结果
全部骨肉瘤病例在接受新辅助化疗前的平均 CT 强化率为 1.67(中位 1.62,1.00~2.94)。
1. 新辅助化疗后测量结果:全部骨肉瘤病例在新辅助化疗后的平均强化率为 1.40(中位 1.29, 1.00~3.51),与化疗前比较,差异有统计学意义 (F= 20.986,P= 0.000)(图 2)。

图2 化疗前后总体 CT 强化率的比较Fig.2 Comparison of overall CT enhancement rates before and after chemotherapy
2. 化疗后与化疗前比较:本组所有病例平均降低 13.9%(中位 16.1%,-27.5%~53.0%) 其中 55 例降低,平均降低 24.4%(中位 23.0%,0.6%~ 53.0%);3 例不变;19 例升高,平均升高 14.4%(中位 13.5%,0.7%~27.5%)(图 3)。

图3 化疗前后的肿瘤 CT 强化率的个体分布情况Fig.3 Individual distributions of CT enhancement rate before and after chemotherapy
二、不同坏死率分组的 CT 强化率
1. 坏死率情况:全部病例新辅助化疗后的肿瘤坏死率结果显示,31 例的肿瘤坏死率 > 90%,46 例的肿瘤坏死率 < 90%。
2. 坏死率分组的匹配情况:坏死率 > 90% 组和 < 90% 组的平均年龄分别为 19.6(7~53) 和 17.0(6~49),两组患者年龄差异无统计学意义(F= 1.399,P= 0.241)。坏死率 > 90% 组包含 19 例男性和 12 例女性,坏死率 < 90% 组包含 33 例男性和 13 例女性,两组的性别分布,差异无统计学意义 (χ2= 0.922,P= 0.337)。坏死率 > 90% 组包含股骨 19 例、胫骨 7 例和其它部位 5 例,坏死率 < 90% 组包含股骨 26 例、胫骨 13 例和其它部位 7 例,两组肿瘤部位分布差异无统计学意义(χ2= 0.312,P= 0.856)。两组在年龄、性别和肿瘤部位等,差异均无统计学意义。
3. 两组化疗前的 CT 强化率比较:初始 CT 强化率比较:坏死率 > 90% 组和 < 90% 组的平均强化率分别为 1.72(中位 1.67,1.32~2.41) 和 1.63(中位 1.61,1.00~2.94),差异无统计学意义(F= 1.045,P= 0.310)。
4. 两组化疗后的 CT 强化率比较:化疗后 CT 强化率比较:坏死率 > 90% 组和 < 90% 组的平均强化率分别为 1.20(中位 1.16,1.00~1.53) 和 1.53(中位 1.44,1.00~3.51),两组差异有统计学意义(F= 17.609,P= 0.000)(图 4,5)。

图4 化疗后坏死率不同两组的 CT 强化率比较Fig.4 Comparison of CT enhancement rate between the two groups with different necrosis rates after chemotherapy
5. 两组化疗后 CT 强化率的降低程度比较 (图 6):坏死率 > 90% 组的强化率平均降低 27.9% (中位 28.0%,-2.3%~53.0%),比化疗前显著降低,差异有统计学意义(F= 72.892,P= 0.000);坏死率 < 90% 组的强化率平均降低 4.4%(中位 1.0%,-27.5%~44.5%),与化疗前比较,差异无统计学意义(F= 1.495,P= 0.225)。

图5 化疗后坏死率不同两组的 CT 强化率的个体分布情况Fig.5 Individual distributions of CT enhancement rate between the two groups with different necrosis rates after chemotherapy
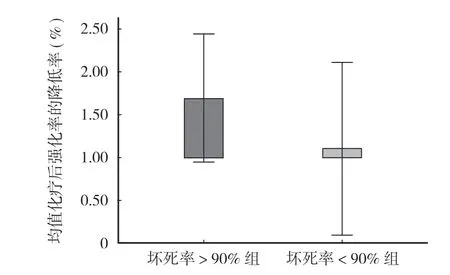
图6 化疗后坏死率不同两组的 CT 强化率的降低程度Fig.6 Reduction of CT enhancement rate between the two groups with different necrosis rates after chemotherapy
6. 两组化疗后 CT 强化率降低程度的个体分布情况(图 7):坏死率 > 90% 组中 21 例(21 / 31,67.7%) 强化率的降低率超过 20%,8 例(8 / 31,25.8%) 强化率的降低率超过 40%,4 例(4 / 31,12.9%) 强化率的降低率超过 50%,仅有 2 例 (2 / 31,6.5%) 强化率未降低;坏死率 < 90% 组中 13 例(13 / 46,28.3%) 强化率的降低率超过 20%,1 例(1 / 46,2.2%) 强化率的降低率超过 40%,无强化率的降低率超过 50% 的病例,有 20 例(20 / 46,43.5%) 强化率未降低,其中 17 例(17 / 46,37.0%) 强化率反而升高。

图7 化疗后坏死率不同两组的强化率降低程度的个体分布情况Fig.7 Individual distributions of enhancement rate reduction between the two groups with different necrosis rates after chemotherapy
讨 论
骨肉瘤为代表的原发恶性骨肿瘤患者的生存率逐渐提高,但仍有部分患者出现肿瘤复发和转移,甚至最终死于疾病。这些患者虽然接受了规范化的术前和术后化疗,但仍不能阻止肿瘤的进展,这与肿瘤对化疗药物的不敏感相关。因此,不论是医师与研究者,还是患者与家属,都十分关心且希望尽早得知肿瘤的化疗效果,从而调整治疗方案和判断肿瘤预后。笔者在临床工作中发现,骨肉瘤的肿瘤血运较为丰富,体现为增强 CT 中具有明显强化,而经过化疗后,肿瘤的强化程度会有所改变。着眼于上述现象是否能客观体现肿瘤的化疗效果,开展相关研究。本研究中首次提出以化疗前后的增强 CT 的强化率、强化率的改变程度来评价术前化疗的效果,并与受到广泛认可的客观指标肿瘤坏死率进行比较。
本研究显示,骨肉瘤病灶在接受治疗前具有较高的强化率,平均基线强化率为 1.67,最高者接近 3 倍。由此可见,骨肉瘤的肿瘤血运十分丰富,这也符合其作为生长活跃的高度恶性肿瘤的生物学特点,丰富的血液供应是肿瘤快速生长的必要条件。对于接受新辅助化疗后的骨肉瘤,笔者用同样的方法进行 CT 值测量,结果显示化疗后的整体平均强化率显著降低。整体平均降低 13.9%,降低最大幅度者超过了 50.0%。同时也发现,虽然大部分病例表现为强化率降低,但仍有将近 1 / 4(19 / 77) 的病例表现为强化率不降反升。因此,需要进一步研究强化率的上述变化的特点是否具有一定的规律和提示意义,特别是对化疗效果的提示性。大量病例的研究[4-5]显示坏死率可以提示化疗效果和患者的肿瘤学预后,分析了强化率变化特点与肿瘤坏死率这一客观指标的相关性。
本研究中包括 31 例坏死率 > 90% 和 46 例坏死率 < 90%,两组病例的年龄、性别和部位分布等一般情况无明显差异,匹配良好。两组病例化疗前的初始 CT 强化率比较无显著差异,这说明从现有的证据进行分析,初始 CT 强化率尚不能提示化疗效果乃至肿瘤的预后。
在接受新辅助化疗后,坏死率 > 90% 组和坏死率 < 90% 组的平均 CT 强化率分别为 1.20 和 1.53,两组出现显著差异。这一结果提示坏死率 > 90% 组病例的 CT 强化率降低更为显著,说明化疗后的 CT 强化率与肿瘤坏死率存在相符合的结果。而且发现,化疗后坏死率 > 90% 组强化率最高的 1 例为 1.53,这一数值仅仅达到坏死率 < 90% 组的平均 CT 强化率,这样的数据进一步验证了两组 CT 强化率整体分布的具有很大差距。组内化疗前后的比较显示,坏死率 > 90% 组的强化率显著降低(平均降低 27.9%),坏死率 < 90% 组的强化率无显著变化(平均降低仅为 4.4%)。这一结果充分说明,CT 强化率的降低与肿瘤坏死率的提高是具有相关性的,CT 强化率降低可以提示肿瘤组织坏死。分析 CT 强化率能体现肿瘤坏死率的机制,是由于有效的化疗能抑制局部肿瘤生长,导致病灶内组织坏死率,同时在一定程度上抑制肿瘤血供,因此表现为 CT 强化程度的降低和硬化程度的增加。
有研究者报道通过增强 MRI 判断骨肉瘤术前化疗的效果[10-11],试图通过测量化疗前后肿瘤的体积和强化程度的变化情况进行分析,测量方法与本研究相似。虽然取得一定的进展,但具有明显的局限性。 MRI 检查的成像原理较为复杂,图像序列多变且差异性大,其图像的灰度显示和测量技术不便于非影像科医师的常规应用和掌握,前后测量的可比性较差。而本研究中应用的增强 CT 的成像原理与 MRI 完全不同,CT 图像的成像原理较为简单,其图像的灰度值可直接反应肿瘤的强化和硬化程度,便于测量和前后数据的比较。
还有研究报道通过骨扫描[12-13]或 PET-CT 检 查[14]判断骨肉瘤的化疗效果。骨扫描虽然可以反应骨代谢的活跃程度,但是容易受到其它因素干扰,而且图像的清晰度不佳,精确的选取测量靶区域较为困难。PET-CT 检查可以通过比较化疗前后肿瘤部位的最大 SUV 值评价化疗效果,但由于价格昂贵,并不推荐用于骨肉瘤的常规检查,化疗前后的多次检查会显著增加患者的经济负担。而本研究中应用的增强 CT 的成像质量和清晰度高于骨扫描和 PET-CT 检查,可以精确的选择测量区域和层面,化疗前后进行精确的匹配和比较,而且价格低于 MRI 和 PET-CT 检查,更适用于临床的普遍应用和多次检查对比。
在骨巨细胞瘤中也开展过 CT 强化率的相关研究[15-17]。对一组比例的测量结果显示[15],骨巨细胞瘤属于高血运的骨肿瘤,初始平均 CT 强化率为 2.01,甚至超过了本研究中的骨肉瘤初始强化率。经过地舒单抗治疗后,骨巨细胞瘤的 CT 强化率显著降低,平扫 CT 值显著提高,即病灶的硬化程度显著提高。组织学检查显示用药后骨巨细胞瘤中的破骨细胞样多核巨细胞几乎消失,单核基质细胞明显减少[15-16],这样的结果在某种程度上与骨肉瘤接受化疗后的肿瘤细胞大量坏死十分相似。由此可见,进行的骨肿瘤 CT 强化率的一系列研究,不仅局限于影像学的数值分析,更重要的是将影像学数据与组织学变化相结合,从而可以更早期、简便和无创的提供骨肿瘤治疗效果的判断依据。
综上所述,本研究采用增强 CT 评价骨肉瘤新辅助化疗前后的肿瘤强化率变化,发现化疗后全部病例的平均肿瘤强化率显著降低。坏死率 > 90% 组的强化率显著降低,而坏死率 < 90% 组的强化率无显著变化。上述结果提示 CT 强化率的变化与肿瘤坏死率存在一定相关性,值得作为判断化疗效果的指标进行研究分析。今后需要开展前瞻性研究,进一步分析这种通过 CT 强化率判断化疗效果的方法的准确性和可靠性,为临床实践提供帮助。
