基于正交实验的氢氧化亚铁制备实验的改进
2021-11-25许玮凡蔡文联
许玮凡 蔡文联

摘要:设计装置简单、操作简便、现象明显的氢氧化亚铁制备,并以氢氧化钠溶液的浓度、酸溶液的浓度、反应溶液的外界温度为变量,设计正交实验,在确保白色沉淀产生时间持久的同时,探究课堂制备氢氧化亚铁的最佳演示实验效果.关键词:氢氧化亚铁制备;正交实验;条件优化
文章编号:1008-0546(2021)08-0095-03
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j.issn. 1008-0546.2021.08.025
一、问题的提出
铁及其化合物的性质实验,是《普通高中化学课程标准》要求的学生必做实验,在人教版高一化学第一册第三章第一节铁及其化合物的学习中,教材关于氢氧化亚铁的制备提供的实验方案为,在试管中加入少量FeSO4溶液,然后滴加NaOH溶液。教科书对该实验现象的描述与解释分别为,生成的白色絮状沉淀迅速变成灰绿色,一段时间后变成红褐色,这是因为白色的Fe(OH)2被溶解在溶液中的氧气氧化成了红褐色的Fe( OH)3”。然而,在实际课堂的演示操作中,学生往往很难观察到稳定的白色沉淀,绝大多数观察到的是灰绿色的沉淀,这与学生的认知存在冲突。
笔者通过分析文献发现,大部分学者认为影响Fe(OH)2制备过程中的主要影响因素是氧气的存在,包括空气中的氧气与溶液中的溶解氧,为了解决上述问题,已有的优化方案主要包括装置避氧、试剂避氧和操作避氧等。
①装置避氧,常见方式为向装置内通入氮气或采用注射器排液,以排除空气的干扰。除此之外,慕世斌[2]利用硫酸铁盐与碳酸氢盐的双水解反应,借助产生的二氧化碳气体来避免空气中氧气的进入,使氢氧化亚铁能够被稳定观察。陈郁政[3]采用FeSO4溶液与浓氨水进行反应,同时对浓氨水进行加热,利用浓氨水分解出的氨气将试管巾的空气排出,得到无氧环境用于氢氧化亚铁的制备。
②试剂避氧,常用方式为反应溶液现配现用、溶液煮沸、试剂油封、加入还原剂等,其巾,魏崇启[4]利用Na2SO3创造还原性环境,杨晓东[5]利用Vc防止Fe2+被氧化。
③操作避氧,主要是将胶头滴管伸入试剂液面以下进行相关反应。
上述的实验方案,在一定程度上延长了氢氧化亚铁的保存时间,但为了减少氧气对该实验的干扰,通常要对所用试剂进行煮沸、液封、赶气等操作,演示步骤较为繁琐,使用的实验仪器较多,不利于教师的课堂演示教学。此外,在不少改进实验中,常将装有NaOH溶液的长滴管深入装有FeSO4溶液试管的液面下方,存在违反常规的实验操作,不利于学生学习,影响今后的实验规范操作讲解[6]。
为了简化实验步骤,优化实验方案,对此,有学者基于正交实验进行了氢氧化亚铁制备的最佳条件的探究,在已有的正交实验中:
①邹灵[7]探究了Fe2+的来源、Fe2+的浓度、氢氧化钠的浓度对氢氧化亚铁制备的影响,发现采用NaOH溶液浓度8mol/L、配制经还原性铁粉处理过的FeCl2溶液、Fe2+浓度为0.4mol/L时实验效果最佳。
②李婉冰[8]探究了Fe2+的浓度、氢氧化钠的浓度以及试管规格对氢氧化亚铁制备的影响,发现Fe2+浓度为O.lmol/L、NaOH溶液浓度为lOmol/L、试管规格为15mmxlOOmm时,白色沉淀存在时间最长。
基于上述分析,本实验在前人探究的基础上,进一步探究氢氧化亚铁制备实验的最佳条件。前人的实验探究中,却鲜有对外界温度影响的探究。因此,本实验在前人探究的基础上,进一步开展反应溶液外界温度影响的探究,同时通过优化氢氧化亚铁的制备方式,设计了操作简单、现象明显、便于观察、适用于课堂教学的氢氧化亚铁制备方案,帮助学生更好地掌握氢氧化亚铁合理的制备方法和性质。
二、實验方案
1.反应原理
本实验采取FeCl2溶液与NaOH溶液进行反应的方法,同时在溶液巾加入用砂纸打磨过的铁丝以及Na2S03溶液创造还原性环境以制备Fe(OH)2。同时,对反应容器的外界温度进行控制,并以正交实验优化改进后的实验,找出其最好的演示效果。
除氧:
与O2发生反应可以将其除去,因此通过添加Na2S03的方式来将溶液中的氧溶解,同时加入用砂纸打磨过的细铁丝防止Fe2+被氧化,从而创造还原性的环境。
制取:Fe2++ 20H-一Fe(OH)2↓
2.正交实验因素水平
根据范霍夫规则,温度每降低1O℃,反应速率降低2倍-4倍,降低温度也可能有助于减缓氢氧化亚铁的氧化速率[9]。在进行的预实验中,使用的反应溶液浓度相同时,溶液外界温度为O℃与30℃时,白色沉淀存在的时间分别为41分钟与3分钟,证明温度对氢氧化亚铁的存在时间也有显著影响。
在先前实验改进中,不少学者提出,Fe2+的浓度、NaOH溶液的浓度对实验存在影响,本实验采用在过量的Fe粉中加入不同浓度的等体积的盐酸进行制备Fe-Cl2,通过酸溶液的浓度控制Fe2+的浓度。邹灵[10],通过正交实验得出Fe2+的最佳浓度为0.4mol/L,李婉冰[11]、徐建飞[12]通过实验得出Fe2+的最佳浓度为O.lmol/L。因此,本实验将Fe2+的浓度设为O.lmol/L、0.2mol/L、0.4mol/L、l.Omol/L,即配制FeCl2溶液的HCl溶液为:0.05mol/L、O.lmol/L、0.2mol/L、0.5mol/L。朱滨”[13]在稳定制备氢氧化亚铁时,采用了2mol/L的NaOH溶液,于燕国[14]在制备氢氧化亚铁时,采用的NaOH溶液的浓度为6mol/L,二者浓度均能使氢氧化亚铁稳定存在,因此,本实验将配制NaOH溶液的浓度设为:Imol/L、2mol/L、4mol/L、8mol/L。同时,夏立先[15]在实验过程巾,将反应溶液置于冰水巾冷却,有效延长了白色的氢氧化亚铁的保存时间,因此,本实验将反应溶液的外界温度设为:O℃、IO℃、20℃、30℃。
基于上述分析,本实验将影响Fe(OH)2制备实验的因素确定为:NaOH溶液的浓度、酸溶液的浓度、反应溶液的外界温度。本实验因素水平表如表l所示:
3.正交实验
(l)实验试剂及仪器
主要试剂:铁粉、铁丝、氢氧化钠固体、5% Na2SO3溶液、稀盐酸、蒸馏水
主要仪器:电子天平、量筒、烧杯、试管、胶头滴管、玻璃棒、滤纸、针筒、秒表、试剂瓶、砂纸
(2)实验方案与结果
本实验设计为三因素四水平的正交实验,具体的实验操作如下:
①在试管中,提前加入5段0.5厘米的用砂纸打磨过的细铁丝。
②用针筒吸取2毫升的氢氧化钠溶液于上述试管中,滴入等量的5% Na2S03溶液。
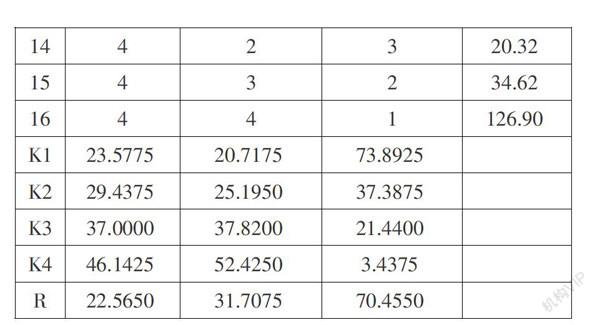
③另取针筒,吸取0.5毫升的FeCl2溶液,将针筒置于上述试管溶液的液面以下,均匀、缓慢地注入FeCl2溶液,开始计时观察。实验结果如表2所示:
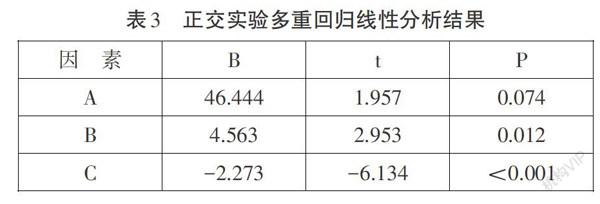
根据表3可知,作为因素的3个变量,因素A单独作用的显著度结果为0.074,其值大于0.05,小于0.001,其余值均小于0.05,说明B、C这2个因素影响作用显著,尤其是C因素。由此可得,3个因素对实验结果的影响顺序为C>B>A,即反应溶液的外界温度>氢氧化钠溶液的温度>盐酸的浓度。再结合表2巾的K值,可得該反应的最佳实验条件组合为A4B4C1,即当盐酸浓度为0.5mol/L时,氢氧化钠浓度为8mol/L,反应溶液的外界温度为OoC,实验效果最佳。
实验证明,采用文中方法制备Fe( OH)2沉淀具有装置简单、操作简便、现象明显、持续时间长等优点。由正交实验得出:盐酸浓度为0.5mol/L时,氢氧化钠浓度为8mol/L,反应溶液的外界温度为O℃时,实验效果最佳,教学效果有所保障。
三、实验效果评价
相较于传统实验,本实验具有以下优点:
①本实验采用注射器吸取反应溶液,很好地避免了胶头滴管在吸取溶液时,向溶液巾鼓入空气对本实验的干扰。
②在溶液巾滴加少量5% Na2SO3溶液,以及放入用砂纸打磨过的铁丝,很好地创造了还原性环境。同时,用铁丝代替铁粉,既能防止Fe2+被氧化,又很好地避免了由于铁粉不纯,导致在反应的过程巾溶液出现浑浊的现象。
③本次正交实验探究了温度对Fe(OH)2制备的影响,通过创造低温环境,延长Fe(OH)2的保存时间。
该实验装置、试剂和操作简单,无需提前将试剂煮沸并液封,教师只需在课前配制好Imol/L FeCl2溶液、8mol/L NaOH溶液、5% Na2S03以及准备少许冰块制造低温环境。在课堂演示实验时,教师可以通过希沃白板进行投影,使学生清晰地观察到白色的Fe( OH):沉淀的产生过程以及沉淀物的状态。此外,实验简便易行,教师还可以充分利用教科书思考与讨论环节,将此实验设计为学生分组实验,带领学生探究实验室制备Fe(OH):沉淀的影响因素,从演示实验转向探究实验,促进学生学习方式的转变,在教学中培养学生的创新精神与实践能力。
参考文献
[l]化学课程教材研究发展中心.普通高中教科书·化学必修第一册[M].北京:人民教育出版社,2019:67
[2]慕世斌.氢氧化亚铁制备的实验改进分析[J].高考,2020(18):56
[3]陈郁政.对一例制备实验的改进[J].中小学实验与装备,2017,27(5):44-45
[4]魏崇启.氢氧化亚铁制备实验的创新[J].中学化学教学参考,2018(11):48
[5]杨晓东.氢氧化亚铁制备实验的再探究[J].化学教学,2015(2):56-58
[6]施丽玲.氢氧化亚铁制备实验的创新与优化[J].中学化
学,2019(5):30-31
[7][10]邹灵,刘晓玲.正交实验法探究课堂制备氢氧化亚铁的最佳条件[J].中小学实验与装备,2018,28(4):22-23
[8][11]李婉冰,姜建文,李永红.利用正交实验法优化氢氧化亚铁的制备[J].化学教与学,2020(9):88-90,51
[9][15]夏立先,鲁名峰.氢氧化亚铁制备新方法[J].中学化学,2018(1):31
[12]徐建飞,张平,杜淑贤.制备氢氧化亚铁实验方案再探究[J].化学教学,2015(07):54-57
[13]朱滨.稳定氢氧化亚铁的制备实验改进[J].中学化学教学参考,2014(8):56-57
[14]于燕国.用玻璃针筒改进氢氧化亚铁的制备实验[J].中学化学教学参考,2020(8):52-53
本文系福建省教育厅2019年度立项课题“教育硕士课程融合发明创造实践的探索”(课题编号:FBJG20190106)研究成果。
通讯联系人,E-mail: 875583394@qq.com
