葛根素诱导人肝癌HepG2细胞凋亡与自噬及其分子机制研究*
2021-11-25胡亚丽杨杰庞茜茜
胡亚丽,杨杰,庞茜茜
(河北北方学院附属第一医院,张家口 075000)
肝癌是威胁中国人民生命健康的主要恶性肿瘤之一,发病率居恶性肿瘤第4位、病死率居第3位[1]。手术切除并辅以放化疗是临床治疗肝癌的首选方案,但术后5年复发率超过60%、5年生存率不足40%[2]。中医药抗肿瘤逐渐得到人们的关注与认可,葛根素(Puerarin)是从中药葛根中提取的1类具有异黄酮类化合物,包括葛根素、胡萝卜苷、β-谷甾醇等活性成分,呈白色至微黄色结晶性粉末、微溶于水,具有抗炎、抗氧化、降血压、调节血脂、抗心律失常等多种药理学作用[3]。近年来葛根素抗肿瘤活性很受关注,对胰腺癌、非小细胞肺癌、结肠癌等均具有一定的抑制作用[4]。阻滞肿瘤细胞周期进程、诱导肿瘤细胞凋亡和自噬是葛根素抗肿瘤的作用机制[5-6]。本实验以临床治疗肝癌一线化疗用药顺铂为阳性对照,设葛根素3个剂量组进行干预,研究不同剂量葛根素对人肝癌HepG2细胞凋亡、自噬的影响并探讨其可能的分子机制。
1 材料与方法
1.1 细胞 人肝癌HepG2细胞购自上海中科院细胞库。HepG2细胞接种于含10%胎牛血清和双抗(100 U/mL链霉素-青霉素)的DMEM培养基,置细胞培养箱(37℃、5%CO2)中进行培养,细胞贴壁生长,细胞汇合度约80%时进行传代。取第3代对数生长期HepG2细胞开展实验研究,设空白组、葛根素(50、100、200 μg/mL)组和顺铂 20 μg/mL 组[7-8]。
1.2 药物与试剂 葛根素购自上海源叶生物科技有限公司(纯度≥99%,批号:B21028);注射用顺铂购自齐鲁制药有限公司(国药准字H37021357,规格 20 mg/支,批号:1905016);DMEM 培养基、二甲基亚砜(DMSO)、胰酶、胎牛血清购自上海源叶生物科技有限公司;CCK-8试剂盒购自北京索莱宝科技有限公司;Annexin V-FITC/PI凋亡试剂盒、BCA蛋白浓度测定试剂盒、山羊抗兔IgG二抗购自上海碧云天生物技术研究所;兔抗人蛋白激酶B(Akt)、磷酸化Akt(p-Akt)、激活型半胱氨酸蛋白酶(Cleaved Caspase-3)、B 淋巴细胞瘤-2(Bcl-2)、Bcl-2 相关 X蛋白(Bax)、磷酸化哺乳动物雷帕霉素靶蛋白(pmTOR)、酵母 ATG6 同源物(Beclin1)、微管相关蛋白1轻链3(LC3)抗体购自北京中杉金桥生物技术有限公司;二氨基联苯胺(DAB)显色试剂盒购自杭州四季青生物工程材料有限公司。
1.3 主要仪器 BB15型细胞培养箱(德国Heraeus公司);LB940型酶标仪(德国Berthold公司);SE300型电泳仪、TE22型转膜仪(美国Hoefer公司);FACSAria型流式细胞仪(美国BD公司);BX53型荧光显微镜(日本Olympus公司)。
1.4 细胞增殖抑制率检测 取对数生长期HepG2细胞,消化、重悬并计数后调整细胞浓度为1×105个/mL,100 μL/孔接种于96孔培养板,培养24 h后更换培养液,并以 DMSO(空白组)和终浓度(50、100、200 μg/mL)葛根素、20 μg/mL 顺铂进行干预,每组设10个复孔,继续培养48 h后每孔10 μL加入CCK-8溶液,放回培养箱继续培养2 h后通过酶标仪检测450nm处吸光度值(A),细胞增殖抑制率(%)=(1-A药物组/A空白组)×100%
1.5 细胞凋亡水平检测 取浓度1×105个/mL的HepG2细胞悬液,500 μL/孔接种于6孔细胞培养板,培养24 h后更换培养液,分组并分别以相应浓度药物进行干预,每组设10个复孔,继续培养48 h后通过不含乙二胺四乙酸(EDTA)的胰酶消化、离心(2 000 r/min,离心半径 8 cm,5 min)收集细胞,经磷酸盐缓冲液(PBS)洗涤后,按照Annexin V-FITC/PI试剂盒操作说明依次处理,通过流式细胞仪分析细胞凋亡水平。
1.6 细胞自噬溶酶体水平检测 取浓度1×105个/mL的HepG2细胞悬液,200 μL/孔接种于24孔板,培养24 h后更换培养液,分组并分别以相应浓度药物进行干预,每组设10个复孔,继续培养48 h后弃培养液、PBS洗涤3次,500 μL/孔滴加吖啶橙溶液(1 mg/L)避光孵育15 min,PBS洗涤3次后通过荧光显微镜观察(自噬溶酶体呈红色荧光)。
1.7 细胞蛋白表达检测 取对数生长期HepG2细胞,消化、重悬并计数后调整细胞浓度为1×106个/mL,每孔1 mL接种于60 mm培养皿,放回细胞培养箱继续培养24 h后更换培养液,分组并分别以相应浓度药物进行干预,每组设10个皿,继续培养48 h后消化、离心(2 000 r/min,离心半径 8 cm,5 min)收集细胞,冰上裂解30 min,低温4℃离心(12 000 r/min,离心半径8 cm,15 min)取上清液,BCA法检测总蛋白浓度、95℃水浴10 min蛋白变性,取总蛋白30 μg行十二烷基硫酸钠聚丙烯酰胺凝胶电泳、湿转法将蛋白转移到聚偏二氟乙烯(PVDF)膜上、置5%蛋白免疫印迹封闭液室温封闭2 h,滴加Akt、p-Akt、Cleaved Caspase-3、Bcl-2、Bax、p-mTOR、Beclin1、LC3、β-actin抗体4℃孵育过夜,洗膜后滴加二抗室温孵育1 h,洗膜后滴加DAB显色,应用ImageJ软件进行分析,以β-actin为内参半定量目标蛋白相对表达量。
1.8 统计学处理 采用GraphPad prism 6软件进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法检测,P<0.05为差异有统计学意义。
2 结果
2.1 各组HepG2细胞增殖抑制率比较 与空白组比较,葛根素 50、100、200 μg/mL 组和顺铂 20 μg/mL组HepG2细胞增殖抑制率显著升高(P<0.01);与顺铂20 μg/mL组比较,葛根素200 μg/mL组细胞增殖抑制率升高(P<0.05)。见表1。
2.2 各组HepG2细胞凋亡水平比较 与空白组比较,葛根素 50、100、200 μg/mL 组和顺铂 20 μg/mL组HepG2细胞凋亡数量明显增多,凋亡率显著升高(P<0.01);与顺铂20μg/mL组比较,葛根素200μg/mL组HepG2细胞凋亡率升高(P<0.05)。见图1、表1。
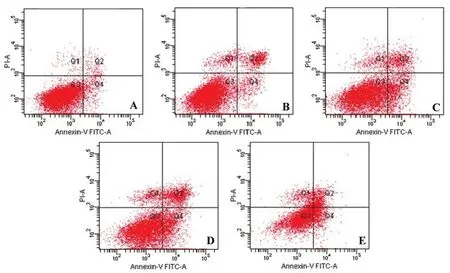
图1 各组HepG2细胞凋亡水平比较Fig.1 Comparison of apoptosis levels of HepG2 cells in each group
表1 各组HepG2细胞增殖抑制率和凋亡率比较(±s)Tab.1 Comparison of proliferation inhibition rate and apoptosis rate of HepG2 cells in each group(±s)
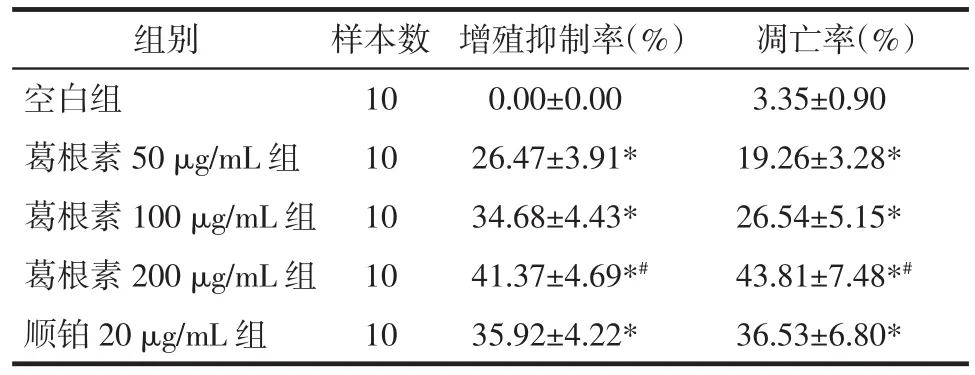
表1 各组HepG2细胞增殖抑制率和凋亡率比较(±s)Tab.1 Comparison of proliferation inhibition rate and apoptosis rate of HepG2 cells in each group(±s)
注:与空白组比较,*P<0.01;与顺铂 20 μg/mL 组比较,#P<0.05。
组别 样本数 增殖抑制率(%) 凋亡率(%)空白组 10 0.00±0.00 3.35±0.90葛根素 50 μg/mL 组 10 26.47±3.91* 19.26±3.28*葛根素100 μg/mL组 10 34.68±4.43* 26.54±5.15*葛根素200 μg/mL组 10 41.37±4.69*# 43.81±7.48*#顺铂 20 μg/mL 组 10 35.92±4.22* 36.53±6.80*
2.3 各组HepG2细胞自噬水平比较 与空白组比较,葛根素 50、100、200 μg/mL 组和顺铂 20 μg/mL组自噬溶酶体(亮红色荧光)呈不同程度增多,葛根素作用呈现一定剂量依赖性,葛根素200 μg/mL组自噬溶酶体数量明显多于其他组,提示葛根素具有诱导HepG2细胞自噬的作用。见图2。
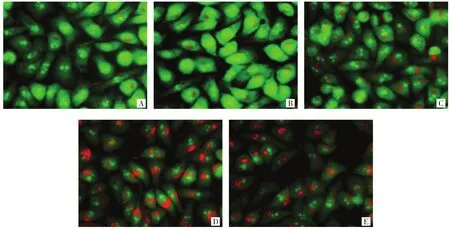
图2 各组HepG2细胞自噬水平比较(吖啶橙染色,×200倍)Fig.2 Comparison of autophagy levels of HepG2 cells in each group(acridine orange staining,×200)
2.4 各组HepG2细胞Akt、p-Akt、p-mTOR表达及Akt磷酸化(p-Akt/Akt比值)比较 与空白组比较,葛根素 100、200 μg/mL 组和顺 铂 20 μg/mL 组HepG2 细胞 p-Akt、p-mTOR 表达明显下调(P<0.01),Akt表达差异无统计学意义(P>0.05),Akt磷酸化明显降低(P<0.01);与顺铂 20 μg/mL 组比较,葛根素200 μg/mL 组 p-Akt、p-mTOR 表达下调(P<0.05 或P<0.01),Akt磷酸化降低(P<0.01)。见图 3、表 2。
表2 各组HepG2细胞Akt、p-Akt、p-mTOR表达及Akt磷酸化比较(±s)Tab.2 Comparison of Akt,p-Akt,p-mTOR expression and Akt phosphorylation of HepG2 cells in each group(±s)
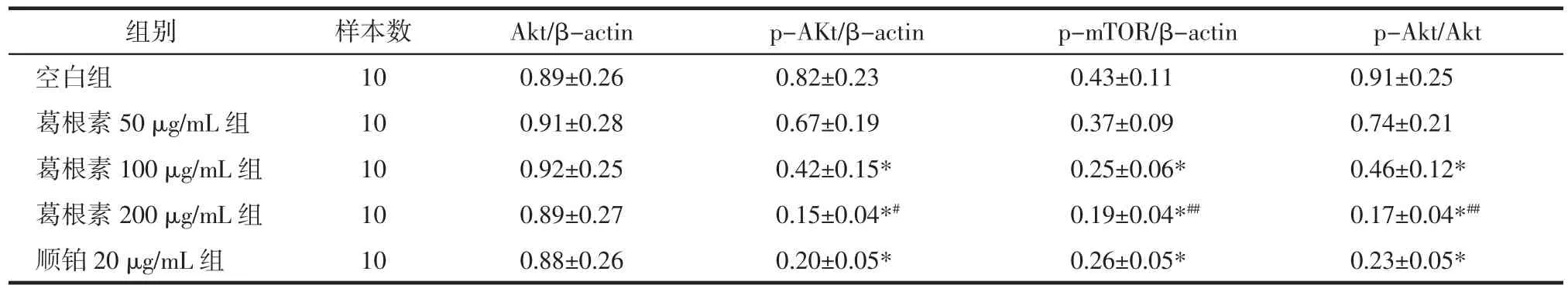
表2 各组HepG2细胞Akt、p-Akt、p-mTOR表达及Akt磷酸化比较(±s)Tab.2 Comparison of Akt,p-Akt,p-mTOR expression and Akt phosphorylation of HepG2 cells in each group(±s)
注:与空白组比较,*P<0.01;与顺铂 20 μg/mL 组比较,#P<0.05,##P<0.01。
组别 样本数 Akt/β-actin p-AKt/β-actin p-mTOR/β-actin p-Akt/Akt空白组 10 0.89±0.26 0.82±0.23 0.43±0.11 0.91±0.25葛根素 50 μg/mL 组 10 0.91±0.28 0.67±0.19 0.37±0.09 0.74±0.21葛根素 100 μg/mL 组 10 0.92±0.25 0.42±0.15* 0.25±0.06* 0.46±0.12*葛根素 200 μg/mL 组 10 0.89±0.27 0.15±0.04*# 0.19±0.04*## 0.17±0.04*##顺铂 20 μg/mL 组 10 0.88±0.26 0.20±0.05* 0.26±0.05* 0.23±0.05*
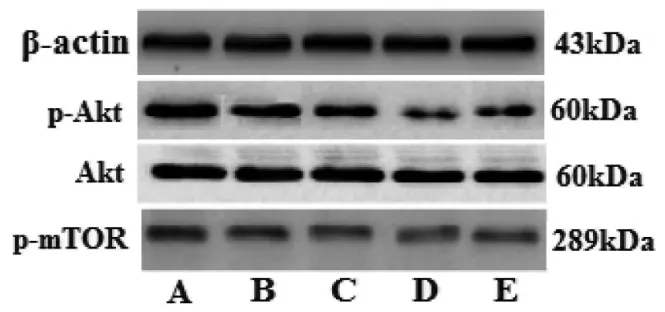
图3 各组HepG2细胞Akt、p-Akt、p-mTOR表达比较Fig.3 Comparison of Akt,p-Akt,p-mTOR expression of HepG2 cells in each group
2.5 各组 HepG2细胞 Cleaved Caspase-3、Bcl-2、Bax、Beclin1、LC3 表达及 Bax/Bcl-2、LC3-Ⅱ/LC3-Ⅰ比值比较 与空白组比较,葛根素100、200 μg/mL组和顺铂20 μg/mL组HepG2细胞Cleaved Caspase-3、Bax、Beclin1、LC3-Ⅰ、LC3-Ⅱ表达明显上调而 Bcl-2表达下调(P<0.01),Bax/Bcl-2、LC3-Ⅱ/LC3-Ⅰ比值显著升高(P<0.01);与顺铂 20 μg/mL 组比较,葛根素 200 μg/mL 组 Cleaved Caspase-3、Bax、Beclin1、LC3-Ⅱ上调(P<0.05 或 P<0.01),两组间 Bcl-2 表达差异无统计学意义 (P>0.05),Bax/Bcl-2、LC3-Ⅱ/LC3-Ⅰ比值升高(P<0.05 或 P<0.01)。见图 4、表 3和表4。
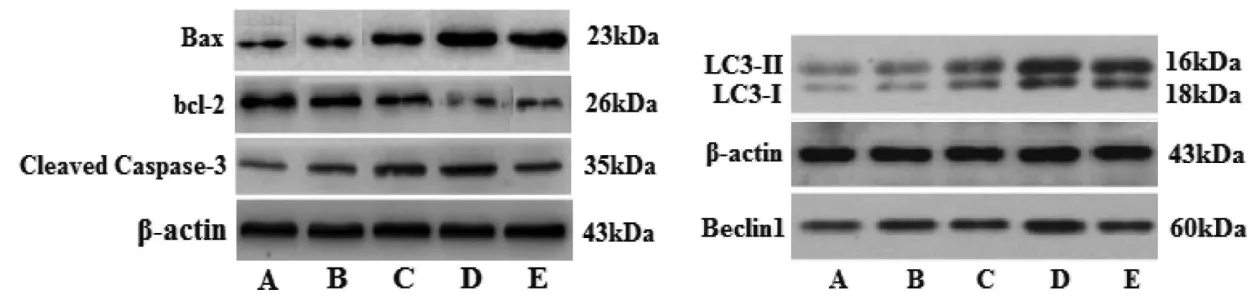
图4 各组HepG2细胞Cleaved Caspase-3、bcl-2、Bax、Beclin1、LC3表达比较Fig.4 Comparison of Cleaved Caspase-3,bcl-2,Bax,Beclin1,LC3 expression of HepG2 cells in each group
表3 各组HepG2细胞Cleaved Caspase-3、Bcl-2、Bax表达及Bax/Bcl-2比值比较(±s)Tab.3 Comparison of Cleaved Caspase-3,Bcl-2,Bax expression and the ratio of Bax/Bcl-2 of HepG2 cells in each group(±s)

表3 各组HepG2细胞Cleaved Caspase-3、Bcl-2、Bax表达及Bax/Bcl-2比值比较(±s)Tab.3 Comparison of Cleaved Caspase-3,Bcl-2,Bax expression and the ratio of Bax/Bcl-2 of HepG2 cells in each group(±s)
注:与空白组比较,*P<0.05,**P<0.01;与顺铂 20 μg/mL 组比较,#P<0.05,##P<0.01。
组别 样本数 Cleaved Caspase-3/β-actin bcl-2/β-actin Bax/β-actin Bax/bcl-2空白组 10 0.09±0.03 0.95±0.21 0.14±0.05 0.15±0.06葛根素 50 μg/mL 组 10 0.12±0.03* 0.84±0.18 0.18±0.06 0.21±0.07葛根素 100 μg/mL 组 10 0.28±0.07** 0.67±0.13** 0.47±0.09** 0.72±0.14**葛根素 200 μg/mL 组 10 0.41±0.13**## 0.14±0.05** 1.14±0.27**# 8.13±1.95**##顺铂 20 μg/mL 组 10 0.19±0.06** 0.16±0.06** 0.86±0.21** 5.38±1.20**
表4 各组HepG2细胞Beclin1、LC3-Ⅰ、LC3-Ⅱ表达及LC3-II/LC3-I比值比较(±s)Tab.4 Comparison of Beclin1,LC3-Ⅰ,LC3-Ⅱ expression and the ratio of LC3-II/LC3-I of HepG2 cells in each group(±s)
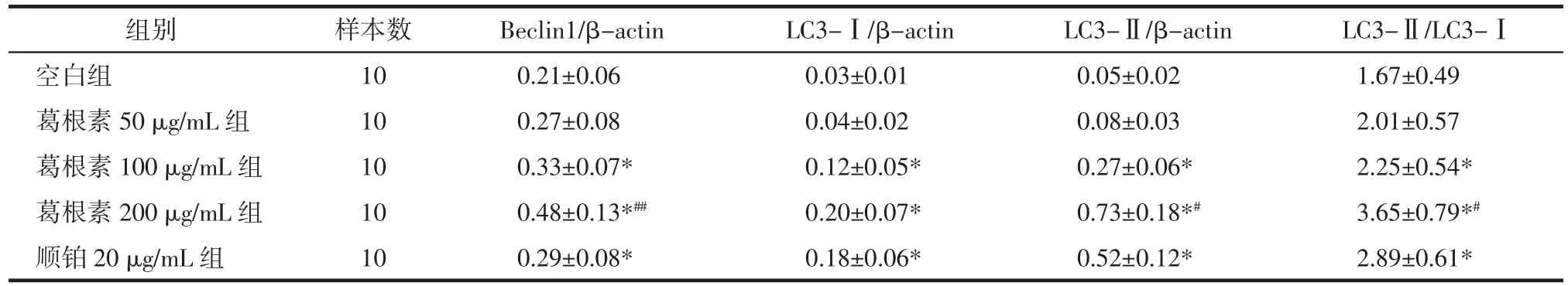
表4 各组HepG2细胞Beclin1、LC3-Ⅰ、LC3-Ⅱ表达及LC3-II/LC3-I比值比较(±s)Tab.4 Comparison of Beclin1,LC3-Ⅰ,LC3-Ⅱ expression and the ratio of LC3-II/LC3-I of HepG2 cells in each group(±s)
注:与空白组比较,*P<0.01;与顺铂 20 μg/mL 组比较,#P<0.05,##P<0.01。
组别 样本数 Beclin1/β-actin LC3-Ⅰ/β-actin LC3-Ⅱ/β-actin LC3-Ⅱ/LC3-Ⅰ空白组 10 0.21±0.06 0.03±0.01 0.05±0.02 1.67±0.49葛根素 50 μg/mL 组 10 0.27±0.08 0.04±0.02 0.08±0.03 2.01±0.57葛根素 100 μg/mL 组 10 0.33±0.07* 0.12±0.05* 0.27±0.06* 2.25±0.54*葛根素 200 μg/mL 组 10 0.48±0.13*## 0.20±0.07* 0.73±0.18*# 3.65±0.79*#顺铂 20 μg/mL 组 10 0.29±0.08* 0.18±0.06* 0.52±0.12* 2.89±0.61*
3 讨论
肝癌是世界范围内常见恶性肿瘤之一,每年新发病例超过100万,其中40%以上的患者分布在中国,中国肝癌发病率居恶性肿瘤第四位、病死率居第3位[9]。虽然近年来人民生活条件明显改善、乙型肝炎疫苗得到普及,但肝癌发病率并未出现下降趋势。因此,寻找新型高效的抗肝癌药物仍是目前医药工作者的研究热点。
肝癌在中医属“癥瘕”“臌胀”“黄疸”等范畴,中药葛根以豆科植物野葛的干燥根入药,收入《中国药典》,是长期应用于临床的中药品种,葛根素是提取自葛根的一种异黄酮类化合物,目前临床上主要用于缺血性心脑血管疾病的治疗,近年来葛根素抗肿瘤活性得到广泛关注。本实验研究发现,经葛根素干预能够明显提高人肝癌HepG2细胞增殖抑制率和凋亡率,诱导自噬溶酶体生成;葛根素200μg/mL组效果优于顺铂20 μg/mL组,提示葛根素具有诱导HepG2细胞凋亡和自噬的药理学作用。
凋亡和自噬是细胞程序性自主死亡的两种主要途径,均由多种基因调控[10]。线粒体介导的内源性凋亡途径由Bcl-2家族、Caspase家族蛋白等参与调控[11]。肿瘤发病过程中,由于肿瘤细胞过度增殖但新生血管相对缺乏而局部缺氧,引发氧化应激、炎症反应、Ca2+超载等而病理性刺激Bcl-2家族蛋白Bax上调表达并移位到线粒体膜、导致膜通透性改变,细胞色素C(Cyt C)释放,从而启动细胞凋亡。Cyt C是Caspase家族蛋白的主要激活因子,其中Cleaved Caspase-3将通过剪切细胞结构蛋白等而诱导细胞凋亡,是细胞凋亡最重要的执行者;Bcl-2蛋白位于线粒体膜,能够与Bax形成异源二聚体而抑制Bax促凋亡活性,保护线粒体膜通透性,表现出抑凋亡活性[12]。LC3蛋白位于于自噬溶酶体膜,能够与线粒体受体蛋白结合而诱导期降解,因此LC3可作为细胞自噬活性的标志蛋白[13]。LC3以LC3-Ⅰ和LC3-Ⅱ两种亚型存在,LC3-Ⅱ具有自噬活性,当细胞自噬发生时无活性的LC3-Ⅰ将转化为LC3-Ⅱ,因此LC3-Ⅱ/LC3-Ⅰ比值能够反映细胞自噬水平[14]。本研究发现,经葛根素干预能够明显上调人肝癌HepG2细胞 Cleaved Caspase-3、Bax、LC3-I、LC3-Ⅱ表达并下调Bcl-2表达,提高Bax/Bcl-2、LC3-Ⅱ/LC3-Ⅰ比值,并且葛根素200 μg/mL组对上述蛋白表达的调节作用优于顺铂20 μg/mL组。
Akt是一种原癌基因,被磷酸化(p-Akt)激活后能够诱导Caspase家族蛋白磷酸化而失活,抑制Bax表达与转移[15]。mTOR为Akt下游基因,能够被p-Akt诱导mTOR磷酸化(p-mTOR)而激活,进而诱导细胞周期素上调表达而促进细胞增殖、清除泛素蛋白而抑制细胞自噬[16]。此外,p-mTOR能够诱导下游自噬特征蛋白Beclin1磷酸化而失活,Beclin1是介导LC3等自噬蛋白位移至自噬体的关键因子,从而间接促进细胞自噬[17]。本研究发现,经葛根素干预能够明显下调p-Akt、p-mTOR表达并抑制Akt磷酸化,上调Beclin1表达,并且葛根素200 μg/mL组对p-Akt、p-mTOR、Beclin1表达及 Akt磷酸化的调控作用优于顺铂20 μg/mL组,提示葛根素对HepG2细胞凋亡、自噬的调控作用可能与抑制Akt/mTOR/Beclin1通路有关。
综上所述,葛根素具有诱导人肝癌HepG2细胞凋亡与自噬的药理学作用,抑制Akt/mTOR/Beclin1通路进而诱导促凋亡、促自噬相关蛋白表达与活化可能是其重要的分子机制。本研究为体外细胞实验,结果提示葛根素具有较良好的抗肝癌细胞活性,但肝癌的发生发展具有复杂的病理机制,受多种因素影响,因此葛根素抗肝癌作用及相关机制仍需体内实验进一步研究。
