冷藏充二氧化碳对切花菊的影响
2021-11-25章康艺楼恬恬邬雨津寿建昕俞明操
章康艺,余 莎,楼恬恬,邬雨津,寿建昕,俞明操
(1.绍兴文理学院生命科学学院,浙江绍兴 312000;2.浙江丰岛股份有限公司,浙江新昌 312500)
菊花(Dendranthemuma morifolium)是我国十大传统名花和世界四大切花之一,在花卉生产、园林绿化和美化环境中占有十分重要的地位。我国是栽培菊花的起源中心和菊属种质资源的分布中心,菊属有40 余种,在我国分布的就有20 余种,栽培品种达3 000 余个[1]。鲜切花生产是花卉产业中附加值最高的一个分支,正以前所未有的速度蓬勃发展。中国是世界鲜切花的最大生产国,鲜切花产销量占全球切花总量的30%以上。我国菊花的产量和规模正在逐年扩大,产销量占全球鲜切菊花总量的18%以上,在国内鲜切花中,菊花约占总产量的30%。切花采后的数量损失,发达国家为5%~25%,发展中国家为20%~50%[4]。世界发达国家的切花生产商都通过栽培及采后保鲜控制技术,满足消费者对切花观赏性和延长瓶插寿命的要求,但同国外相比,由于对菊花的采收前和采后生理研究不够,保鲜技术水平仍有较大差距,导致我国菊花切花在采后和流通中的损失高达20%左右[5],造成资源浪费、环境污染和经济损失。切花菊采摘后,合成物质减少,分解加速,逐渐失水萎蔫走向衰老,并且伴随着复杂的生理生化变化。通过切花采摘并包装后充入不同体积的二氧化碳,对切花菊水分、代谢相关酶和产物等生物学特征进行研究,并且测试保存后切花菊的瓶插时间,以期为切花菊采后存储运输条件提供参考。
1 材料与方法
1.1 二氧化碳充气保存法
在4℃下向长40~50 cm、PVC 高阻隔材料制成的包装袋中,充入2 个大气压的二氧化碳若干体积,每个包装袋中放入10 支鲜切花,为了和生产方便程度对应,项目组采用计时充气法,设定0 min 为对照,实验组采用0.5、2.0、5.0 min。
1.2 叶相对含水量测定
取新鲜叶片称重W1,放入烘箱内杀青0.5 h 后80℃烘至恒重,称重W2。相对含水量计算公式:相对含水量=[(W1-W2)/W1]×100%,每测定重复3 次。
1.3 可溶性糖含量的测定
采用蒽酮比色法。取叶片擦净表面污物,剪碎混合,称取0.25 g,共3 份,分别放入3 支刻度试管中,加入5 mL蒸馏水,薄膜封口,于沸水中提取30 min(提取2 次),提取液过滤入25 mL 容量瓶中,用蒸馏水反复漂洗试管及残渣并定容至25 mL。吸取样品提取液0.5 mL 于20 mL刻度试管中,加蒸馏水1.5 mL,然后按顺序向试管中加入0.5 mL 2%的蒽酮乙酸乙酯和5 mL 浓硫酸,放入沸水中保温1 min,自然冷却至室温,以不加提取液的空白作对照,在630 nm 波长下测其吸光度。以蔗糖做标准曲线。
1.4 可溶性蛋白含量的测定
采用考马斯亮蓝G-250 染色法,稍有改动。称切花菊叶片0.5 g,用5 mL 蒸馏水研磨成匀浆后,3 000 r/min 离心10 min,取上清液0.1 mL 放入具塞试管中,并加入蒸馏水0.9 mL,再加入5 mL 考马斯亮蓝G-250 溶液,充分混合,放置2 min 后在595 nm 下比色,测定吸光度,并通过以牛血清蛋白所作标准曲线求值。
V样品中蛋白质的含量=[C×VT/VS×WF×1 000](mg/g)
式中:C 为查标准曲线值(μg);VT为提取液总体积(mL);VS为测定时的加样量(mL);WF为样品鲜重(g)。
1.5 过氧化物酶活性测定
取10 mL 50 mmol/L(pH 7.8)的磷酸缓冲液于反应管中,加入0.076 mL 0.3%液体愈创木酚,0.112 mL 30%的H2O2,0.1 mL 叶片粗酶液,立即摇匀,然后测定470 mn 处的吸光值,3 min 内每隔30 s 记录1 次,共计6 次。以1 min内A470 变化0.01 为一个酶活性单位(U)。
1.6 超氧化物歧化酶活性测定
SOD 反应体系为3 mL:50 mmol/L 的磷酸缓冲液(PBS)(pH 7.8)1.7 mL,130 mmol/L 甲硫氨酸溶液0.3 mL,750 μmol/L氮蓝四唑溶液0.3 mL,l mmol/L EDTA-Na2溶液0.3 mL,20 μmol/L 核黄素溶液0.3 mL,酶液0.1 mL。同时做2 支对照管,取3 mL 反应混合液加入0.1 mL PBS,其中一支管照光后,作为光最大还原管,另一支置于黑暗中,测定时用于调零。各管置于270 μmol/m2·s 日光灯25℃下照光反应20 min,反应结束后,分别测定各管在560 nm 处的吸光值。
1.7 丙二醛(MDA)含量测定
称取切花叶0.5 g,加入5 ml 5%的三氯乙酸(TCA),充分研磨,将匀浆转入10 mL 的离心管中,在转速3 000 r/min下离心10 min,取上清液2 mL(上清液为样品提取液),加入2 mL 0.67%硫代巴比妥酸(TBA),在100℃沸水浴中煮沸30 min,冷却(冰浴)后再离心1 次,分别测定上清液在450、532、600 nm 波长下的吸光度,(以2 mL 蒸馏水加2 mL 0.67% TBA 的混合液作为对照测定进行比色)。
MDA 浓度(μmol/L)= 6.45(D532-D600)-0.56D450
MDA 浓度(μmol/g)= MDA 浓度(μmol/L)×提取液体积(5 mL)/植物组织鲜重(g)
1.8 切花瓶插检验
采用自来水瓶插检验,每种存储条件下10 支1 组,重复3 组,观察瓶插衰败情况。
2 结果与分析
2.1 叶相对含水量
对包装后的箱装切花菊分别进行0、0.5、2.0、5.0 min的二氧化碳充气,保存至4℃培养箱中,隔天取样测定,保存14 d。从图1 可以看出,前4 d 4 个保存组相对含水量无显著性差异,第6 天充入0.5 min 的组相对含水量开始上升,显著高于其他组别,充入5 min 组相对含水量开始显著减少于其他组别。由于保存至第10 天,充入5.0 min的实验组出现比较严重的腐烂,导致该组后续数据无法测得,3 个平行组均出现此现象,说明大量充入二氧化碳,切花菊进入了无氧呼吸,产生了大量的乙醇,切花菊正常的采后生理被破坏。但充入0.5 min 的组直至14 d,相对含水量都要多于对照组,说明少量充入二氧化碳,对切花菊保持活性是有利的。
2.2 可溶性糖含量
将采后的切花菊按上述方法装箱后,进行0、0.5、2.0、5.0 min 的二氧化碳充气,保存至4℃培养箱中,隔天取样测定其可溶性糖的含量,分析在4℃下,充不同量二氧化碳对保存切花菊可溶性糖的影响。从图2 可以看出,第4天0、0.5、2.0 min 3 个保存组间切花菊可溶性糖含量无显著性差异,但充5.0 min 组可溶性糖含量显著高于其他3组。但5.0 min 组在4 d 后可溶性糖含量出现急剧降低,第8 天降至25 mg/g。由于保存至第10 天,充入5.0 min 的实验组出现比较严重的腐烂,导致该组后续数据无法测得,3 个平行组均出现此现象,说明大量充入二氧化碳,切花菊进入了无氧呼吸,产生了大量的乙醇,切花菊正常的采后生理被破坏。0.5 min 和2.0 min 组第6 天可溶性糖含量接近,均显著高于对照,其后至试验结束,充入0.5 min 二氧化碳组可溶性糖含量均显著高于2.0 min 组及对照,这可能是由于装箱后,切花菊转入了暗反应阶段,充入低剂量二氧化碳有助于其糖类等有机物的合成。

图2 4℃下充二氧化碳对切花菊可溶性糖含量的影响
2.3 可溶性蛋白(SP)含量
将采后的切花菊按上述方法装箱后,进行0、0.5、2.0、5.0 min 的二氧化碳充气,保存至4℃培养箱中,隔天取样测定其可溶性蛋白含量,分析在4℃下,充不同量二氧化碳对保存切花菊可溶性蛋白的影响。从图3 可以看出,充入二氧化碳后4 个组别中可溶性蛋白均呈下降趋势,但各组别间无显著性差异,但由于保存至第10 天,充入5.0 min的实验组出现比较严重的腐烂,导致该组后续数据无法测得,3 个平行组均出现此现象,说明大量充入二氧化碳,切花菊进入了无氧呼吸,产生了大量的乙醇,切花菊正常的采后生理被破坏。说明在4℃下保存切花菊,二氧化碳的浓度对可溶性蛋白的影响不太大。
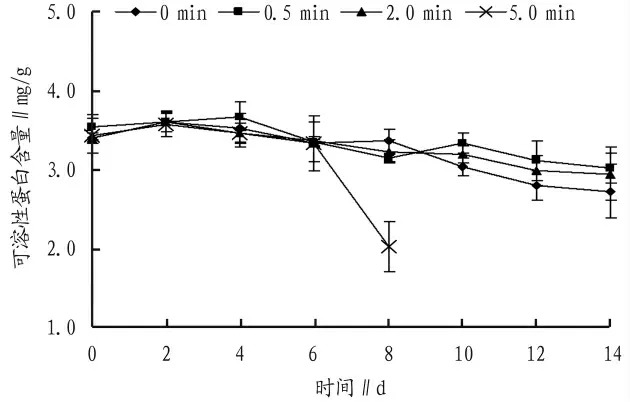
图3 4℃下充二氧化碳对切花菊可溶性蛋白含量的影响
2.4 过氧化物酶(POD)活性
采后的切花菊按上述方法装箱后,进行0、0.5、2.0、5.0 min 的二氧化碳充气,保存至4℃培养箱中,隔天取样测定其过氧化物酶活性,分析在4℃下,充不同量二氧化碳对保存切花菊过氧化物酶活性的影响。从图4 可以看出,4 个组别的切花菊中过氧化物酶活性在前4 d 均出现上升趋势,其中5.0 min 组的上升最为明显,极显著高于其他3 组,达到143.94 U/mg·FW,其后5.0 min 组过氧化物酶活性出现下降直至测定第8 天,由于保存至第10 天,充入5.0 min 的实验组出现比较严重的腐烂,导致该组后续数据无法测得。对照组在第6 天后出现逐渐下降趋势。0.5 min 组第10 天出现上升,至170.76 U/mg·FW,其后出现降低,但过氧化物酶活性0.5 min 组极显著高于其他组别。
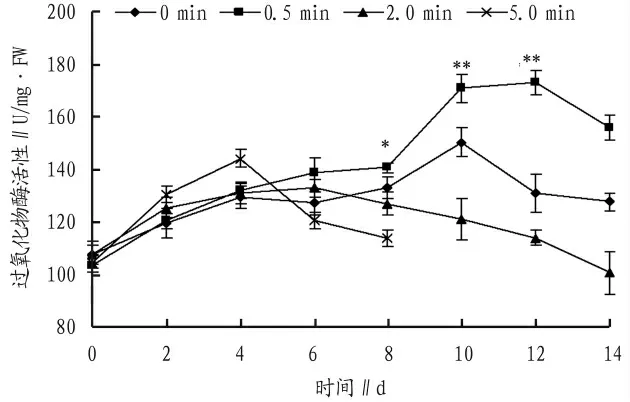
图4 4℃下充二氧化碳对切花菊过氧化物酶活性的影响
2.5 超氧化物歧化酶(SOD)活性
将采后的切花菊按上述方法装箱后,进行0、0.5、2.0、5.0 min 的二氧化碳充气,保存至4℃培养箱中,隔天取样测定其超氧化物歧化酶活性,分析在4℃下,充不同量二氧化碳对保存切花菊超氧化物歧化酶活性的影响。从图5可以看出,前6 d 4 个组别超氧化物歧化酶活性均上升,其中5.0 min 组第6 天后出现迅速下降,由于保存至第10天,充入5.0 min 的实验组出现比较严重的腐烂,导致该组后续数据无法测得。对照组和2.0 min 组第10 天后出现下降,但是2.0 min 组的SOD 酶活性高于对照组,0.5 min组除第14 天出现下降外,其他测试值均较前次增加,第12天出现最高值,达35.02 U/mg·FW。

图5 4℃下充二氧化碳对切花菊超氧化物歧化酶活性的影响
2.6 丙二醛(MDA)含量
将采后的切花菊按上述方法装箱后,进行0、0.5、2.0、5.0 min 的二氧化碳充气,保存至4℃培养箱中,隔天取样测定其丙二醛的含量,分析在4℃下,充不同量二氧化碳对保存切花菊丙二醛含量的影响。从图6 可以看出,4 个组别的丙二醛含量均出现持续上升,其中2.0 min 组在第10 天后出现快速增加,极显著高于其他组别,到第14 天达到28.72 mol/g·FW。

图6 4℃下充二氧化碳对切花菊丙二醛含量的影响
2.7 切花菊瓶插最大花径和瓶插寿命
将经过14 d 保存后的切花菊包装打开进行纯水瓶插试验,测定切花菊瓶插后的最大花径和瓶插寿命。从表1可以看出,由于5.0 min 组在实验第10 天出现腐烂,故不能继续瓶插检验,其他3 组纯水瓶插后的试验结果表明:充二氧化碳0.5 min 与对照组在花径大小上无显著性差异,但是极显著高于2.0 min 组,花平均寿命0.5 min 组最长,达到16.49 d,极显著高于对照组,2.0 min 组极显著低于对照组,说明充入低剂量二氧化碳有利于瓶插时间的延长。叶的寿命对照组与0.5 min 组无显著差异,2.0 min组极显著低于对照。

表1 切花菊瓶插最大花径和瓶插寿命
3 结论
切花菊采摘后,合成物质减少、分解加速,逐渐失水萎蔫走向衰老,并且伴随着复杂的生理生化变化。项目组利用切花菊包装后充入不同体积的二氧化碳,测定与切花菊衰老相关的指标,来确定包装切花菊的最适二氧化碳充入量。经过测定后发现在4℃保存温度下,充入低剂量的二氧化碳,有利于切花菊的瓶插延时,但随着二氧化碳浓度增加,包装中相对氧含量降低,导致切花菊开始进行无氧呼吸,对其生理活动影响很大,当项目组在包装中充入5.0 min 二氧化碳后,出现腐烂现象。综上,切花菊采后包装完成后,应尽快移至4℃冷库冷藏,并且充入低剂量二氧化碳,能够延长瓶插时间。
